Верифікація алгоритмів тестування на ВІЛ з використанням швидких тестів
УДК 616.98:578.828+57.083.3
DOI : https://doi.org/10.61948/prevmed-2024-1-16
О. М. Кислих1, І. В. Андріанова2, О. В. Максименок1, В. А. Марциновська1,2
Верифікація алгоритмів тестування на віл з використанням швидких тестів
1. ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України»
2. ДУ «Центр громадського здоров’я МОЗ України»
Адреса для листування. Е-mail: olenakyslykh@gmail.com
Забезпечення точної, своєчасної та доступної за вартістю діагностики ВІЛ–інфекції є пріоритетним заходом, спрямованим на досягнення поставлених перед Україною глобальних цілей подолання епідемії ВІЛ, а саме: отримання результатів досліджень гарантованої якості для забезпечення 95% людей, які живуть з ВІЛ, та знання про свій статус. Своєчасне встановлення діагнозу ВІЛ-інфекції із застосуванням швидких тестів (ШТ) набуває особливого значення в умовах воєнного стану, коли доступ до обстежень із застосуванням інструментальних методів дослідження обмежений або взагалі недоступний. Для встановлення точного діагнозу вкрай важливими є стандартизована стратегія тестування та використання продукції гарантованої якості, тоді як незадовільний вибір алгоритмів тестування може призводити до помилок діагностики. У Зведеному керівництві ВООЗ з послуг тестування на ВІЛ (редакція від 2019 р.) рекомендовано єдину «стандартну» стратегію тестування на ВІЛ для всіх закладів, де проводиться таке обстеження — отримання трьох послідовних позитивних результатів серологічних аналізів на ВІЛ і спрощено схему аналізу випадків з дискордантними результатами проведених тестів. Причини хибної діагностики багатофакторні й включають в себе помилки на різних етапах діагностичного процесу, однак неправильний підбір послідовності використання в алгоритмі діагностики тестів (наприклад, низька специфічність тестів другої і/або третьої лінії) вважають основним фактором появи значної кількості хибних діагнозів. Проведення верифікації алгоритмів тестування забезпечує можливість отримання об’єктивних фактичних даних щодо ефективності певної комбінації тестів для точної діагностики ВІЛ-інфекції перед їх масштабним впровадженням. Для цього в ході верифікації перевіряють відсутність в обраної продукції однакових помилкових результатів, що можуть призвести до невірного діагнозу. Тому нагальним питанням для країни є необхідність визначити надійний національний алгоритм тестування з резервним алгоритмом для використання в якості альтернативного у випадках, коли з будь-яких причин виконання досліджень за основним алгоритмом тимчасово неможливе.
Мета роботи. На підставі оцінки специфічності визначити найкращі комбінації ШТ, спільне використання яких забезпечить отримання гарантованих результатів тестування (з найменшою чи нульовою перехресною хибною реактивністю) у межах обраних алгоритмів тестування.
Матеріали і методи. З архіву лабораторії епідеміології парентеральних вірусних гепатитів та ВІЛ-інфекції ДУ
«Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України» для формування верифікаційної панелі підбирали зразки крові пацієнтів, охарактеризованих щодо відсутності серологічних маркерів ВІЛ. Відповідно до рекомендацій фахівців ВООЗ, розмір вибірки у 250 зразків було визначено як достатній для виявлення не менше 2–8% хибнореактивних результатів при використанні ШТ та виявлення їхнього сукупного рівня хибної реактивності. Дане верифікаційне дослідження базувалося на стратегії тестування на ВІЛ із послідовним використанням трьох найменувань ШТ: перший тест повинен бути найбільш чутливим (≥99% для визначення як дійсно, так і хибнопозитивних зразків); другий та третій тести мали бути найбільш специфічними (≥98% для виявлення всіх хибнопозитивних), при цьому передбачалося використання декількох різних ШТ для взаємозамінності. Відповідно до рекомендацій експертів ВООЗ, технічних та операційних характеристик потенційних тестів-кандидатів для верифікаційного дослідження було обрано 7 найменувань ШТ (по 2 серії кожного найменування).
Усі зразки верифікаційної панелі досліджували у випадковому (рандомізованому) порядку і сліпим способом — тестували по 5 зразків сироваток на 2-х серіях усіх 7 найменуваннях ШТ протягом однієї постановки у першій половині робочого дня (зранку до обіду) у точній відповідності до інструкцій виробників із застосування. Для візуальної оцінки результатів досліджень із застосуванням ШТ була використана шкала інтенсивності тестової лінії, за якою оцінювалися результати дослідження. Візуальна інтерпретація результатів за умови їх суб’єктивної оцінки проводилася двома інтерпретаторами незалежно один від одного (без їх відома щодо іншого варіанту оцінки результатів і статусу самого зразка з верифікаційної панелі).
При визначенні загального статусу кожного зразка брали до уваги результати, отримані на обох серіях конкретного ШТ. Співпадаючий результат підлягав обліку як остаточний; при невизначених результатах враховували ВІЛ-реактивний результат.
Результати. В ході проведеного випробування 230 зразків сироваток веріфікаційної панелі протестовано із застосуванням 7 найменувань ШТ (по дві серії кожного найменування ШТ). Недійсних результатів тестування (відсутність контрольної смуги за наявності або відсутності тестової смуги) зафіксовано не було. Всі 230 зразків з панелі показали негативний результат при тестуванні на обох серіях п’яти найменувань ШТ, відтак їх специфічність становила 100%, тобто всі негативні матеріали були оцінені як негативні. На двох інших найменуваннях ШТ, що залишились, були отримані хибнопозитивні результати при тестуванні 7 зразків, з яких 6 зразків були оцінені як хибнопозитивні на ШТ одного найменування та 1 — на іншому; водночас не було зафіксовано перехресної хибної реактивності при застосуванні цих найменувань тестів. Відповідно до отриманих даних, специфічність першого ШТ становила 97,5% з 95% ДІ (95,5%–99,5%), а другого — 99,6% (95% ДІ (98,8%–100%)).
Висновки. Для всіх ШТ, за даними випробувань зі зразками верифікаційної панелі, не було зафіксовано перехресної хибної реактивності. Один ШТ, на якому була зафіксована найбільша кількість хибнопозитивних результатів, може бути запропонований для вибору тільки як тест першої лінії в алгоритмах тестування, водночас як інші шість найменувань ШТ можуть бути застосовані як тести першої, так і другої/третьої ліній. Отримані дані підтверджують дієвість застосування алгоритмів тестування ШТ для діагностики ВІЛ-інфекції, що на сьогодні використовуються в Україні для обстеження різного контингенту населення: як представників населення, так і ключових груп. Оцінку ефективності алгоритмів тестування на ВІЛ в країні потрібно періодично повторювати із застосуванням діагностикумів, що мають різні антигенні компоненти або засновані на різних принципах дії.
Ключові слова: верифікація, тестування на ВІЛ, швидкі тести.
M. Kyslykh1, I. V. Andrianova2, O. V. Maksymenok1, V. A. Martsynovska1,2
Verification of hiv testing algorithms using rapid tests
1. SI «The L. V. Hromashevskyi institute of epidemiology and infectious diseases of NAMS of Ukraine»
2. SI «Public Health Center of the Ministry of Health of Ukraine»
Ensuring accurate, timely and accessible diagnosis of HIV infection is a priority measure aimed at achieving global goals set for Ukraine to overcome the HIV epidemic, namely obtaining research results of guaranteed quality so that 95% of people living with HIV know their status. Timely diagnosis of HIV infection with the help of rapid tests (RT) becomes especially important in the conditions of martial law, when access to ELISA testing is limited or absent at all.
A standardized testing strategy and the use of quality-assured products are extremely important for accurate diagnosis, and the wrong choice of testing algorithm can lead to diagnostic errors. WHO Consolidated guidelines on HIV testing services (2019 edition) recommends a single «standard» HIV testing strategy for all HIV testing facilities — three consecutive positive HIV serological test results and a simplified case analysis scheme for testing when discrepant test results are obtained.
The causes of misdiagnosis are multifactorial and include errors at various stages of the testing process, but the main factor in the occurrence of a significant number of misdiagnoses is the incorrect selection of tests and/or the sequence of their use. Verification of testing algorithms makes it possible to obtain objective factual data on the effectiveness of a certain combination of tests for accurate diagnosis of HIV infection before their mass introduction. For this, during verification, the selected products are checked for the absence of the same false results, which could lead to incorrect diagnosis.
Therefore, an urgent issue for the country is the need to define a reliable national HIV testing algorithm with a backup algorithm, which would be used as an alternative in cases when, for any reason, it is temporarily impossible to conduct research according to the main algorithm.
The purpose of the work. Based on the assessment of specificity, to determine the best combinations of RTs, the joint use of which will ensure obtaining guaranteed test results (with the smallest or zero false cross-reactivity) within the framework of the selected testing algorithms.
Materials and methods. This verification study was based on an HIV testing strategy using three RTs sequentially, the first of which should be the most sensitive (≥99% for both true and false-reacitive results); the second and third tests should be the most specific (≥98% to detect all false reactive results).
7 RTs brands (2 lots of each brand) were selected for the verification study. The verification panel of 230 samples of blood sera, which does not contain HIV serological markers, was prepared from the sample archive of the laboratory of epidemiology of parenteral viral hepatitis and HIV infection of the SI «The L. V. Hromashevskyi institute of epidemiology and infectious diseases of NAMS of Ukraine». The testing of the samples of the verification panel took place in a random order and in a blind way — in the first half of the working day (from morning to lunch), 5 serum samples were tested for 2 lots of all 7 RTs brands in exact accordance with the instructions for using the tests.
For the visual interpretatation of the testing results with rapid tests, the intensity scale of the test line was used, according to which the results of the study were evaluated. The visual interpretation of the results, taking into account their subjective evaluation, was carried out by two interpreters independently of each other (without their knowledge of the other version of the evaluation of the results and the status of the sample itself from the verification panel). When determining the general status of each sample, the results obtained on both lots of a specific RT were taken into account. The match of the result was considered final; in case of discordant results, the HIV-reactive result was taken into account.
Results. During the evaluation, 230 sera samples of the verification panel were examined using 7 RTs brands (two lots of each RT brand). Invalid test results (absence of a control strip in the presence or absence of a test strip) were not recorded. All 230 samples from the verification panel were negative when tested by both lots of five RTs brands, so their 100% specificity was confirmed. False-reactive results were obtained for the remaining two RTs brands when 7 negative samples were tested: 6 samples were tested by one RT brand and 1 sample was tested by another RT brand. At the same time, no false cross-reactive results were recorded when using these test brands. According to the obtained data, the specificity of the one RT brand was 97.5% with 95% CI (95.5%–99.5%), the other RT brand — 99.6% (95% CI (98.8%–100%)).
Conclusions. According to the results of tests with samples of the verification panel, no false cross-reaction was recorded for all RT brands. Th,e one RT brand with the highest number of false-reactive results can be offered for selection only as a first-line test in testing algorithms, while the other six RT brands can be used as firstand second-/third-line tests. The obtained data confirm the effectiveness of the use of RT in HIV testing algorithms, which are currently used in Ukraine for different contingents of the population both representatives of the population and key groups. Evaluation of the effectiveness of HIV testing algorithms in the country should be periodically repeated using diagnostic kits that have different antigenic components or are based on different principles of action.
Key words: verification, HIV testing, rapid tests.
Досягнення глобальних цілей Fast Track «95-95-95» до 2030 року вимагає реалізації ефективних заходів з протидії ВІЛ/СНІДу, що сприяють зниженню на 95%, порівняно з базовим показником 2010 року, рівнів захворюваності та смертності, зумовлених ВІЛ, у світі [1]. Ключовим компонентом у досягненні цих цілей є забезпечення доступу до послуг з тестування на ВІЛ (далі — ПТВ) як відправної точки для надання послуг з профілактики, лікування, догляду та підтримки у зв’язку з ВІЛ-інфекцією, із забезпеченням лабораторними службами підтримки якості та надання правильних результатів тестування на ВІЛ.
Для встановлення діагнозу ВІЛ-інфекції Всесвітня організація охорони здоров’я (далі — ВООЗ) рекомендує застосовувати стратегії тестування на основі використання групи серологічних тестів на ВІЛ, що включають швидкі тести (далі — ШТ) та імуноферментні діагностикуми (далі — ІФА) [2, 3]. Чутливість кожного з тестів має становити не менше 99% (реактивність тесту фіксується не менше ніж у 99 із 100 випадків аналізу матеріалів, дійсно позитивних на ВІЛ), тоді як специфічність — не менше ніж 98% (реактивність тесту відсутня не менше ніж у 98 із 100 випадків протестованих зразків, дійсно негативних на ВІЛ), що є мінімальними пороговими значеннями для схвалення тесту в межах процедури прекваліфікації ВООЗ [4, 5].
В останні роки, у зв’язку із зростанням поінформованості про свій ВІЛ-статус, показники позитивності серед осіб, які звертаються за ПТВ, суттєво знизилися. Навіть в умовах вкрай високої поширеності ВІЛ-інфекції у країнах Південної та Східної Африки рівень позитивності знаходиться нижче порогового значення 5% (встановлено для того, щоб забезпечити прогностичну цінність позитивного результату комбінації тестів (PPV), що використовуються в межах стратегії тестування, на рівні не нижче 99%, за умови досягнення тестами мінімальних вимог щодо специфічності на рівні 98%) і, за оцінками, продовжить знижуватися на тлі широкого охоплення антиретровірусною терапією (далі — АРТ) та імовірно низької захворюваності на ВІЛ-інфекцію [6]. Відтак, у Зведеному керівництві ВООЗ з послуг тестування на ВІЛ (редакція від 2019 р.) була рекомендована єдина стратегія тестування на ВІЛ, згідно з якою, для визначення ВІЛ-позитивного статусу рекомендовано отримання трьох послідовних позитивних результатів серологічних досліджень. За даними огляду політики тестування було встановлено, що лише 25% національних стратегій тестування на ВІЛ повною мірою відповідали рекомендаціям ВООЗ [7, 8]. Для встановлення точного діагнозу ВІЛ-інфекції, крім стан-дартизованої стратегії тестування, вкрай важливими є використання алгоритмів тестування, що гарантують виключення помилок діагностики [9].
Забезпечення точної, своєчасної та доступної за вартістю діагностики ВІЛ-інфекції є пріоритетним заходом, спрямованим на досягнення поставлених перед Україною глобальних цілей подолання епідемії ВІЛ-інфекції, а саме: отримання результатів досліджень гарантованої якості для забезпечення того, щоб 95% людей, які живуть з ВІЛ, знали про свій статус.
Надання ефективних та якісних ПТВ з метою виявлення нових випадків ВІЛ-інфекції відповідає Стратегічній цілі 1 Державної стратегії у сфері протидії ВІЛ-інфекції/СНІДу, туберкульозу та вірусним гепатитам на період до 2030 року, схваленій розпорядженням Кабінету Міністрів України від 27 листопада 2019 року №1415-р [10] та Закону України № 2869-IX від 12 січня 2023 року «Про внесення змін до Закону України «Про протидію поширенню хвороб, зумовлених вірусом імунодефіциту людини (ВІЛ), та правовий і соціальний захист людей, які живуть з ВІЛ» (ст.6 ч.8) щодо забезпечення оцінки ефективності алгоритму та періодичність його перегляду [11]. Проведення верифікації алгоритмів тестування забезпечує можливість отримання об’єктивних даних щодо ефективності певної комбінації тестів для точної діагностики ВІЛ-інфекції перед їх масштабним впровадженням. Для цього в ході верифікації перевіряють відсутність в обраної продукції однакових помилкових результатів, що можуть призвести до невірного діагнозу. Якщо діагностичні засоби характеризуються специфічністю нижче 100%, можна очікувати появу хибнопозитивних результатів тестування на ВІЛ. У разі, коли два або більше результатів тестів є хибнореактивними в тієї ж самої особи (хибна реактивність, загальна для кількох тестів), може бути неправильна чи невчасна діагностика [12].
Вимоги до отримання правильних результатів тестування набувають особливої ваги. Це зумовлено тим, що прогнозовано зростають наслідки хибних діагнозів в умовах, коли все більша кількість ВІЛ-позитивних пацієнтів розпочинає АРТ, базуючись виключно на серологічній діагностиці ВІЛ-інфекції. Наслідки, пов’язані з хибною діагностикою, можуть мати негативний вплив як на індивідуальному рівні, так і на рівні системи громадського здоров’я. Зокрема, призначення АРТ людині з хибним ВІЛ-позитивним діагнозом, яка насправді є ВІЛ-негативною, призводить до невиправданого медикаментозного навантаження на пацієнта, що може призвести до непередбачуваних побічних ефектів від прийому антиретровірусних препаратів, стресу та стигми пацієнта, а також втрати довіри до системи охорони здоров’я загалом [13–16].
Причини хибної діагностики ВІЛ-інфекції багатофакторні й включають у себе помилки на різних етапах діагностичного процесу. Серед інших, причиною хибної діагностики є неправильний підбір послідовності використання тестів в алгоритмі діагностики, наприклад, низька специфічність тестів другої і/або третьої лінії. За інформацією ВООЗ, стратегія тестування, відома як «тайбрейк» (в межах якої два результати тестів, що суперечать один одному, верифікуються шляхом отримання позитивного результату третього тесту, тоді як ВІЛ-позитивний діагноз встановлюється на основі реактивного результату усіх трьох тестів), призводить до встановлення невірного позитивного діагнозу для пацієнтів, які найімовірніше є ВІЛ-негативними. За деякими повідомленнями, неоптимальні національні стратегії тестування на ВІЛ вважаються основним фактором появи значної кількості хибних діагнозів [17–21]. Тому нагальним питанням для країн є необхідність визначити надійний національний алгоритм тестування з резервним алгоритмом для використання в якості альтернативного у випадках, коли з будь-яких причин виконання досліджень за основним алгоритмом тимчасово неможливе. Суворе дотримання верифікованого національного алгоритму тестування, а саме: комбінації та послідовності застосування конкретних медичних виробів (найменувань) для встановлення ВІЛ-статусу в рамках заданої стратегії тестування на ВІЛ, є необхідним завданням для усіх закладів охорони здоров’я (далі — ЗОЗ), де надаються ПТВ. Відхилення від такого алгоритму може призвести до встановлення хибного діагнозу, і для його уникнення слід впроваджувати верифіковані алгоритми діагностики. Верифікація у даному контексті означає «підтвердження шляхом перевірки і надання об’єктивних доказів про виконання певних вимог для конкретного цільового призначення».
Верифікаційне дослідження алгоритмів тестування на ВІЛ із застосуванням швидких тестів було виконано протягом лютого–серпня 2023 року в лабораторії епідеміології парентеральних вірусних гепатитів та ВІЛ-інфекції ДУ «Інститут епідеміології інфекційних хвороб ім. Л. В. Громашевського НАМН України» на замовлення ДУ «Центр громадського здоров’я МОЗ України» за технічної підтримки Глобального Фонду з боротьби з ВІЛ, туберкульозом та малярією (далі — ГФ) та у співпраці з експертами ВООЗ.
Метою дослідження є визначення найкращих комбінацій швидких тестів, спільне використання яких забезпечить отримання гарантованих результатів тестування з найменшою чи нульовою перехресною реактивністю в межах обраних алгоритмів тестування на ВІЛ-інфекцію.
Матеріали і методи. Для реалізації поставленої мети необхідним було вирішення декількох завдань, а саме:
- Складання переліку «кандидатів» серед швидких тестів — від 6 до 10 (вибір продуктів-кандидатів відбувався з переліку медичних виробів для діагностики in vitro (далі — IVD) гарантованої якості за критерієм їх діагностичних та операційних характеристик, із урахуванням зареєстрованих IVD в Україні; та/або переліку тестів, попередньо кваліфікованих ВООЗ; та/або переліку медичних виробів, що закуповуються донорами/партнерами;
- Підготовка верифікаційної панелі зразків для досліджень, що належним чином охарактеризовані на відсутність серологічних маркерів ВІЛ.
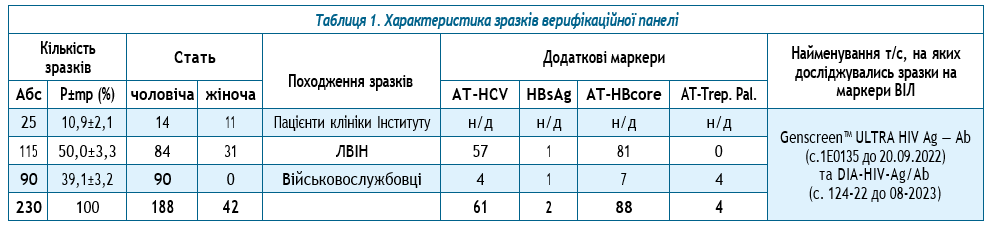
Збір зразків від осіб, які отримали ПТВ, та формування верифікаційної панелі зразків відбувалися в лабораторії епідеміології парентеральних вірусних гепатитів та ВІЛ-інфекції (далі — лабораторія) ДУ «Інститут епідеміології інфекційних хвороб ім. Л. В. Громашевського НАМН України» (далі — Інститут). Для формування верифікаційної панелі зразків ретроспективно були використані залишкові зразки сироватки крові осіб, які пройшли обстеження на наявність антитіл до ВІЛ у лабораторії, та зберігалися в архіві лабораторії. Серед архівних зразків сироватки крові, отриманих від військовослужбовців, людей, які вживають ін’єкційні наркотики (далі — ЛВІН) та загального населення — пацієнтів клініки Інституту, які мешкали у різних регіонах України, були обрані залишкові кількості зразків біологічного матеріалу.
Для виконання завдань дослідження, відповідно до рекомендацій ВООЗ, було визначено розмір вибірки 230 зразків, що є достатньою після виявлення не менше від 2% до 8% хибнореактивних результатів, отриманих при використанні тих чи інших засобів діагностики ВІЛ-інфекції, та виявлення їхнього сукупного рівня хибної реактивності [22]. З урахуванням необхідності виключення 8% зразків у зв’язку з реактивністю тесту або невизначеним результатом, загальна кількість зразків для відбору та складання верифікаційної панелі становила 250 сироваток крові. При цьому критеріями включення зразків крові пацієнтів у дослідження були: вік пацієнта 18 років та старше; наявність не менше 600 мкл залишкової кількості сироватки крові в архіві лабораторії, що дозволяє забезпечити тестування на всіх обраних для дослідження швидких тестах; відсутність у зразках сироваток крові серологічних маркерів ВІЛ.
Перед прийняттям рішення щодо включення зразків сироваток крові до складу верифікаційної панелі, усі матеріали з архіву лабораторії були протестовані на вміст серологічних маркерів ВІЛ шляхом тестування методом ІФА одночасно на двох тест-системах різних найменувань та виробників, призначених для виявлення антигену р24 ВІЛ-1 та антитіл до ВІЛ ½. Зразки, що були негативні у двох тест-системах, подальшого дослідження не потребували. Їх статус визначався як ВІЛ-негативний. Такі зразки були кандидатами до складу верифікаційної панелі. Зразки з дискордантними результатами тестування у двох тест-системах до складу верифікаційної панелі не включалися — їх статус вважався невизначеним. Після завершення скринінгу зразків-кандидатів було відібрано 230 матеріалів, що не містили серологічних маркерів ВІЛ (табл. 1).

Рішення щодо визначення необхідної кількості ШТ в алгоритмах тестування у рамках даного верифікаційного дослідження базувалося на стратегії тестування на наявність антитіл до ВІЛ із послідовним використанням трьох найменувань швидких тестів.
Перший тест повинен бути найбільш чутливим (≥99% для визначення як дійсно, так і хибнопозитивних зразків); необхідно було вибрати не менше 2-х найменувань для взаємозамінності. Другий та третій тести мали бути найбільш специфічними (≥98% для виявлення всіх хибнопозитивних), при цьому необхідно було вибрати декілька різних найменувань тестів для взаємозамінності.
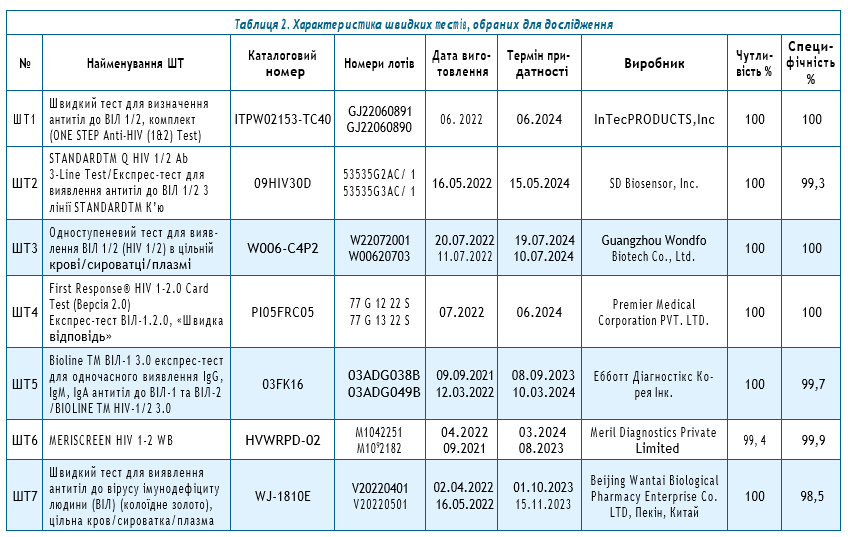
Відповідно до рекомендацій ВООЗ, технічних та операційних характеристик потенційних тестів-кандидатів [23] для верифікації обрано 7 найменувань ШТ (табл. 2).
Результати досліджень та їх обговорення.
Як було зазначено вище, для проведення дослідження обрано 7 найменувань ШТ. Усі обрані для верифікації алгоритмів тестування тести були використані у точній відповідності до інструкцій виробників до їх застосування. Усі зразки верифікаційної панелі протестовані у випадковому (рандомізованому) порядку сліпим способом.
Для оцінки алгоритмів тестування із застосуванням обраних ШТ протягом однієї постановки у першій половині робочого дня (зранку до обіду) досліджували по 5 зразків сироваток крові на усіх 7 найменуваннях швидких тестів 2-х лотів.
Для візуальної оцінки результатів досліджень із застосуванням ШТ була використана шкала інтенсивності тестової лінії, за якою оцінювалися результати дослідження (табл. 3).

Візуальна інтерпретація результатів за умови їх суб’єктивної оцінки проводилася двома навченими інтерпретаторами незалежно один від одного.
При визначенні загального статусу кожного зразка з використанням діагностичного засобу, що проходив оцінку, були взяті до уваги результати, отримані при тестуванні як на лоті 1, так і на лоті 2. Співпадаючий результат підлягав обліку як остаточний, тобто, за відсутності реактивності на обох лотах, результат оцінювали як ВІЛ-негативний. У разі реактивності на обох лотах, результат оцінювали як ВІЛ-реактивний. При неспівпадаючих результатах у лотах 1 та 2 результат вважався ВІЛ-реактивним.
В ході проведеного випробування 230 зразків сироваток крові з верифікаційної панелі були протестовані із застосуванням 7 найменувань ШТ — по два різних лота кожного найменування ШТ. Тестування передбачало паралельне використання експрес-тестів без попередньої рекомендації щодо їх вибору як тестів для 1, 2 або 3 ліній. Метою такого тестування було оцінювання отримання можливих хибних реакцій і можливих перехресних хибних реакцій при тестуванні на тестах різних найменувань і виробників.
Після закінчення лабораторного етапу отримано такі дані:
- Відсутність недійсних результатів тестування на наявність антитіл до ВІЛ — не зафіксовано відсутності контрольної смуги.
- Усі 230 зразків з панелі показали негативний результат при тестуванні на п’яти з 7 найменувань ШТ з використанням 2-х різних лотів (табл. 4).

Як видно з представлених даних, при дослідженні усіх 230 зразків, що не містили антитіла до ВІЛ, не було виявлено матеріалів, які б давали хибнопозитивну реакцію при тестуванні на ШТ 5 найменувань з 7. Крім того, при застосуванні цих ШТ не відмічена варіабельність інтерпретації результатів незалежними фахівцями.
Таким чином, специфічність 5 ШТ при дослідженні 230 зразків сироваток крові становила 100%, тобто всі негативні матеріали були оцінені як негативні — це тест-системи STANDARD Q HIV 1/2 Ab 3-Line Test, First Response HIV 1-2.O Card test (Version 2.0), ONE STEP Anti-HIV (1&2) Test, One Step HIV1/2 Whole Blood/ Serum/Plasma Test, Bioline HIV-1/2 3.0.
3. При тестуванні 7 з 230 сироваток крові за допомогою експрес-тестів 2-х найменувань були отримані хибнопозитивні результати:
а) 6 зразків були оцінені як хибнопозитивні на тест-системі Rapid Test for Antibody to HIV (Colloidal Gold Device) — Wantai, виробник Beijing Wantai Biological Pharmacy Enterprise Cо., Пекін, Китай та MERISCREEN HIV 1-2 WB; при цьому хибні результати були отримані як на 2-х серіях, так і тільки в одному лоті, тобто всього 9 хибнореактивних результатів. (табл. 5).
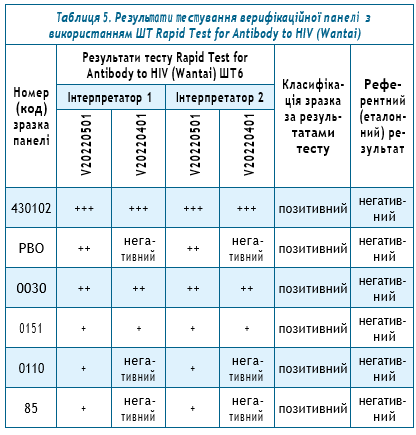
Решта зразків з панелі (224 з 230 зразків) на тест-системі Rapid Test for Antibody to HIV (Wantai) були оцінені відповідно до їх еталонного результату — тобто як негативні.
б) Ще один зразок був оцінений як хибнопозитивний на тест-системі MERISCREEN HIV 1-2 WB, виробник Meril Diagnostics Pvt. Ltd., Мумбай, Індія; хибний результат отриманий на ШТ однієї серії, інші матеріали з панелі (229 з 230 зразків) були оцінені на тест-системі MERISCREEN HIV 1-2 WB відповідно до їх референтного значення — тобто як негативні.
Згідно з отриманими даними, для ШТ, при застосуванні яких були отримані хибнореактивні результати, були розраховані показники специфічності тест-систем в дослідженні, які становили:
- для тестів Rapid Test for Antibody to HIV (Wantai) — 97,5%з 95%ДІ (95,5%–99,5%),
- для тестів MERISCREEN HIV 1-2 WB (Meril Diagnostics Ltd.) — 99,6% з 95% ДІ (98,8%–100%).
Для того щоб перевірити, чи пов’язані отримані хибнореактивні результати тестування на ВІЛ цих 7 зразків сироваток крові з можливою перехресною реактивністю, що зумовлена наявністю серологічних маркерів збудників деяких інфекційних хвороб, ці зразки сироваток крові були також охарактеризовані на наявність антитіл до вірусу гепатиту С (АТ-HCV), антитіл до корового антигену (АТ-Hbcore) вірусу гепатиту В та антитіл до збудника сифілісу (АТ-T.pallidum), а також поверхневого антигену (HBsAg) вірусу гепатиту В (табл. 6).
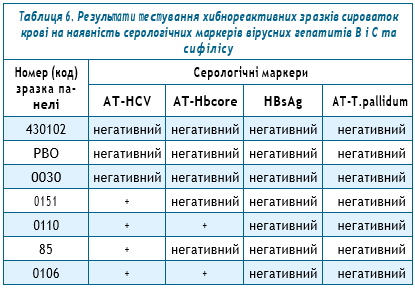
Як видно з представлених даних, взаємозв’язок між наявністю у зразках сироваток крові інших серологічних маркерів певних інфекційних захворювань та хибнореактивними результатами тестування на ВІЛ із застосуванням швидких тестів Rapid Test for Antibody to HIV (Wantai) та MERISCREEN HIV 1-2 WB (Meril Diagnostics) не був підтверджений.
Слід зазначити, що при застосуванні зазначених найменувань ШТ хибна реактивність при тестуванні тих самих зразків з верифікаційної панелі не спостерігалась, тобто не було зафіксовано загальної хибної реактивності для цих найменувань тестів. Проте, оскільки зазначені тести все ж таки виявляють випадки хибної реактивності, вони не можуть розглядатись як такі, що можуть сумісно використовуватись в одному алгоритмі тестування.
Отже, за результатами верифікаційного дослідження всіх кандидатів ШТ не була зафіксована загальна хибна реактивність. Виходячи з отриманих даних, а також операційних і технічних характеристик тестів пропонується наступний перелік діагностикумів як тестів першої, другої та третьої ліній для вибору алгоритмів тестування (табл. 7).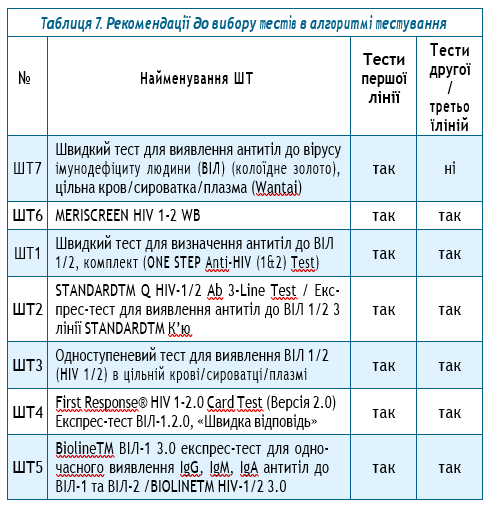
Таким чином, тестами першої лінії можуть бути обрані будь-який з 7 тестів, що увійшли до переліку ШТ для верифікаційного дослідження. Тим часом тестами другої або третьої ліній можуть бути обрані 6 з 7 найменувань ШТ, що увійшли до цього переліку.
Алгоритми тестування на ВІЛ із застосуванням ШТ, що наразі закуповуються за кошти програм ГФ та PEPFAR, є прийнятними та ефективними при обстеженні представників загального населення та ключових груп для визначення у них ВІЛ-статусу, а саме:
Алгоритм 1:
- Тест №1. Rapid Test for Antibody to Human Immunodeficiency Virus (HIV) (Colloidal Gold Device), Wantai Biological Pharmacy Enterprise Co, Ltd, China. Швидкий тест для виявлення антитіл до вірусу імунодефіциту людини (ВІЛ) (колоїдне золото).
Тест №2. First Response HIV 1-2.0 Card Test, Premier
Medical Corporation PVT. LTD., India; Експрес-тест ВІЛ-1.2.0, «Швидка відповідь».
- Тест №3. Bioline TM ВІЛ-1 3.0 Ебботт Діагностікс Корея Інк.; Експрес-тест для одночасного виявлення IgG, IgM, IgA антитіл до ВІЛ-1 та ВІЛ-2.
Алгоритм 2:
- Тест №1. Rapid Test for Antibody to Human Immunodeficiency Virus (HIV) (Colloidal Gold Device), Wantai Biological Pharmacy Enterprise Co, Ltd, China. Швидкий тест для виявлення антитіл до вірусу імунодефіциту людини (ВІЛ) (колоїдне золото).
- Тест №2. One Step HIV 1/2 Whole Blood/Serum/ Plasma Test, Guangzhou Wondfo Biotech Co., Ltd., Одноступеневий тест для виявлення ВІЛ ½ в цільній крові/сироватці/плазмі.
- Тест №3. ONE STEP Anti-HIV (1&2) Test (ADVANCED QUALITY), InTec Products, Inc.. Chinа, Швидкий тест для визначення антитіл до ВІЛ ½ (колоїдне золото).
У випадку неможливості застосування Rapid Test for Antibody to Human Immunodeficiency Virus (HIV) (Colloidal Gold Device), Wantai Biological Pharmacy Enterprise Co, Ltd, China як тестів першої лінії, можуть бути застосовані ШТ MERISCREEN HIV 1-2 WB (Meril Diagnostics Pvt. Ltd.) або STANDARD TM Q HIV-1/2 Ab 3-Line Test/Експрес-тест для виявлення антитіл до ВІЛ 1/2 3 лінії STANDARD TM К’ю. Крім того, MERISCREEN HIV 1-2 WB (Meril Diagnostics Pvt. Ltd.) або STANDARD TM Q HIV-1/2 Ab 3-Line Test/Експрес-тест для виявлення антитіл до ВІЛ 1/2 3 лінії STANDARD TM К’ю можуть бути використані також як тест 2 або 3 ліній.
За такої умови швидкі тести Rapid Test for Antibody to Human Immunodeficiency Virus (HIV) (Colloidal Gold Device), Wantai Biological Pharmacy Enterprise Co, Ltd, China, та MERISCREEN HIV 1-2 WB (Meril Diagnostics Pvt. Ltd.) не рекомендовані для використання у комбінації в межах одного алгоритму тестування із застосуванням ШТ як такі, що мали випадки отримання хибнопозитивних результатів тестування, хоча й не зафіксована їхня перехресна реактивність при тестуванні тих самих зразків сироваток.
Дані алгоритми тестування за допомогою ШТ не передбачають їх застосування для обстеження на наявність антитіл до ВІЛ вагітних жінок та донорів крові. Відповідно до галузевих стандартів медичної допомоги, для обстеження вагітних рекомендовано використання тестів, призначених або для одночасного виявлення антигену р24 ВІЛ-1 та антитіл до ВІЛ ½, або для одночасного виявлення серологічних маркерів ВІЛ та сифілісу в умовах безпосереднього звернення вагітних жінок по медичну допомогу в антенатальні клініки [24]. ШТ не використовуються для дослідження донорської крові крім випадків, визначених нормативно-правовими актами.
Згідно з рекомендаціями ВООЗ, регулярний перегляд алгоритму тестування кожні три-п’ять років забезпечить адекватну роботу тестів, впровадження покращених тестів і певну конкуренцію серед виробників. При кожному перегляді чинних алгоритмів тестування слід оцінювати їх програмну прийнятність, враховувати частоту випадків невизначеного ВІЛ-статусу, дискордантних і недійсних результатів тестування, а також потреби в додатковому навчанні персоналу та в перегляді інструктивних матеріалів.
Представлене верифікаційне дослідження сприятиме оновленню поточних алгоритмів тестування на ВІЛ-інфекцію та їх приведенню у відповідність до актуальних рекомендацій ВООЗ з метою забезпечення підбору алгоритмів, що зводитимуть до мінімального ризику встановлення неправильного діагнозу, до їх впровадження у широку практику. Крім того, це дослідження сприятиме вибору тих видів продукції (діагностикуми), котрі задовольняють нагальні потреби країни.
Висновки.
- Для 7 ШТ-кандидатів, за даними випробувань, не було зафіксовано загальної хибної реактивності.
- За результатами дослідження, виходячи з отриманих даних, всі 7 найменувань ШТ можуть бути запропоновані для застосування в алгоритмах тестування в Україні.
- Тести Rapid Test for Antibody to HIV (Wantai) та MERISCREEN HIV 1-2 WB (Meril Diagnostics Ltd.) не рекомендовані для використання у комбінації в одному алгоритмі тестування.
- Отримані дані підтверджують дієвість застосування алгоритмів тестування з використанням ШТ для діагностики ВІЛ-інфекції, що на сьогодні використовуються в Україні для обстеження різних контингентів — як представників т. з. «загального» населення, так й ключових груп, тому можуть бути рекомендовані проєктам міжнародної технічної допомоги для закупівлі та подальшого використання в алгоритмах тестування на ВІЛ з метою досягнення цільового показника перших 95%.
- Надати пропозиції щодо закупівлі швидких тестів за кошти місцевих бюджетів з урахуванням визначених у верифікаційному дослідженні переліку ШТ та послідовності їх застосування в алгоритмах тестування на ВІЛ для надання ПТВ (відповідно до результатів верифікаційного дослідження та ч.8 ст.6 Закону України «Про протидію поширенню хвороб, зумовлених вірусом імунодефіциту людини (ВІЛ), та правовий і соціальний захист людей, які живуть з ВІЛ»).
- Потребують верифікації алгоритми тестування на ВІЛ із застосуванням швидких тестів вагітних жінок, де серед тестів першої лінії слід обрати тести, призначені як для одночасного виявлення антигену р24 ВІЛ-1 та антитіл до ВІЛ ½, так і для одночасного виявлення серологічних маркерів ВІЛ та сифілісу.
- Оцінку ефективності алгоритмів тестування на ВІЛ в країні потрібно періодично (один раз у 3–5 років) повторювати із застосуванням діагностикумів, що мають різні антигенні компоненти або використовують різні принципи дії (т. з. ортогональні тести).
Автори заявляють про відсутність конфлікту інтересів.
Література
- Fast-Track strategy to end the AIDS epidemic by 2030. http:// www.unaids.org/en/resources/campaigns/World-AIDS-Day-Report-2014
- Global programme on Recommendations for the selection and use of HIV antibody tests. Wkly Epidemiol Rec Relev Epidemiol Hebd World Heal Organ. 1992;67: 145–149. Available from: https:// apps.who.int/iris/handle/10665/228362
- UNAIDS-WHO. Revised recommendations for the selection and use of HIV antibody tests. Wkly Epidemiol Rec. 1997;72: 81–7. Available from: http://www.ncbi.nlm.nih.gov/pubmed/9238418
- Selecting and purchasing HIV, HBsAg and HCV in vitro diagnostics. Geneva: World Health Organization; 2021. Available from: https:// who.int/diagnostics_laboratory/procurement/purchase/en/, accessed 8 November 2021
- Consolidated guidelines on HIV testing Geneva: World Health Organization; 2015. Available from: http://apps.who.int/iris/ bitstream/10665/179870/1/9789241508926_eng.pdf
- Giguère K., Eaton J. W., Marsh K., Johnson L. F., Johnson C. C., Ehui E. et al. Trends in knowledge of HIV status and efficiency of HIV testing services in sub-Saharan Africa, 2000–20: a modelling study using survey and HIV testing programme Lancet HIV.2021;8(5):E284–E293.Available from: https://doi.org/doi:10.1016/ S2352-3018(20)30315-5
- Fonner A., Sands A., Figueroa C., Baggaley R., Quinn C., Jamil M.et al. Country adherence to WHO recommendations to improve the quality of HIV diagnosis: a global policy review. BMJ Glob Heal. 2020;5: e001939. Available from: https://doi.org/doi:10.1136/ bmjgh-2019-001939.
- Сonsolidated guidelines on HIV TESTING SERVICES 5Cs: Consent, Confidentiality, Counselling, Correct results and Connection, ANNEX An analysis of 48 national HIV testing and counselling policies: https://apps.who.int/iris/bitstream/handle/10665/180208/WHO_ HIV_2015.19_eng.pdf?sequence=1
- Всесвітня організація охорони здоров’я 2020 Consolidated guidelines on HIV testing services, 2019 https://www.int/ publications/i/item/978-92-4-155058-1
- Державна стратегія у сфері протидії ВІЛ-інфекції/СНІДу, туберкульозу та вірусним гепатитам на період до 2030 року. — Режим доступу: https://zakon.rada.gov.ua/laws/show/1415-2019-р#Text
- Закон України від 12 січня 2023 року № 2869-ІХ «Про внесення змін до Закону України «Про протидію поширенню хвороб, зумовлених вірусом імунодефіциту людини (ВІЛ), та правовий і соціальний захист людей, які живуть з ВІЛ» https://zakon.rada.gov.ua/ laws/show/2869-20#Text
- Klarkowski D., O’Brien D. P., Shanks L., Singh K. P. Causes of false-positive HIV rapid diagnostic test Expert Rev Anti Infect Ther. 2014; 12:49–62 Available from: https://doi.org/10.1586/14787210.2014.866516
- Eaton J. W., Johnson C. C., Gregson S. The cost of not retesting: human immunodeficiency virus misdiagnosis in the antiretroviral therapy “Test-and-Offer” era. Clin Infect Dis. 2017;65. Available from: https://doi.org/doi:10.1093/cid/cix341
- Lasry , Kalou M. B., Young P. R., Rurangirwa J., Parekh B., Behel S. Cost implications of HIV retesting for verification in Africa. PLoS One. 2019;14(7):e0218936. Available from: https://doi.org/doi:10.1371/ journal.pone.0218936
- Bhattacharya , Barton S., Catalan J. When good news is bad news: psychological impact of false positive diagnosis of HIV. AIDS Care. 2008;20:560–564. Available from: https://doi.org/ doi:10.1080/09540120701867206
- Johnson C., Dalal S., Baggaley R., Taegtmeyer M. A public health approach to addressing and preventing misdiagnosis in the scale-up of HIV rapid testing programmes. J Int AIDS Soc. 2017;20(S6):22190. Available from: https://onlinelibrary.wiley.com/ doi/10.7448/IAS.20.7.22290
- Johnson C. C., Fonner V., Sands A., Ford N., Obermeyer C. M., Tsui S., Wong V., Baggaley R. To err is human, to correct is public health: a systematic review examining poor quality testing and misdiagnosis of HIV status. J Int AIDS Soc. 2017;20(S6):21755. Available from: https://onlinelibrary.wiley.com/doi/full/10.7448/IAS.20.7.21755
- Al-Kindi , Al-Jardani A. HIV serology false positivity among expatriates from Africa: a screening dilemma. J Med Microbiol. 2020;69(6):812-816. Available from: https://doi.org/doi:10.1099/ jmm.0.001186
- Kim , Lee J. H., Choi J. Y., Kim J. M., Kim H. S. False-positive rate of a «fourth-generation» HIV antigen/antibody combination assay in an area of low HIV prevalence. Clin Vaccine Immunol. 2010;17(10):1642-1644. Available from: https://doi.org/doi:10.1128/ CVI.00258-10
- Reid J., Van Zyl G., Linström M., Korsman S., Marais G., Preiser W. High positive HIV serology results can still be false IDCases. 2020;21:e00849. Available from: https://doi.org/doi:10.1016/j. idcr.2020.e00849
- Smotrys , Magge T., Alkhuja S., Gandotra S. D. Babesiosis as a cause of false-positive HIV serology. BMJ Case Rep. 2018; 2018:bcr2017223738. Available from: https://doi.org/doi:10.1136/ bcr-2017-223738
- Optimizing HIV testing algorithms: a generic verification protocol for selecting appropriate HIV serology assays and assessing the level of shared false Geneva: World Health Organization; 2021. Licence: CC BY-NC-SA 3.0 IGO Available from: https://www.who. int/publications/i/item/9789240039162
- WHO verification tool HIV test selection tool. Available from:https://www.who.int/tools/optimizing-hiv-testing-algorithms-toolkit
- Guidance for procurement of in vitro diagnostics and related laboratory items and Geneva: World Health Organization; 2017 (https://www.who.int/diagnostics_ laboratory/publications/procurement/en/, accessed 17 November 2019).
- Стандарти медичної допомоги «Профілактика передачі ВІЛ від матері до дитини», затверджені наказом МОЗ України від 26.2022 №692 — https://www.dec.gov.ua/mtd/profilaktyka-peredachi-vil-vid-materi-do-dytyny/
Відомості про авторів:
Кислих О. М. — науковий співробітник лабораторії епідеміології інфекційних хвороб ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України».
ORCID: 0009-0003-7387-2109
Андріанова І. В. — імунолог референс-лабораторії з діагностики ВІЛ/СНІДу, вірусних та особливо небезпечних патогенів ДУ «Центр громадського здоров’я МОЗ України»
Максименок О. В. — к. б. н., старший науковий співробітник лабораторії епідеміології інфекційних хвороб ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України».
ORCID: 0009-0004-3566-2124
Марциновська В. А. — к. м. н., старший науковий співробітник лабораторії епідеміології інфекційних хвороб ДУ
«Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України»; Головний фахівець відділу управління та протидії ВІЛ-інфекції ДУ «Центр громадського здоров’я МОЗ України».
ORCID: 0000-0001-8283-0179
Information about the authors:
Kyslykh O. M. — researcher at the laboratory of epidemiology of infectious diseases, SI «The L. V. Hromashevskyi Institute of epidemiology and infectious diseases of NAMS of Ukraine». ORCID: 0009-0003-7387-2109
Andrianova I. V. — immunologist of the reference laboratory for diagnosis of HIV/AIDS, viral and particularly dangerous pathogens, SI «Public Health Center of the Ministry of Health of Ukraine».
Maksymenok O. V. — Сandidate of Biological Sciences, senior researcher at the laboratory of epidemiology of infectious diseases, SI «The L. V. Hromashevskyi Institute of epidemiology and infectious diseases of NAMS of Ukraine». ORCID: 0009-0004-3566-2124
Martsynovska V. A. — Candidate of Medical Sciences, senior researcher at the laboratory of epidemiology of infectious diseases, SI «The L. V. Hromashevskyi Institute of epidemiology and infectious diseases of NAMS of Ukraine»; Chief Specialist of HIV management and counteraction department SI, «Public Health Center of the Ministry, of Health of Ukraine».
ORCID: 0000-0001-8283-0179

Дослідження ефективності перевірки алгоритмів для виявлення ВІЛ з використанням швидких тестів показало можливість помилково позитивних результатів у певних індивідів із позитивними результатами Тай-брейку. Це наголошує на необхідності проведення додаткового підтверджуючого тестування для цієї групи людей.