Матеріали конференції

DOI : https://doi.org/10.61948/prevmed-2023-4-44
О. І. Білогорцева1, Я. І. Доценко1, О. П. Недоспасова2
ЕПІДЕМІОЛОГІЧНА СИТУАЦІЯ ЩОДО ЗАХВОРЮВАНОСТІ НА ТУБЕРКУЛЬОЗ У ДІТЕЙ РІЗНОГО ВІКУ НА СУЧАСНОМУ ЕТАПІ
1. ДУ «Національний інститут фтизіатрії і пульмонології ім. Ф. Г. Яновського НАМН України», м. Київ, Україна
2. ДУ «Центр громадського здоров’я МОЗ України»Е-mail: child10ifp@gmail.com
Захворюваність на туберкульоз (ТБ) серед дітей тісно пов’язана із захворюваністю на ТБ у дорослих. ТБ у дітей часто пропускають через неспецифічні симптоми і труднощі у виявленні та діагностиці. Це ускладнює визначення фактичних масштабів епідемії ТБ серед дитячого населення, які можуть бути гіршими, ніж оцінюється зараз.
Серед вперше виявлених випадків ТБ, відсоток дітей з цим діагнозом має бути від 5,0% до 15,0% у країнах з низьким і середнім рівнем економічного розвитку та <10,0% у країнах з високим рівнем економічного розвитку, відповідно до даних ВООЗ.
Захворюваність серед дітей є важливим прогностичним та епідемічним показником. Структура клінічних форм вперше виявленого ТБ у дітей відповідає особливостям руху туберкульозної інфекції у певних вікових періодах. Переважно у дітей молодшого віку виявляються первинні форми ТБ, частіше всього — ТБ внутрішньогрудних лімфовузлів. Слід зауважити, відповідно до класифікації ТБ, що затверджена в Україні, ТБ внутрішньогрудних лімфовузлів відносять до позалегеневого ТБ органів дихання.
Матеріали і методи: епідеміологічні, статистичні. Робота виконана за кошти державного бюджету.
Результати. Впродовж останніх 5 років спостерігалось поступове зниження захворюваності на ТБ як серед усього населення (2018 р. — 50,5; 2022 р. — 36,7 на 100 тис. нас.), так і серед дітей України (2018 р. — 10,1; 2022 р. — 7,7 на 100 тис. відповідного населення). Аналіз п’ятирічної динаміки (2018–2022 рр.) захворюваності на ТБ серед дітей виявив тенденцію до зниження.
Для більш детального аналізу захворюваності на ТБ, його смертності було розраховано показник динамічного ряду — темп приросту за роками. Захворюваність на ТБ серед дітей в Україні за період 2018–2022 рр. постійно знижувалась, проте у 2021 р. спостерігалось незначне зростання показника до 7,9 на 100 тис. дитячого населення. Показники смертності від ТБ серед дітей також мали тенденцію до зниження, найбільший спад спостерігався у 2019 та 2022 рр. — на 22,2% та 48,9% (у 2019 та 2022 рр. зареєстровано 4 померлих дітей, відповідно 0,07 та 0,05 на 100 тис. дитячого населення; у 2021 році — 3 померлих дітей, що становило 0,01 на 100 тис. дитячого населення).
Найвищі показники захворюваності на ТБ серед дітей, віком 0–17 років включно, були зареєстровані у 2022 р. у Кіровоградській обл. (62,7 на 100 тис. дит. нас.), Чернігівській обл. (16,5), Одеській обл. (13,9), Дніпропетровській обл. (13,0) та Запорізькій обл. (10,7 на 100 тис. дит. нас.); найнижчі — у Львівській обл. (2,9 на 100 тис. дит. нас.), Тернопільській обл. (2,1), Харківській та Миколаївській обл. (3,3 та 3,5 на 100 тис. дит. нас., відповідно).
У 2022 р. в Україні ТБ легень був діагностований у 403 дітей (71,2% від загальної кількості випадків ТБ у дітей), а позалегеневий ТБ — у 162 дітей (28,6%). У структурі позалегеневого ТБ у дітей найбільшу частку, а саме: 66,7% (108 випадків) становив ТБ органів дихання. Серед позалегеневого ТБ інших органів у 2022 р. перше місце посів ТБ периферичних лімфатичних вузлів — 13,0% (2018 р. — 8,3%), друге — ТБ кісток та суглобів — 8,0% (2018 р. — 9,3%), на третьому місці — ТБ нервової системи — 6,8% (2018 р. — 2,7%), ТБ очей — 3,7% (2018 р. — 2,1%), інші позалегеневі форми ТБ зустрічались набагато рідше.
Висновки. Аналіз захворюваності на ТБ та смертності від нього серед дітей України за період 2018–2022 років показав хвилеподібну тенденцію захворюваності на ТБ та смертності від нього. Такі дані свідчать про поступове поліпшення загальної епідемічної ситуації щодо ТБ у дітей в Україні.
Покращення роботи у профілактичному секторі щодо ТБ серед дітей є можливим при поєднанні зусиль загальнолікувальної мережі та протитуберкульозної служби, що поряд із проведенням низки освітніх заходів з питань профілактики та виявлення ТБ дасть змогу покращити надання медичної допомоги дітям та в кінцевому результаті покращити ситуацію з даної недуги.
А. В. Бондаренко1, Д. В. Кацапов1, О. В. Бондаренко2, І. В.Крохмаль3, Л. І. Маркуш3
ПОШИРЕНІСТЬ ГЕНІВ РЕЗИСТЕНТНОСТІ ДО АНТИБІОТИКІВ У ACINETOBACTER BAUMANNII, ВИДІЛЕНИХ У ХВОРИХ НА COVID-19 У ВІДДІЛЕННІ ІНТЕНСИВНОЇ ТЕРАПІЇ
1. Харківський національний медичний університет, м. Харків, Україна
2. Харківський міжнародний медичний університет, м. Харків, Україна
3. Комунальне некомерційне підприємство Харківської обласної ради «Обласна дитяча клінічна інфекційна лікарня», м. Харків, Україна
Е-mail: Dkatsapov@ukr.net
Серед усіх збудників інфекцій особливе місце за поширеністю та високою резистентністю займає Acinetobacter baumannii, завдяки чому він посідає провідне місце в етіологічній структурі інфекцій, пов’язаних з наданням медичної допомоги. A. baumannii має здатність набувати та інтегрувати нові детермінанти резистентності, стаючи вектором для розповсюдження генів резистентності не лише на видовому рівні, а й між видами.
Метою цього дослідження було: вивчити наявність специфічних генів, пов’язаних з ферментами β-лактамаз розширеного спектру (TEM, SHV, CTX-M, DHA, KPC, GES, OXA), а також генів метало-β–лактамаз (IMP, VIM, NDM) у штамів A. baumannii, отриманих із зразків крові пацієнтів з COVID-19, які були госпіталізовані у відділення інтенсивної терапії.
Матеріали і методи: для ідентифікації бактерій і генів, пов’язаних із стійкістю до множинних лікарських засобів використовувався мультиплексний ПЛР-аналіз у реальному часі. Дослідження включало загалом матеріал від 50 пацієнтів із COVID-19 та госпітальними інфекціями, спричиненими A. baumannii.
Результати. Було виявлено, що всі штами A. baumannii, виділені в цьому дослідженні, мають гени, пов’язані з антибактеріальною стійкістю, зокрема ЛРС та МБЛ. Визначали наявність β–лактамаз Амблера класу А в таких співвідношеннях: ТЕМ — 8%, SHV — 58%, СТХ-М — 6%. Клас Ambler C, зокрема DHA, був виявлений у 4% зразків. Клас Амблера D, зокрема OXA-23, був виявлений у 4% зразків. Крім того, гени метало-β–лактамаз (клас B за Амблером) були ідентифіковані у 28% зразків, NDM виявлено у 9%, VIM — у 17% та IMP — у 2% випадків.
Висновок. Висока поширеність генів антибіотикорезистентності серед клінічних ізолятів A. baumannii створює значний ризик горизонтального перенесення генів іншим видам бактерій. Виявлення в цьому дослідженні штамів A. baumannii, що продукують карбапенемази, викликає особливе занепокоєння та підкреслює важливість впровадження заходів інфекційного контролю. Звичайні методи діагностики в мікробіології не можуть підтвердити наявність або відсутність генів резистентності, і варто відзначити, що до 60% штамів, що продукують β–лактамази, відповідають формальним критеріям чутливих штамів. Однак використання мультиплексних ПЛР-аналізів у реальному часі дозволяє оцінити генетичну структуру бактеріальної популяції. Дослідження підкреслює необхідність покращення діагностики та комплексних заходів для боротьби з поширенням мультире- истентного A. baumannii.
Vatlitsova, A. Golovko, O. Romanenko, H. Kuzmich
SELECTIVE SEROLOGICAL MONITORING OF BRUCELLA CANIS SPREAD AMONG DOGS
State Scientific Control Institute of Biotechnology and Strains of Microorganisms, Kyiv, Ukraine
Е-mail: olga.vatlitsova@gmail.com
Due to the close contact between dogs and humans, such a widespread zoonosis as B. canis forms a serious public health concern. According to available data, cases of B. canis infection are reported all over the world.
Recently, there has been a significant increase in the number of dogs diagnosed with B. canis. Moreover, up to the official reports, the majorities of infected dogs originate from Eastern Europe have traveled to Eastern Europe or have been in contact with those animals that have traveled. Infections are also detected in Western Europe. Considering current conditions, the situation is getting worse, given the increase in the intensity of dog migration and, unfortunately, the surge in the number of homeless animals. There are no sufficient data concerning B. canis dissemination in Ukraine today, so the purpose of our study was to conduct a selective serological screening of the spread of this disease.
This work was performed within the framework of the project «Stärkung der Biosicherheit beim Umgang mit proliferationskritischen Tierseuchenerregern in der Ukraine», financed by the German Federal Foreign Office. The research program included the collection of dog blood serum samples and performing the immunochromatographic assay, using the commercial kit “Antigen Rapid C. Brucella Ab Test Kit” (South Korea). Samples were obtained both from veterinary clinics in Kyiv and from the other regions of Ukraine. As part of cooperation with the Public Organization “ZooControl”, samples were obtained between stray dogs from some eastern regions of the country.
In total, out of 628 dog serum samples were tested and antibodies to B. canis were detected in 11 samples, which is 1.7% of the total. In comparison with global index, most surveys have reported seroprevalence rates are ranging from <1% to ~15% in various groups of dogs. Out of 82 samples obtained from neglected animals, 6 turned out to be positive, which, respectively, was 7.3%. Out of 13 samples taken from dogs with clinical symptoms typical for the course of brucellosis, 3 samples were found to be positive, and all three animals that had antibodies to B. canis belonged to the same owner. Based on the results we obtained, it can be noted that the epidemiological situation in the country regarding B. canis remains, at the moment, poorly covered, which, in turn, continues to cause concern. Thus, the prevention and control of canine brucellosis remains a difficult issue, and serological monitoring of the spread of zoonosis caused by B. canis stays necessary in light of recent events.
О. В. Демиховська
АКАДЕМІК Л. В. ГРОМАШЕВСЬКИЙ ТА ЗБЕРЕЖЕННЯ ТРАДИЦІЙ ІНСТИТУТУ
Відомство суспільного здоров’я та соціального захисту при Міністерстві охорони здоров’я Федеральної землі Мекленбург Померанія, м. Росток, Німеччина
Е-mail: helen-bey@gmx.de
Як учениця професорки Людмили Митрофанівни Чудної я відчуваю себе одним із носіїв великих традицій епідеміологічної школи академіка Л. В. Громашевського. Щорічні «Читання», які не перериваються десятиріччями, незважаючи на зовнішні обставини, це символ наступності поколінь українських вчених і посил до нащадків, яким далі продовжувати цю благородну справу: захищати людину від загрозливих інфекцій та епідемій.
Так склалося, що я покинула країну майже 20 років тому і змушена була шукати відповідну нішу в системі охорони здоров’я Німеччини, яка дуже відрізняється від того, що успадкувала Україна з радянських часів. Сучасне лабораторне оснащення, детально продумані закони про захист від інфекцій з чіткою централізованою системою обліку та звітності про інфекційні захворювання, баланс між науковими рекомендаціями від німецького Інституту Роберта Коха і втіленням цих рекомендацій в практичних закладах федеральних земель. Засвоєння цієї премудрості, та ще й іноземною мовою, триває для мене, як наукового співробітника відділення інфектології федерального міністерського відомства й досі. Готуючи матеріали до чергової доповіді для практичних епідеміологів, я спіймала себе на думці: загально прийнятих у міжнародній епідеміологічній теорії понять (наприклад, прямий та непрямий контакт, когортні дослідження тощо) недостатньо, щоб зрозуміти особливості епідемічного процесу інфекцій з різними механізмами передачі та розпланувати необхідні протиепідемічні заходи. І тоді, як на інститутській лекції з теорії Громашевського, чітко і структуровано виплила схема епідемічного процесу з 3-ма ланками (джерело інфекції, механізм передачі та сприйнятливий колектив), 5 механізмів передачі, кожний з яких завжди має найслабшу ланку, куди мають бути спрямовані протиепідемічні заходи. І все стало на свої місця. Коли я побачила просвітлені обличчя моїх практикантів-епідеміологів, я зрозуміла, теорія Льва Васильовича Громашевського жива и може бути корисною.
Моє посилання: поважати традиції та пишатися оригінальністю національних вчених. Вивчаючи іноземний досвід, використати в сучасних обставинах все раціональне, що було створено попередніми поколіннями та йти вперед, назустріч новим викликам у боротьбі з інфекційними хворобами.
Хіба не це є головною метою сьогоднішньої конференції?
Сьогодні Україна у всіх на вустах. Важко переоцінити рівень співчуття і солідарності в усьому світі з українським народом. Але не всі, принаймні у колі моїх колег, можуть собі уявити, що в цих умовах, під звуки сирен і вибухів, один із старіших науково-дослідницьких інститутів України в Києві збирає наукову конференцію, слухає доповіді, дивиться у майбутнє.
О. М. Дерябін1,2, М. А. Архипова1,3, С. Л. Рибалко1, Т. Ю. Трохимчук1, В. П. Атаманюк4, О. Ю. Галкін3
ВПЛИВ ФЛАВОНОЇДОВМІСНИХ ПРЕПАРАТІВ НА ЕКСПРЕСІЮ ГЕНІВ ПОЛІМЕРАЗИ, ГЛІКОПРОТЕЇНУ М ТА ТИМІДИНКІНАЗИ ВІРУСУ ПРОСТОГО ГЕРПЕСУ 1 ТИПУ
1. ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
2. Державний науково-контрольний інститут біотехнології і штамів мікроорганізмів, м. Київ, Україна
3. Національний технічний університет України «Київський політехнічний інститут ім. Ігоря Сікорського», м. Київ, Україна4ТОВ «НВК «Екофарм», м. Київ, УкраїнаЕ-mail: aniramovna@gmail.com
Вірус простого герпесу першого типу (HSV-1) належить до нейротропних альфагерпесвірусів, широко поширений в світі серед людей і розподіляється на 3 географічні філогрупи. Його генетична структура включає 84 унікальних гени, які відіграють ключову роль у реплікації та інфекційності вірусу. Порушення в функціонуванні деяких із цих генів може супроводжуватись повною або частковою інгібіцією реплікації вірусу, що відіграє головну роль при розробці антивірусної терапії. Флавоноїди, природні сполуки, які зустрічаються у рослинах, відомі своєю потужною біологічною активністю, зокрема й антивірусною, але механізми їх впливу на процеси реплікації вірусів залишаються малодослідженими.
Мета нашої роботи полягала у визначенні можливих таргетних генів HSV-1 для виявлення флавоноїдів з антивірусною активністю, що дозволить розробити нові ефективні методи лікування герпетичних інфекцій.
Матеріали і методи. Для пошуку таргетних генів вірусу була використана база даних GenBank (США). Підбір праймерів виконали в програмах “Vector NTI” v.10.0.1 та “BLAST” NCBI. Синтез праймерів виконаний фірмою “Generi-biotech” (Чехія). Для виділення ДНК і РНК використали набори “High Pure PCR Template Preparation Kit” та “GeneJet RNA Purification Kit”, а для реакції зворотної транскрипції “Maxima H Minus First Strand cDNA Synthesis Kit”. Для полімеразної ланцюгової реакції використали реагенти виробництва “Thermo Fisher Scientific” та “New England BioLabs Inc”. Реакцію проводили на термоциклері “T1 Personal Comby”. Продукти ПЛР аналізували методом електрофорезу в 1,5% гелі агарози з етидієм броміду і переглядали в системі гель-документування “GelDoc XR Plus”.
Антивірусну активність флавоноїдів перевіряли на перещеплювальній культурі клітин BHK-21, інфікованій HSV-1.
Результати. Як таргетні були обрані гени: UL10 (gM) — кодує один з двох гідрофобних глікопротеїнів (інший — gL), які занурені в подвійний ліпідний шар зовнішньої оболонки вірусу і необхідні для реплікації вірусу в культурі клітин; UL23 (тимідинкіназа) — кодує фермент метаболізму нуклеїнових кислот та UL30, що кодує ДНК-полімеразу — центральний фермент вірусного реплікаційного комплексу, який складається з 6 доменів, утворює комплекс з ДНК-зв’язуючим білком UL42 і належить до B-сімейства полімераз.
Характеристиці підпадали флавоноїдовмісні препарати «Протефлазід» і «Тазалок» та зразки флавоноїдів — апігенину і лютеоліну. Препарати були перевірені в концентраціях, які були ефективними на інших вірусних моделях.
На першому етапі була проведена верифікація наявності ДНК HSV-1 в усіх зразках. На другому етапі був проведений якісний аналіз експресії генів UL10, UL23 та UL30 HSV-1 методом ЗТ-ПЛР. Ревертазна реакція була виконана тільки з відповідними специфічними зворотними праймерами. Для гена UL10, з високим вмістом гуаніна і цитозина, ревертазну реакцію виконали з попередньою деструкцією вторинної структури РНК.
Проведений аналіз виявив, що препарати «Протефлазід» і «Тазалок» викликали, прямо або опосередковано, інгібіцію експресії гена gM (UL10) і не впливали на експресію генів тимідинкінази (UL23) та ДНК-полімерази (UL30). На відміну від них, індивідуальні зразки флавоноїдів — апігенин та лютеолін, не виявляли інгібуючої дії на експресію 3 таргетних генів.
Висновки
- У результаті проведених досліджень підтверджена наявність антивірусної активності флавоноїдовмісних препаратів «Протефлазід», «Тазалок» на вірус герпесу 1 типу.
- Виявлено можливі механізми інактивації реплікації вірусу в культурі клітин.
С. Б. Дорогань1, О. А. Шевченко2
СПРИЙНЯТТЯ ЕПІДЕМІЧНИХ РИЗИКІВ ПАНДЕМІЇ COVID-19 НАСЕЛЕННЯМ УКРАЇНИ
1. Донецький національний медичний університет, м. Кропивницький, Україна
2. Дніпровський державний медичний університет, м. Дніпро, УкраїнаЕ-mail: ser.2707@gmail.com
COVID-19 несе смертельну небезпеку, множинні ускладнення, має психологічні наслідки. Це й ситуація очікування хвороби, тривожність і переживання через здоров’я і життя близьких, рідних, друзів. Значний вплив на психоемоційний стан людей також мають зміни стилю життя, усталених гігієнічних навичок,
режим самоізоляції, чисельні, не бачені до того обмеження.
Мета дослідження: визначення структури суб’єктивного ставлення громадян України до небезпеки коронавірусної інфекції та розробка спеціальної шкали для оцінки рівня епідемічної настороженості населення в умовах пандемії COVID-19.
Матеріали та методи досліджень. Для вивчення особливостей сприйняття жителями України пандемії COVID-19 у соціальній мережі «Фейсбук» з 9 квітня 2020 р. до 8 жовтня 2020 р. проведено інтернет-опитування з використанням “Google Form”.
У дослідженні взяли участь 550 осіб з усіх підконтрольних Україні регіонів і міста Києва та троє закордонних респондентів — колишніх громадян України. Найактивнішими були жителі Донецької (21,5%), Кіровоградської (21,1%), Київської (9,8%), Дніпропетровської (9,3%) областей та міста Києва (10,9%).
Вік учасників опитування коливався від 16 до 73 років (середній, M±m — 34,9±0,6 року). Серед респондентів переважали жінки (n=353, 64,2%) та мешканці міст (n=449, 81,6%).
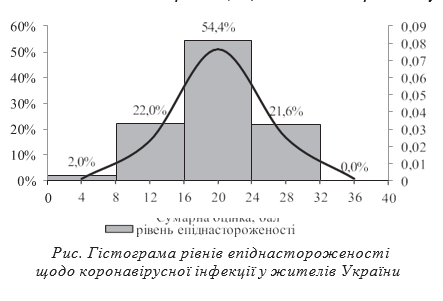 Результати та їх обговорення. Коронавірус вважають серйозною небезпекою (33,3±2,0)% опитаних і ще (11,6±1,4)% з певними сумнівами з цим погоджуються; сумарно — ∑ (44,9±2,1)%. Але (21,1±1,7)% вважають, що коронавірус — це не серйозно, (17,3±1,6)% думають, що напевно не серйозно (∑ (38,4±2,1)%). Пандемією COVID-19 визнають вже (73,6±1,9)% опитаних, з них повністю з цим згодні (45,6±2,1)% респондентів. Різні погляди на серйозність проблеми слабко, але вірогідно корелюють з віком (r=0,23; p<0,001) і статтю (r=0,21; p<0,001) респондентів, а також із кількістю населення у пунктах проживання (r=0,30; p<0,001). Зокрема, скептичніше до існування реальної небезпеки ставляться чоловіки — (47,2±3,6)%, особи старше 50 років — (47,5±5,0)%, мешканці селищ та невеликих міст з населенням від 3 до 100 тис. — (47,7±4,3)%.
Результати та їх обговорення. Коронавірус вважають серйозною небезпекою (33,3±2,0)% опитаних і ще (11,6±1,4)% з певними сумнівами з цим погоджуються; сумарно — ∑ (44,9±2,1)%. Але (21,1±1,7)% вважають, що коронавірус — це не серйозно, (17,3±1,6)% думають, що напевно не серйозно (∑ (38,4±2,1)%). Пандемією COVID-19 визнають вже (73,6±1,9)% опитаних, з них повністю з цим згодні (45,6±2,1)% респондентів. Різні погляди на серйозність проблеми слабко, але вірогідно корелюють з віком (r=0,23; p<0,001) і статтю (r=0,21; p<0,001) респондентів, а також із кількістю населення у пунктах проживання (r=0,30; p<0,001). Зокрема, скептичніше до існування реальної небезпеки ставляться чоловіки — (47,2±3,6)%, особи старше 50 років — (47,5±5,0)%, мешканці селищ та невеликих міст з населенням від 3 до 100 тис. — (47,7±4,3)%.
Згідно з даними нашого дослідження встановлено, що епіднастороженість у більшості опитаних відповідає середньому рівню — 299 осіб, (54,4±2,1)% (рис.). Тобто людина здебільшого визнає серйозність і реальні загрози коронавірусної інфекції, не проти вжитих заходів та виконує їх, але тільки «за можливості». Це майже відповідає кількості громадян, готових до вакцинації станом на кінець травня 2021 р., — (48,2±1,1)%. Високий рівень епіднастороженості, для якого характерні впевненість у реальній ситуації та запроваджених заходах, відзначався у 119 осіб — (21,6±1,8)% респондентів. Низький рівень мав 121 опитаний — (22,0±1,8)%. Лише у 11 осіб — (2,0±0,6)% сума балів відповідала рівню, що свідчить про відсутність епіднастороженості.
Висновки
- Структура суб’єктивного ставлення громадян України до небезпеки коронавірусної інфекції через 18 місяців після оголошення пандемії близька до закону нормального розподілу імовірностей Гаусса, оскільки більша частина опитаних (54,4%) має «середній» рівень епіднастороженості, а сусідні з ним рівні —«низький» і «високий» практично віддзеркалюють один одного та складають відповідно 22,0% та 21,6%. Примітно, що відсоток людей з «середнім» рівнем епіднастороженості дуже близький до кількості громадян, готових до вакцинації проти COVID-19. Лише незначна частина респондентів (2,0%), є скептиками, що не сприймають пандемію як загрозу та категорично проти запроваджених в країні обмежувальних правил індивідуальної та суспільної поведінки.
- На тлі соціальних потрясінь, до яких можна долучити і пандемію, зазвичай відбувається розшарування громадської думки щодо ефективності дій влади. В нашому досліджені з’ясовано, що більшість респондентів (48,5%) визнають вжиті в країні заходи своєчасними. Водночас скептично до оперативності дій влади ставиться майже третина громадян (31,9%), ще 30,9% респондентів, вважають упроваджені заходи неадекватними (неефективними). Лише 15,8% опитаних повністю підтримують дії влади, а ще 33,7% підтримують частково.
- Проведене опитування засвідчило тенденцію щодо зв’язку між ставленням до карантинних обмежень і ступенем ділової активності населення різних регіонів та вікових груп, оскільки карантин суттєво обмежив звичний ритм життя одних і майже не вплинув на інших. Найменшу підтримку карантинні обмеження мали серед населення західних областей з високою трудовою міграцією — Волинської, Закарпатської, Рівненської (52,4%), м. Києва (65,0%) і Київської області (72,2%), а також жителів великих міст (71,7%) та працюючих осіб (73,6%).
В. І. Задорожна
ЕВОЛЮЦІЙНІ ТЕНДЕНЦІЇ ПТАШИНИХ ВІРУСІВ ГРИПУ ТА ЇХ РОЛЬ ЯК ЗБУДНИКІВ ЗООНОЗНОГО ГРИПУ В ЛЮДЕЙ
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
Е-mail: viz2010@ukr.net
Генетичне розмаїття вірусів грипу А птахів та ссавців зумовлюють їх високий еволюційний і зоонозний потенціал. Цьому сприяє сегментарна будова геному вірусів, полегшуючи реасортацію генів при одночасному інфікуванні двома або більше варіантами збудника. Тому постійно існують ризики утворення нових для людини вірусів грипу, здатних до подолання міжвидових бар’єрів та набуття пандемічного потенціалу. Значну увагу привертають високопатогенні віруси грипу птахів, але не виключена можливість набуття низькопатогенним вірусом потенціалу високопатогенного, як це сталося з вірусом A(H5N6) у 2014 році. Щороку з’являються повідомлення про окремі або групові випадки захворювання людей на пташиний грип, пов’язаний з тими чи іншими підтипами вірусу. Ця ситуація потребує постійного моніторингу як із вірусологічної, так і епідеміологічної позицій з метою готовності до протидії та недопущення потенційної пандемії.
Надзвичайну роль відіграє пташиний грип щодо економічних наслідків через вибракування мільйонів птахів та значних економічних втрат. Зокрема, у Великій Британії протягом року було утилізовано понад 5,5 млн птахів. Спалах пташиного грипу у США в 2022 р. призвів до загибелі близько 40 млн тварин.
Аналізуючи ситуацію щодо зоонозного потенціалу пташиного грипу, починаючи з 2019 р., слід відмітити тенденцію до зростання зареєстрованих випадків серед людей, саме під час пандемії COVID-19. У 2019 р. ВООЗ офіційно не повідомляла про спалахи пташиного грипу серед людей. Однак у 2021 та 2022 рр. у Китаї було зареєстровано 2 випадки грипу у людей, пов’язані з новими для людини вірусами грипу (А(H10N3) та А(H3N8) відповідно), а в 2021 р. у росії ідентифікували у 7 людей новий для людини вірус A(H5N8) під час спалаху серед птиці на птахофермі. Також випадок грипу, пов’язаний із вірусом А(H3N8), був зареєстрований і в 2023 році. При цьому обидва випадки, викликані цим вірусом, характеризувалися важким перебігом, зокрема 1 закінчився летально. Отже, тільки протягом 2 років було визначено 3 нових пташиних віруси грипу, здатних викликати захворювання у людей.
Починаючи з 2022 р., спостерігається тенденція до зростання захворюваності й на пташиний грип A(H5N1). Згідно з даними CDC (Атланта, США), із січня 2022 р. по 29 червня 2023 р. у 8 країнах було зареєстровано 13 спорадичних випадків серед людей (Велика Британія — 2, В’єтнам — 1, Еквадор — 1, Іспанія — 2, Камбоджа — 2, Китай — 1, США — 1, Чилі — 3), зокрема 6 — із тяжким клінічним перебігом, із них 2 випадки смерті, 2 випадки легкого перебігу та 5 безсимптомних випадків. Привертає увагу той факт, що в 2022 р. випадки були зареєстровані у Великій Британії, Іспанії та США. У 2023 р. ВООЗ повідомила про безпрецедентний спалах грипу А(H5N1) серед свійської та сільськогосподарської птиці, диких птахів і морських ссавців у Чилі (тоді ж вірус А(H5) був виділений від пацієнта у рамках рутинного епіднагляду за тяжкими гострими респіраторними інфекціями), а також про спалах цієї інфекції серед котів у Польщі. Спорадичні випадки зараження котів цим вірусом відзначалися і раніше, проте це 1-й випадок їх масового інфікування на широкій географічній території в межах однієї країни.
У 2020–2022 рр. зросла й кількість випадків пташиного грипу серед людей, викликаного вірусом A(H5N6), який раніше вважався низькопатогенним, а набув ознаки високопатогенного за рахунок потрійної реасортації генів лише в 2014 р., тоді ж було зареєстровано перше захворювання у людини. Привертає увагу той факт, що із 76 випадків, зареєстрованих на момент 2022 р., 54 випадки трапились у 2020–2022 рр. (4 країни, зокрема 47 у Китаї, серед яких 18 летальних). Це викликає настороженість стосовно подальшої «поведінки» цього вірусу, а саме: ризику його адаптації до людської популяції.
На нашу думку, та тенденція, що спостерігається у світі, починаючи з 2021 р., тобто на тлі пандемії COVID-19, щодо зростання випадків пташиного грипу серед людей та ідентифікації нових підтипів вірусу грипу із зоонозним потенціалом, значною мірою може бути пов’язана із зростанням обсягу вірусологічного обстежен- ня випадків тяжкого гострого респіраторного синдрому в межах епідеміологічного нагляду за COVID-19, а також реалізації рутинного епідеміологічного нагляду за грипом на тлі зниження інтенсивності циркуляції сезонних вірусів грипу, що значно підвищило ефективність епідеміологічного нагляду за зоонозним грипом. Однак молекулярно-генетичні зміни зоонозних вірусів грипу, які простежуються за цей період та описані низкою авторів, зокрема й такі, що дозволяють вірусам уникати післявакцинальної імунної відповіді у птахів, а також розпізнавати рецептори людських клітин SAα2,6Gal, підтверджують існуючі ризики набуття зоонозними вірусами епідемічного/пандемічного потенціалу та необхідність постійного моніторингу цього процесу.
В. І. Задорожна1, І. Л. Маричев1, С. І. Брижата1, І. І. Кисляк2
ЗАХВОРЮВАНІСТЬ НА КАШЛЮК В УКРАЇНІ НА ТЛІ ПАНДЕМІЇ COVID-19
1. ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
2. ДУ «Центр громадського здоров’я МОЗ України», м. Київ, УкраїнаЕ-mail: viz2010@ukr.net
Кашлюк залишається актуальною проблемою сьогодення як для дітей, так і для дорослих. Згідно з даними ВООЗ, на кашлюк щорічно хворіє близько 60 млн осіб, переважно дітей перших років життя. В Україні спостерігається зниження захворюваності на кашлюк на тлі низького рівня охоплення щепленнями.
Мета. Аналіз епідситуації з кашлюку в України за період 2020–2022 років.
Матеріали і методи. Матеріалами для вивчення були річні звіти статистичних форм МОЗ України та ДЗ «Український центр з контролю та моніторингу захворювань МОЗ України».
Результати. Аналіз епідемічної ситуації із захворюваності на кашлюк населення України протягом 3-х (2020–2023 рр.) останніх років показав, що рівень захворюваності в цей період коливався в межах від 2,48 до 0,08 на 100 тис. населення.
Починаючи з 2020 р., захворюваність серед всього населення поступово почала знижуватись, і в 2022 р. її показник набув свого мінімального значення – 0,08‰00. У дітей до 17 років цей показник становив: 13,23–0,42‰00, а у дорослого населення: 0,11–0,003‰00.
У 2020 р. в Україні було зареєстровано 1 041 випадок захворювання на кашлюк (2,48‰00). На дітей припадало 96% від загальної кількості захворілих. Основними групами ризику були діти до 1 року, 1–4 років та 5–9 років. Показник захворюваності в цих вікових групах у 2020 р. досягав 62,84‰00, 20,35‰00 та 12,64‰00 відповідного віку. У 2020 р. був зареєстрований низький рівень захворюваності в Луганській та в Чернігівській областях (0,05‰00.), а найбільша кількість випадків реєструвалась у Харківській області (4,02‰00).
З 2021 р. реєструється подальше зниження захворюваності на кашлюк серед всього населення в Україні (0,22 ‰00), а серед дітей до 17 років до 1,14 ‰00. Зниження захворюваності спостерігається в усіх вікових групах. Найбільш ураженою групою серед дітей були діти віком до одного року (показник — 3,58‰00 відповідного віку). За цей період найбільша кількість випадків реєструвалась у Харківській області (22,38‰00), а найменша в Рівненській області (8,21‰00). В 19 областях випадки кашлюку взагалі не реєструвались.
Аналіз епідситуації з кашлюка в Україні за 2022 р. показав, що захворюваність серед всього населення продовжує реєструватись на низькому рівні. Зокрема, за рік усього було зареєстровано 32 випадки кашлюка (0,08‰00) в 11 регіонах та в м. Києві, з них 31 випадок (0,42‰00) — серед дітей до 17 років: у віковій групі до 1 року — 4 випадки (1,37‰00), 1–4 роки — 14 (1,0), 5–9 років – 11 випадків (0,48), 10–14 років — 1 випадок (0,04), 15–17 років — 1 (0,08). 1 випадок кашлюку був зареєстрований серед дорослих (0,003‰00). В 2022 р. найбільшу кількість випадків захворювання на кашлюк зареєстровано в Закарпатській та в Івано-Франківській областях (0,40‰00 та 0,37‰00 відповідно), а в 13 областях взагалі зареєстровано не було.
За 2020–2022 рр. показники охоплення профілактичними щепленнями проти кашлюка в Україні залишались низькими. Вакцинація АКДП до 1 року протягом цього періоду склала 72,9–80,1%, а в 18 міс. — 71,9–78,0%.
Висновки. Отже, враховуючи низький рівень охоплення щепленнями дітей вакциною АКДП, подальше поширення серед населення COVID-19, високі темпи міграції дитячого населення та у зв’язку з військовою агресією рф відбувається накопичення прошарку неімунних до кашлюку осіб, що формує умови та ризики підвищення рівня захворюваності на цю вакцинокеровану інфекцію.
В. І. Задорожна1, І. Л. Маричев1, С. І. Брижата1, І. І. Кисляк2
ЗАХВОРЮВАНІСТЬ НА КРАСНУХУ В УКРАЇНІ НА ТЛІ ПАНДЕМІЇ COVID-19
1. ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
2. ДУ «Центр громадського здоров’я МОЗ України», м. Київ, Україна
Е-mail: viz2010@ukr.net
Вакцинопрофілактика краснушної інфекції проводиться практично в усіх розвинутих країнах у відповідності з національними програмами, основною метою яких є попередження народження дітей з синдромом вродженої краснухи (СВК). Офіційна реєстрація краснухи в Україні впроваджена з 1979 року. Вперше імунізацію проти краснухи в Україні було введено наказом МОЗ України №14 від 25.01.1996 року. Проте масова вакцинопрофілактика краснухи в Україні почалася у 2000–2001 рр., для щеплення дітей та підлітків використовували як моновакцини, так і комбіновані вакцини різних закордонних виробників, зареєстровані на той час в Україні.
Мета. Аналіз епідситуації з краснухи в Україні за період 2020–2022 років.
Матеріали і методи. Ретроспективний епідеміологічний аналіз за матеріалами статистичних звітів МОЗ України та ДУ «Центр громадського здоров’я МОЗ України».
Результати. Ретроспективний за 2020–2022 рр. епідеміологічний аналіз захворюваності на краснуху серед всього населення показав, що рівень захворюваності в цей період коливався в межах від 0,09 до 0,019‰00. Протягом 2020–2021 рр. реєструвалось значне зниження захворюваності на краснуху серед всього населення з 0,09‰00 (у 2020 р.) до 0,05‰00 (у 2021 р.). У дітей до 17 років цей показник становив: 0,26–0,17‰00, а у дорослого населення: 0,05–0,02‰00.
Захворюваність на краснуху серед дітей до 17 років була в 5,2 (2020 р.) та в 8,5 (2021 р.) разів вища, ніж серед дорослих.
У 2020 р. в Україні було зареєстровано 36 випадків краснухи (0,09‰00). За цей рік низькі рівні захворюваності зареєстровані в областях: Донецька (0,05‰00) та Харківська (0,08‰00). В 15 областях захворюваність на краснуху зовсім не реєструвалась. Низький рівень захворюваності на краснуху в містах становив 0,11‰00, а в сільський місцевості — 0,04 ‰00.
В 2021 р. в Україні зареєстровано 20 випадків краснухи (0,05‰00). У цьому році також був зареєстрований низький рівень захворюваності в Харківській області (0,04‰00). В 17 областях захворюваність на краснуху зовсім не реєструвалась.
Рівень захворюваності на краснуху в міській та в сільській місцевості становив: 0,05 та 0,04‰00.
Аналіз епідситуації з краснухи в Україні за 2022 р. показав, що рівень захворюваності серед всього населення продовжував реєструватись на низькому рівні. Зокрема, всього було зареєстровано 8 випадків краснухи (0,017‰00) в 5 регіонах та в м. Києві. Серед дітей був один випадок краснухи (0,01‰00), у дитини до 1 року (0,34‰00). У дорослих зареєстровано 7 випадків (0,02‰00). В 20 областях України захворюваність на краснуху зовсім не реєструвалась.
Висновки. У зв’язку з військовою агресією, пандемією COVID-19, масовою міграцією населення на тлі зниження рівня офіційної реєстрації випадків краснухи існує можливість виникнення спалахів краснухи в Україні. Захворюваність на краснуху залишається однією з найважливіших та найактуальніших проблем сьогодення не тільки для дитячого населення, а й для жінок дітородного віку як потенційної загрози розвитку СВК.
О. М. Кислих, О. В. Максименок
ВЕРИФІКАЦІЯ АЛГОРИТМІВ ТЕСТУВАННЯ НА ВІЛ З ВИКОРИСТАННЯМ ШВИДКИХ ТЕСТІВ
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
Е-mail: olenakyslykh@gmail.com
Забезпечення точної, своєчасної та доступної за вартістю діагностики ВІЛ-інфекції є пріоритетним заходом, спрямованим на досягнення поставлених перед Україною глобальних цілей подолання епідемії, а саме: отримання результатів досліджень гарантованої якості для забезпечення 95% людей, які живуть з ВІЛ, знанням про свій статус. Своєчасне встановлення діагнозу ВІЛ-інфекції із застосуванням швидких тестів (ШТ) набуває особливого значення в умовах воєнного стану, коли доступ до обстежень із використанням інструментальних методів дослідження є обмеженим або взагалі недоступним.
Для встановлення точного діагнозу вкрай важливими є стандартизована стратегія тестування та використання продукції гарантованої якості, тоді як незадовільний вибір алгоритмів тестування може призводити до помилок діагностики. У Зведеному керівництві ВООЗ з послуг тестування на ВІЛ (редакція від 2019 р.) було рекомендовано єдину «стандартну» стратегію тестування на ВІЛ для всіх закладів, де проводиться таке обстеження — отримання трьох послідовних позитивних результатів серологічних аналізів на ВІЛ і спрощено схему аналізу випадків з дискордантними результатами проведених тестів.
Причини хибної діагностики багатофакторні та включають в себе помилки на різних етапах діагностичного процесу, однак неправильний підбір послідовності використання тестів в алгоритмі діагностики (наприклад, низька специфічність тестів другої і/або третьої лінії) вважають основним фактором появи значної кількості хибних лабораторних діагнозів.
Проведення верифікації алгоритмів тестування забезпечує можливість отримання об’єктивних фактичних даних щодо ефективності певної комбінації тестів для точної діагностики ВІЛ-інфекції перед їх масштабним впровадженням. Для цього в ході верифікації перевіряють відсутність у обраної продукції однакових помилкових результатів, що можуть призвести до невірного лабораторного діагнозу. Тому нагальним питанням для країни є необхідність визначити надійний національний алгоритм тестування з резервним алгоритмом для використання як альтернативного у випадках, коли з будь-яких причин виконання досліджень за основним алгоритмом є тимчасово неможливим.
Мета роботи: на підставі оцінки специфічності визначити найкращі комбінації ШТ, спільне використання яких забезпечить отримання гарантованих результатів тестування (з найменшою чи нульовою перехресною хибною реактивністю) в межах обраних алгоритмів тестування на ВІЛ.
Матеріали і методи. З архіву лабораторії епідеміології парентеральних вірусних гепатитів та ВІЛ-інфекції ДУ
«Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України» для формування верифікаційної панелі підбирали зразки крові пацієнтів, охарактеризованих щодо відсутності серологічних маркерів ВІЛ. Відповідно до рекомендацій фахівців ВООЗ, розмір вибірки у 230 зразків було визначено як достатній для виявлення не менше 2–8% хибно-реактивних результатів при використанні ШТ та виявлення їхнього сукупного рівня хибної реактивності.
Дане верифікаційне дослідження базувалося на стратегії тестування на ВІЛ із послідовним використанням трьох найменувань ШТ: перший тест повинен бути найбільш чутливим (≥99% для визначення як дійсно, так і хибно позитивних зразків); другий та третій тести мали бути найбільш специфічними (≥98% для виявлення всіх хибно позитивних), при цьому передбачалося використання декількох різних ШТ для взаємозамінності. Відповідно до рекомендацій експертів ВООЗ, технічних та операційних характеристик потенційних тестів-кандидатів для верифікаційного дослідження було обрано 7 найменувань ШТ (по 2 серії кожного найменування).
Усі зразки верифікаційної панелі досліджували у випадковому (рандомізованому) порядку і сліпим способом — тестували по 5 зразків сироваток на 2-х серіях усіх 7 найменуваннях ШТ протягом однієї постановки у першій половині робочого дня (зранку до обіду) у точній відповідності до інструкцій виробників із застосування. Для візуальної оцінки результатів досліджень із застосуванням ШТ була використана шкала інтенсивності тестової лінії, за якою оцінювалися результати дослідження. Візуальна інтерпретація результатів за умови їх суб’єктивної оцінки проводилася двома інтерпретаторами незалежно один від одного (без їх відома щодо іншого варіанту оцінки результатів і статусу самого зразка з верифікаційної панелі).
При визначенні загального статусу кожного зразка брали до уваги результати, отримані на обох серіях конкретного ШТ. Результат, який збігався, підлягав обліку як остаточний; при невизначених результатах враховували ВІЛ-реактивний результат.
Результати. У процесі проведеного випробування 230 зразків сироваток верифікаційної панелі були протестовані із застосуванням 7 найменувань ШТ (по дві серії кожного найменування ШТ). Недійсних результатів тестування (відсутність контрольної смуги за наявності або відсутності тестової смуги) зафіксовано не було.
Всі 230 зразків з панелі показали негативний результат при тестуванні на обох серіях п’яти найменувань ШТ, відтак їх специфічність становила 100%, тобто всі негативні матеріали були оцінені як негативні.
На двох найменуваннях ШТ, що залишились, було отримано 7 хибнопозитивних результатів: 6 зразків були оцінені як хибнопозитивні на ШТ одного найменування та 1 — на іншому, при цьому не було зафіксовано перехресної хибної реактивності. Відповідно до отриманих даних, специфічність першого ШТ становила 97,5% з 95%ДІ (95,5–99,5%), а другого — 99,6% (95% ДІ (98,8–100%)).
Висновки
Для всіх ШТ, за даними випробувань, зі зразками верифікаційної панелі не було зафіксовано перехресної хибної реактивності. Обидва ШТ, на яких були зафіксовані хибнопозитивні результати, можуть бути запропоновані для вибору тільки як тести першої лінії в алгоритмах тестування, водночас як інші п’ять найменувань ШТ можуть бути застосовані як тести першої, так і другої/третьої ліній. Отримані дані підтверджують дієвість застосування алгоритмів тестування ШТ для діагностики ВІЛ-інфекції, що на сьогодні використовуються в Україні. Оцінку ефективності алгоритмів тестування на ВІЛ в країні потрібно періодично повторювати із застосуванням діагностикумів, що мають різні антигенні компоненти або засновані на різних принципах дії.
П. Г. Коваленко1, З. Л. Усікова1, Я. В. Тур1, А. М. Коновалова1, І. А. Тарасова2, О. А. Слюсарев1, О. А. Ракша-Слюсарева1
ВПЛИВ ЗБУДНИКІВ УРОГЕНІТАЛЬНИХ ІНФЕКЦІЙ НА РЕПРОДУКТИВНУ ФУНКЦІЮ ЛЮДИНИ
1. Донецький національний медичний університет, м. Лиман, Україна
2. ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
Проблема відновлення репродуктивної функції людини в Україні досі залишається актуальною. Гострі та хронічні інфекції статевих шляхів є загальновідомими причинами безпліддя як у жінок, так і у чоловіків. У жінок однією з основних причин безпліддя є пошкодження маткових труб внаслідок перенесення урогенітальної інфекції. Більшість урогенітальних захворювань репродуктивної системи чоловіків є захворюваннями, які призводять до погіршення сперматогенезу, порушення функції сперми та/або закупорки сім’яних шляхів. Найчастіше з безпліддям пов’язують такі інфекції, як гонорея, хламідіоз, викликані анаеробами або факультативними, або аеробами, що спричиняють запальні реакції органів малого тазу. Хламідійні інфекції можуть протікати безсимптомно, а викликаний ними сальпінгіт часто називають тихим запальним захворюванням органів малого тазу.
Мета роботи: вивчити розповсюдженість збудників урогенітальних інфекцій у пацієнтів з порушеннями репродуктивного здоров’я серед осіб, які мешкають у м. Кропивницький Кіровоградської області.
Матеріали і методи. На наявність збудників урогенітальних інфекцій було обстежено 364 особи: 126 чоловіків та 238 жінок із симптомами порушення фертильної функції, які лікувались на базі ПП «Лікарня Святого Луки». Вік обстежених у середньому становив (39,2±0,13) років.
Результати. Під час проведених досліджень у 158 осіб — (43,4±0,31)%, які лікувались, було виявлено збудники урогенітальних інфекцій. Серед чоловіків збудники урогенітальних інфекцій були виявлені у (39,6±0,38)% обстежених, а серед жінок — у (45,4±0,2)%. Мікст-інфікування було виявлено у (16,48±0,1)% обстежених осіб, зокрема у (26,6±0,73)% чоловіків і (73,3±0,72)% жінок. Тобто урогенітальна інфекція й зокрема мікст-інфекція вірогідно частіше (p<0,05) виявлялась у жінок.
Серед збудників урогенітальних інфекцій у обстеженого контингенту загалом найчастіше виявлялись такі, як Ureaplasma parvum — (13,7±0,99)%, Gardnerella vaginalis — (11,5±0,53)%, Mycoplasma hominis — (10,9±0,51)%, Chlamydia trachomatis — (7,7±0,44)%. У чоловіків найчастіше виявлялись такі збудники, як Gardnerella vaginalis — (22,2±0,83)% та Ureaplasma parvum — (12,7±0,73)%. У жінок найчастіше виявлялись Ureaplasma parvum — (14,3±0,7)% та Mycoplasma hominis — (11,86±0,64)%.
Опираючись на дані зарубіжних досліджень, прослідковується негативний вплив виявлених збудників на репродуктивне здоров’я людини. Раннє розпізнавання інфекції, швидке призначення відповідної антибіотикотерапії та належне спостереження є важливими для запобігання наслідкам запальних захворювань органів малого тазу. Хірургічне втручання може знадобитися для лікування негайних або віддалених наслідків інфекції. Профілактика інфекцій органів малого тазу має бути першочерговою.
Висновки. В результаті дослідження встановлено, що порушення репродуктивного здоров’я у жінок було вірогідно частіше пов’язано з виявленням урогенітальної інфекції, ніж у чоловіків. При цьому у чоловіків з порушеннями репродуктивного здоров’я була виявлена вища поширеність Ureaplasma parvum і Gardnerella vaginalis, а у жінок — Mycoplasma hominis і Chlamydia trachomatis. Отримані дані свідчать про необхідність подальших досліджень та ідентифікацій всього спектру негативних наслідків зараження урогенітальною інфекцією щодо репродуктивної функції чоловіків і жінок.
В. О. Коршенко1, А. В. Хайлов2, С. М. Пивовар2, Л. М. Руденко2
ОСОБЛИВОСТІ ПОШИРЕННЯ ЛЕПТОСПІРОЗНОЇ ІНФЕКЦІЇ НА ПОЛТАВЩИНІ
1. Полтавський державний медичний університет, м. Полтава, Україна 2ДУ «Полтавський обласний центр контролю та профілактики хвороб МОЗ України», м. Полтава, Україна
Е-mail: rod1965@ukr.net
Лептоспіроз залишається найбільш розповсюдженим зоонозом у світі з високим ступенем летальних випадків та інфекцією в групі зоонозів, яка завдає у різних країнах світу значних економічних та соціальних збитків (ВООЗ, 2005). В Україні він реєструється щорічно. Спостерігаються як спорадичні, такі групові захворювання, що протікають в значному відсотку випадків з важкою клінічною картиною та нерідко з летальним наслідком. Летальність від лептоспірозу не знижується і в останні роки складає до 10%. Крім того, в останній час трапляється підвищення захворюваності людей на лептоспірозну інфекцію зі значним збільшенням етіологічної ролі найбільш агресивних збудників серогрупи Icterohaemorrhagiae. На долю іктерогеморагічного лептоспірозу в окремих областях припадає більше 90%. При цьому переважна більшість летальних випадків цієї інфекції (до 94%) пов’язана з іктерогеморагічною формою.
Випадки захворювань людей на лептоспіроз у Полтавській області реєструються щорічно, оскільки ландшафтно-географічні умови території сприяють підтримці старих та утворенню нових природних осередків захворювання.
Матеріали і методи. Використовувались експедиційні форми роботи, а також проводилась робота в інших напрямах: збір клініко-епідеміологічних даних; екологічна експертиза і комплексне епідеміолого-епізоотичне обстеження території та об’єктів, плановий відлов гризунів та їх дослідження. За допомогою ретроспективного аналізу епідеміологічної ситуації та серологічного методу (реакція мікроаглютинації та лізису лептоспір з 13-ма штамами діагностичного набору) проведено оцінку і порівняння епідеміологічних та лабораторних характеристик лептоспірозу в Полтавській області за останні 27 років (1996–2022 рр.).
Як джерела інформації також використано аналітичні довідки, записи журналів реєстрації лабораторних досліджень, аналітичних довідок, звітів, узагальнені дані багаторічних епізоотологічних спостережень, досліджена динаміка активності природних осередків лептоспірозу.
Результати. Випадки захворювання людей на іктерогеморагічний лептоспіроз епідеміологічно пов’язані з основним резервуаром лептоспір цієї серогрупи — сірими пацюками. За період дослідження в регіоні було відловлено та комплексно обстежено 1 603 сірих пацюки, з яких у 376 (23,4%) були виявлені антитіла до лептоспір 7-ми серогруп, переважно (60,2%) до іктерогеморагічної.
Ретроспективний аналіз стану по лептоспірозу в північно-східному регіоні (1981–2022 рр.) дав змогу виявити основні епідеміологічні параметри. Лептоспіроз реєструється взагалі серед осіб найбільш активного працездатного віку (78,9%). Хворіють переважно чоловіки (77,8%). В епідемічний процес залучається як сільське (71,1%), так і міське населення (28,9%). Захворювання громадян переважно зв’язують з виїздом їх на відпочинок в зони, ензоотичні за лептоспірозом. Саме цим, вірогідно, пояснюється своєрідність сезонності (на липень–вересень припадає 74,6%).
Матеріалами епідеміологічного розслідування підтверджено значення водного характеру лептоспірозної інфекції (на частку водного фактору припадає 71,8%). Окрім купання, рибної ловлі та інших умов, за яких може відбуватися зараження людей, зберігають своє значення такі фактори, як косовиця на заболочених місцях, меліоративні та інші види робіт в умовах зволожених біотопів. Професійний характер зараження відмічено в 15,3% випадків. В цілому це був контакт (прямий або опосередкований) з тваринами-лептоспіроносіями в умовах тваринницьких господарств, м’ясопереробних та інших об’єктів.
Встановлено головні епідеміологічні характеристики лептоспірозної інфекції: літньо-осіння сезонність; основним фактором зараження залишається водний; частіше хворіють чоловіки (77,8%) і особи у віці 30–50 років; суттєво залучено в епідемічний процес мешканців селищ — 45% (в цілому по Україні — 55,4%).
Висновок. Всі природні вогнища лептоспірозів на Полтавщині виявлені у найтиповіших місцевостях лісових, лісостепових і степових ландшафтів. Загальною рисою всіх виявлених вогнищ є їх приуроченість до поймених і підпоймених терас найбільших річок (Сула, Псел, Ворскла), а також до низин їх притоків. Епізоотична активність вогнищ, що знаходилися під наглядом, доведена позитивними результатами бактеріологічних і серологічних досліджень. Враженість лептоспірами дрібних ссавців різних видів, що мешкають на досліджених природно вогнищевих територіях, склала 11,03%. Вивчення етіологічної структури лептоспірозів показало, що основне значення мають лептоспіри серогрупи Icterohaemorrhagiae — 73,4%, інші випадки захворювань людей зумовлені збудниками серогрупи Pomona — 9,3%, Grippotyphosa — 6,1%, Hebdomadis — 5,7%. Офіційно зареєстрована захворюваність населення на лептоспіроз не відповідає дійсним проявам епідемічного процесу, що є наслідком неповного виявлення захворювань і недосконалістю епіднагляду. Сукупність ознак клінічних і епідеміологічних проявів лептоспірозної інфекції, які найчастіше зустрічаються, в конкретних умовах може бути використана як критерій відбору хворих з неясними діагнозами для їх цілеспрямованого лабораторно-діагностичного обстеження та сприятиме більш повному виявленню патології населення, що зумовлена лептоспірами.
В. І. Макарова1, Т. О. Чумаченко1, Ю. М. Бубнова2
РЕЗУЛЬТАТИ МІКРОБІОЛОГІЧНОГО ДОСЛІДЖЕННЯ РАНОВИХ ПОВЕРХОНЬ ПАЦІЄНТІВ, ОТРИМАНИХ ПІД ЧАС БОЙОВИХ ДІЙ
1. Харківський національний медичний університет, м. Харків, Україна 2Комунальне некомерційне підприємство «Клінічна лікарня швидкої медичної допомоги» Дніпровської міської ради, м. Дніпро, Україна
Е-mail: vi.makarova@knmu.edu.ua
Найпоширенішим патологічним станом під час війни є поранення. Особливістю таких ран є розвиток інфекційних ускладнень, серед яких гнійна інфекція є однією із найнебезпечніших. Україна, як країна, що перебуває в стані воєнного конфлікту з росією, має величезну кількість постраждалих військових та цивільних громадян з численними пораненнями, лікування яких є складним та тривалим. Мікробіологічне дослідження ранових поверхонь є необхідним компонентом діагностичного процесу, яке дозволяє оптимізувати тактику лікування з призначенням антимікробних препаратів та дозволяє отримати дані для епідеміологічного нагляду за інфекціями, що пов’язані з наданням медичної допомоги.
Мета дослідження. Оцінити результати мікробіологічного дослідження ранових поверхонь пацієнтів, яке було проведено у закладі охорони здоров’я (ЗОЗ) за період з 01 січня 2023 р. по 31 травня 2023 р. та аналогічний період 2022 року.
Матеріали та методи. Ретроспективний аналіз результатів мікробіологічного дослідження ранових поверхонь пацієнтів, які отримали поранення під час бойових дій та перебували на лікуванні в ЗОЗ за період з 01 січня 2023 р. по 31 травня 2023 р. та аналогічний період 2022 року.
ЗОЗ надає вторинну спеціалізовану медичну допомогу, у складі має хірургічні відділення, відділення політравми та гінекологічне відділення. Власної мікробіологічної лабораторії ЗОЗ не має, але укладено договір з лабораторією, яка надає послуги з мікробіологічного дослідження зразків біологічного матеріалу. Мікробіологічне дослідження ранових поверхонь проводиться за запитом лікаря.
Результати. Всього за період з 01 січня 2023 р. по 31 травня 2023 р. ЗОЗ направив 242 зразки біологічного матеріалу, а саме: ранової поверхні, для мікробіологічного дослідження. В порівнянні з аналогічним періодом 2022 р., кількість зразків біологічного матеріалу збільшилась в 2 рази (141 зразок в 2022 р.), що свідчить про збільшення кількості пацієнтів з ускладненими ранами, які загоюються більш тривалий час.
Кількість зразків, в яких було виявлено патогенні біологічні агенти в 2023 р. склала 137, тобто 56,6% обстежених пацієнтів з пораненнями мають ранові поверхні, які контаміновані патогенними мікроорганізмами, в 2022 р. аналогічний показник дорівнював 54,6% (77 позитивних зразків біологічного матеріалу). Водночас у 34,7% зразків виявлені виключно непатогенні представники мікробіому шкіри та слизових оболонок. Структура збудників, що були виявлені при мікробіологічних дослідженнях у 2023 та 2022 рр., представлена на рис. 1, рис. 2.

При аналізі структури виявлених збудників встановлено, що найчастіше в ранових поверхнях в 2023 р. виділяли E. сoli, K. pneumoniae та P. aeruginosa. Питома вага ранових поверхонь, контамінованих E. сoli дорівнювала 35,0%, K. рneumoniae була виділена у 21,9% позитивних зразків біологічного матеріалу, відсоток зразків, в яких було підтверджено наявність P. аeruginosa склала 16,8%. Окрім цього, з ранових поверхонь було виділено таких збудників, як E. cloacae, S. aureus, A. baumannii, Acinetobacter spp., питома вага яких в структурі виявлених збудників склала відповідно 2,2%, 6,6%, 4,4%, 13,1%. При порівнянні структури патогенних збудників, виділених з ранових поверхонь пацієнтів за аналогічний період 2022 р. встановлено, що були виявлені аналогічні збудники, але питома вага E. сoli, P. аeruginosa та A. baumannii в структурі збудників була вищою і склала відповідно 45,5%, 23,4% та 9,1%.
Висновок. Результати мікробіологічного дослідження ранових поверхонь пацієнтів виявили превалювання анаеробних грам-негативних збудників, факторами передачі яких можуть бути вода, продукти харчування, медичний інструментарій, медичне та технічне обладнання, розчини антисептиків та дезінфектантів, руки медич- ного персоналу, що потребує удосконалення інфекційного контролю в ЗОЗ. Такі дані важливі для формування власної локальної бази циркулюючих в ЗОЗ збудників та чутливості мікроорганізмів до антимікробних препаратів.
В. Ф. Марієвський, А. М. Щербінська, М. Г. Люльчук
ФАКТОРИ, ЩО ВПЛИВАЮТЬ НА ЕПІДЕМІЧНИЙ ПРОЦЕС ВІЛ-ІНФЕКЦІЇ В УМОВАХ ВОЄННОГО СТАНУ В УКРАЇНІ З ПОЗИЦІЙ ВЧЕННЯ АКАДЕМІКАЛ. В. ГРОМАШЕВСЬКОГО
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
Е-mail: mvf1945@ukr.net
П’ятий закон загальної епідеміології, сформульований Л. В. Громашевським в середині минулого століття, визначає роль природних та соціальних явищ в кількісних та якісних змінах під час епідемічного процесу як його опосередкованих рушійних сил. На сьогодні цей закон не тільки не втратив свого значення при формуванні стратегії та тактики боротьби з інфекціями, а навпаки, його положення затверджені на законодавчому рівні. Зокрема, в Законі України про систему громадського здоров’я, який вступив у дію з 01.10.2023 р. (стаття 1 п.6), визначено детермінанти здоров’я як комплекс індивідуальних, соціальних, економічних і екологічних факторів. Соціальні детермінанти — доступ харчових продуктів, житла, освіти, медичної допомоги. І хоча наука про соціальні детермінанти здоров’я все ще розвивається, зростаюча кількість біологічних, епідеміологічних та соціальних наукових досліджень виявила всеосяжний і міцний зв’язок між низкою соціальних факторів, які формують умови життя та праці, й широким спектром наслідків для здоров’я. В результаті на сьогодні вже визначено перелік захворювань, насамперед інфекційного ґенезу, які вважаються соціальними. До таких інфекцій передусім належить ВІЛ-інфекція/СНІД, пандемія якої продовжується більше 40 років, і яка залишається серйозною глобальною проблемою громадського здоров’я, що забрала 40,4 млн життів і продовжує забирати їх у всіх країнах світу. Тільки за роки незалежності від СНІДу померло більше 50 тисяч українців; щодня в Україні в середньому реєструється 33 випадки захворювання на ВІЛ-інфекцію, у 9 хворих діагностують СНІД, 5 осіб помирають від СНІДу. Згідно з даними Центру громадського здоров’я МОЗ України (далі — ЦГЗ), станом на 01.01.2022 р. кількість людей, які живуть з ВІЛ (ЛЖВ), становила 244 877 осіб, під медичним наглядом перебувало 183 929, отримували антиретровірусну терапію (АРТ) 152 226 осіб. Згідно з даними Об’єднаної програми ООН з ВІЛ/СНІДу (ЮНЕЙДС), за останнє десятиліття в Україні було впроваджено наймасштабніші та найуспішніші заходи у відповідь на ВІЛ у Європі. В результаті на кінець 2021 р. кількість ЛЖВ, які знали про свій статус, збільшилась з 56% в 2013 р. — до 75%, показник охоплення АРТ зріс удвічі й досяг рівня 83%.
Однак розпочата рф в 2014 р. війна з анексією Криму та частково територій Донецької і Луганської областей України і повномасштабне її вторгнення в 2022 р. поставили під загрозу виконання Державної стратегії у сфері протидії ВІЛ-інфекції/СНІДу, туберкульозу та вірусним гепатитам на період до 2030 року. Відомо, що війни чи інші збройні конфлікти завжди являють собою трагічне соціальне явище, що вкрай негативно впливає на усі сфери життя суспільства як під час воєнних дій, так і довгий час після їх завершення.
Мета даної роботи — проаналізувати вплив соціальних факторів, зумовлених військовими діями, на епідемічний процес ВІЛ-інфекції як основи для розробки ефективних профілактичних заходів під час війни та після її закінчення.
Результати аналізу даних вітчизняної та зарубіжної літератури, інших інформаційних матеріалів свідчать, що вплив війни великою мірою позначається на міграційних процесах, внутрішніх та зовнішніх, які супроводжуються ростом бідності, безробіття, дезорганізацією медичної інфраструктури та руйнацією інших соціальних послуг для населення. Як зазначає Міжнародна організація з міграції (2002 р.), міграція є найсильнішим єдиним предиктором ризику поширення ВІЛ.
З початком повномасштабної війни на території України перед охороною здоров’я постали проблеми із забезпеченням системного епіднагляду за ВІЛ-інфекцією, наданням послуг з тестування, лікуванням та клініко-лабораторним моніторингом перебігу ВІЛ-інфекції/СНІДу серед ЛЖВ, профілактикою ВІЛ-інфекції в ключових групах населення, насамперед у південно-східних, неконтрольованих Україною, регіонах.
Оцінюючи ситуацію, що склалась в Україні з початком війни, представник ЮНЕЙДС М. Казачкін зазначив, що Україна до 2022 р. була однією з найуспішніших країн у регіоні щодо гарантованого доступу до антиретровірусних препаратів. Оскільки послуги з лікування та профілактики перериваються в Україні на тлі війни, смертність від ВІЛ-інфекції, туберкульозу, а також мультирезистентного туберкульозу може швидко зростати. Крім того, перерви у лікуванні сприятимуть зростанню ризику формування та поширення резистентних форм ВІЛ-інфекції. Негативні наслідки війни вийдуть і за межі України, оскільки понад мільйон біженців (зокрема ЛЖВ) виїхали до сусідніх країн Центральної Європи, рятуючи життя. Підтвердженням вказаного є статистичні дані ЦГЗ, які свідчать, що станом на 01.04.2023 р. загальна кількість ЛЖВ, які отримували АРТ, зменшилася до 120 980 осіб.
При аналізі зарубіжних публікацій ми звернули увагу на той факт, що в переважній більшості джерел наведено результати досліджень впливу збройних конфліктів на епідемію ВІЛ/СНІДу в країнах африканського регіону, оскільки, як з’ясувалось, протягом останньої чверті століття жоден регіон світу не постраждав від широкомасштабних жорстоких конфліктів так гостро, як африканський: кількість держав, які брали участь у значних насильницьких конфліктах, подвоїлася між 1989 і 2000 роками (з 11 до 22). Встановлено також, що більшість досліджень, пов’язаних з епідемією ВІЛ/СНІДу, проводилися серед загальної популяції населення і лише невелика кількість із них присвячені аналізу впливу різних соціальних детермінант, зумовлених збройними конфліктами, на поширеність та захворюваність на ВІЛ/СНІД серед переміщеного населення.
Деякі автори вважають, що конфлікти значною мірою сприяли поширенню ВІЛ-інфекції та стали причиною глобальної епідемії в країнах Африки. Інші дослідники не виявили достатніх доказів зв’язку між конфліктом і поширеністю ВІЛ, вони вважають, що передача ВІЛ збільшується внаслідок масових переміщень населення на тлі конфлікту, відсутності продовольчої безпеки та зростання бідності, від чого постраждале населення стає більш вразливим до інфікування ВІЛ. У низці публікацій автори робіт зазначають, що розбіжності в результатах оцінки впливу збройних конфліктів на ВІЛ/СНІД пояснюються тим, що збройний конфлікт неминуче призводить до збільшення поширеності ВІЛ, але скоріше його можна розуміти як фактор ризику, вплив якого може бути пом’якшеним або підсиленим іншими змінними факторами в причинно-наслідковому зв’язку. І хоча декілька опублікованих досліджень визначили збройний конфлікт як ключову причину глобальної епідемії ВІЛ, докази були рідкісними та суперечливими, а пов’язане з конфліктом збільшення поширеності ВІЛ-інфекції все ж таки відбувається через низку інших факторів, породжених конфліктом. Треба також враховувати, що з початком бойових дій в більшості випадків значно ускладнюється і навіть унеможливлюється збір та аналіз статистичних даних щодо епідемічної ситуації.
До похідних факторів війни передусім належить масова міграція населення. Масові міграційні процеси призводять до формування умов, у яких змінюються поведінкові стосунки, насамперед статеві: це незахищений секс, часта зміна партнерів, насильство та ґвалтування, зокрема дітей та підлітків, які залишились без опіки дорослих. Секс розглядається часто як стратегія виживання в умовах зубожіння та голоду. Міграція призводить до соціального змішування населення, як фактору інтенсифікації механізму передачі ВІЛ.
Часто в районі бойових дій відбувається насильство та ґвалтування місцевих жителів з боку комбатантів, поширюються гомосексуальні стосунки з частою зміною партнерів.
Війна призводить до руйнування системи охорони здоров’я, що, зі свого боку, унеможливлює забезпечення АРТ, своєчасну діагностику, проведення профілактичної та освітньої роботи.
Висновок. Результати наведених матеріалів свідчать про те, що встановити безпосередній вплив війни на епідемічний процес з ВІЛ-інфекції/СНІДу за наявними даними важко. Водночас доведено, що війна є головним соціальним фактором, що породжує похідні фактори, які в тій чи іншій мірі мають безпосередній вплив на інтенсифікацію механізму передачі ВІЛ серед населення та значною мірою перешкоджають проведенню тактичних і стратегічних заходів, спрямованих на подолання епідемії ВІЛ/СНІДу. Чітке розуміння явищ, породжених війною в Україні та їх впливу на поширення ВІЛ/СНІДу, має вирішальне значення для розробки ефективних і адекватних стратегій зниження ризику інфікування населення ВІЛ як під час війни, так і після її закінчення.
О. Г Мацьков, І. І. Яницька, М. С. Панасюк
ЕФЕКТИВНІСТЬ ВИКОНАННЯ ГІГІЄНІЧНОЇ ОБРОБКИ РУК МЕДИЧНИМИ ПРАЦІВНИКАМИ ЗАКЛАДІВ ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ В 2022 РОЦІ
Незважаючи на те, що рекомендована Всесвітньою організацією охорони здоров’я (далі — ВООЗ) техніка проведення гігієни рук (далі — ГР) була офіційно затверджена для використання в закладах охорони здоров’я України з 2010 р., не було передбачено обов’язкового проведення навчання та моніторингу дотримання ГР. Наказом Міністерства охорони здоров’я України від 03 серпня 2021 р. №1614, зареєстрованого в Міністерстві юстиції України 11 жовтня 2021 р. за №1318/36940, затверджено Інструкцію з впровадження покращення гігієни рук в закладах охорони здоров’я та установах/закладах надання соціальних послуг/соціального захисту населення, яка передбачає використання мультимодального підходу до впровадження ГР, зокрема проведення моніторингу за її дотриманням.
Мета: визначити ефективність гігієнічної обробки рук медичних працівників (далі — ГОР) при застосуванні техніки, рекомендованої ВООЗ, в Україні у 2022 році.
Матеріали та методи. Ми оцінювали знання та навички медичних працівників щодо ГОР. Для збору даних використовували стандартизовану форму — Анкету оцінки знань та навичок медичних працівників із дотримання рекомендацій ВООЗ щодо техніки та показань до ГОР. У дослідженні взяли участь 407 медичних працівників з 9 закладів охорони здоров’я, які були обрані шляхом випадкового відбору, незалежно від статі, віку та спеціалізації.
Результати. Дослідження виявило низьку обізнаність медичних працівників: назвати п’ять базових показань до ГОР змогли менше половини респондентів (49,5%) (рис. 1).

Залежності рівня обізнаності від спеціальності (лікар чи сестра медична) працівників під час дослідження не встановлено.
Всі шість етапів ГОР виконали лише 55,7% медичних працівників, 11% виконали три і менше етапів з шести рекомендованих, а 4% проводили ГОР у такий спосіб, що відокремити етапи було неможливо (рис. 2).
Медичні працівники не дотримувалися послідовності етапів ГОР, п’ять етапів (кількісно) виконали 16,3% респондентів, проте лише 4,1% виконали ці етапи послідовно. Наявний помірний зв’язок між обізнаністю медичних працівників щодо показань до ГОР та володінням технікою її виконання (r=0,43), що може опосередковано свідчити про ефективність навчання медичних працівників. Сестри медичні продемонстрували кращі навички проведення ГОР, ніж лікарі, водночас обізнаність щодо показань та володіння технікою обробки рук не мають залежності від віку і статі медичних працівників.
Висновки. Ефективність ГОР має пряму залежність від тривалості та виконання всіх етапів відповідно до рекомендацій ВООЗ. В Україні 44,3% медичних працівників не володіють технікою обробки рук антисептиком, відповідно лікарі та сестри медичні неефективно проводять ГОР.
А. П. Міроненко, Л. В. Радченко, О. С. Голубка, Н. В. Тетерюк, І. В. Кравчук, І. Г. Захарчук
ДИНАМІКА МОЛЕКУЛЯРНО-ГЕНЕТИЧНИХ ЗМІН У ВІРУСАХ SARS-COV-2, ЩО ЦИРКУЛЮЮТЬ В УКРАЇНІ
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
Е-mail: miralla@ukr.net
Із грудня 2019 року світ пережив нечувану за масштабами пандемію, викликану новим респіраторним збудником — коронавірусом SARS-CoV-2, який має здатність до стрімкого поширення і передається через повітря від людини до людини. Людство вживало заходів протидії — від обмежувальних до специфічної вакцинації та лікування противірусними препаратами і моноклональними антитілами. Однак, хоча пандемія закінчилася, збудник інкорпорувався у людську популяцію і набув властивостей чинника сезонної хвороби.
Метою дослідження було слідкування за молекулярно-генетичними змінами у вірусах SARS-CoV-2, зміною їх варіантів та субваріантів за період з початку пандемії COVID-19 в Україні і до сьогоднішніх днів.
Матеріали і методи. Для аналізу молекулярно-генетичних змін у вірусах SARS-CoV-2 використовували базу даних GISAID, де представлені дані про секвеновані послідовності цього збудника з усього світу.
Нами було проведено молекулярно-генетичний аналіз вірусів SARS-CoV-2, які циркулювали в Україні з травня 2020 р. по серпень 2023 р. за даними послідовностей, завантажених до бази даних GISAID (www.gisaid.org). Було проаналізовано мутації, що виникли протягом усього періоду, що спричинило зміни генетичних варіантів та субваріантів вірусу SARS-CoV-2. Ми проаналізували генетичні послідовності 1 125 вірусів SARS-CoV-2, які циркулювали в Україні.
Результати. Протягом періоду спостереження відбулося накопичення мутацій у вірусі SARS-CoV-2, що призвело до змін його властивостей. За весь період спостережень зареєстровано 4 хвилі захворюваності на COVID-19, які були викликані різними варіантами вірусу SARS-CoV-2. Перша хвиля була викликана класичним, або Уханьським, штамом, друга — «Альфа» варіантом, третя — «Дельта» варіантом. Варіант «Омікрон» з’явився в грудні 2021 р. і до сьогодні циркулює в Україні. Відбувається постійна і швидка зміна його підваріантів. У першому кварталі 2023 р. найбільш поширеним був підваріант «Омікрону» ХВВ.1.5, який складав 26% від усіх досліджених вірусів. Підваріант «Омікрону» XBB.1.9.1 був домінуючим у другому кварталі 2023 р. в Україні. У третьому кварталі 2023 р. захворюваність на COVID-19 була на низькому рівні. Продовжували циркулювати у рівних пропорціях підваріанти «Омікрону» XBB.1.9.1 та ХВВ.1.5. Реєструвались також поодинокі випадки ХВВ.1, ХВВ.1.16 та ВА.5.
Слід зазначити, що багато відомих варіантів вірусу SARS-CoV-2, які спричинили підйоми захворюваності в інших країнах і на інших континентах, в Україні реалізовані не були.
Висновок. Спостереження за динамікою молекулярно-генетичних змін у вірусах SARS-CoV-2, що циркулювали в Україні з початку пандемії COVID-19, засвідчили зміну чотирьох варіантів цього збудника та продовження циркуляції варіанту «Омікрон» із швидкою зміною його підваріантів.
А. П. Подаваленко, Т. Д. Нессонова, Н. В. Білера
РИЗИК ПОШИРЕННЯ СКАРЛАТИНИ В УКРАЇНІ В УМОВАХ ВОЄННИХ ДІЙ
Харківський національний медичний університет, м. Харків, Україна
Е-mail: epid@ukr.net
Скарлатина належить до стрептококових інфекцій з провідним аерозольно-аспіраційним механізмом передачі збудника. Гемолітичний стрептокок групи А (Streptococcus pyogenes) є збудником скарлатини, ангіни, фарингітів, отитів, імпетіго, ектими, рожі тощо (первинні форми), а також ревматизму, гломеру-лонефриту, васкулітів тощо (вторинні форми). Спільний збудник зазначених нозологічних форм та їх механізми передачі (аерозольно-аспіраційний та контактний) свідчать про взаємозв’язок між ними. На скарлатину хворіють переважно діти, її поширенню сприяють соціальні фактори, а підйом захворюваності відбувається в осінньо-зимово-весняний період року.
Стрептококові інфекції поширені повсюдно і є найбільш гострою проблемою охорони здоров’я в усіх країнах світу. У 2022–2023 роках в країнах Європи, США, Китаї спостерігали підйоми захворюваності на скарлатину з летальними випадками. Хворіли на скарлатину переважно діти до 10 років, зокрема з тяжким перебігом хвороби.
Війна в Україні призвела до інтенсифікації міграційних процесів. Наразі активізувалася маятникова міграція та міжнародні міграційні процеси, що підвищує ризик поширення скарлатини в нашій країні. Наприклад, у 2023 році були зареєстровані спалахи скарлатини в Івано-Франківській області та Ужгороді.
Зважаючи на вищезазначене, метою роботи стала оцінка ризику поширення скарлатини в Україні в умовах воєнних дій на підставі ретроспективного аналізу захворюваності.
Матеріали та методи. У роботі використано матеріали офіційної статистики Міністерства охорони здоров’я України (форма №2 «Звіти про окремі інфекції та паразитарні захворювання (річні)» та Державної статистики України. На підставі цих даних проведено ретроспективний аналіз захворюваності на скарлатину за 1986–2021 роки і прогнозування на найближчий період. Аналіз вихідних даних з метою виявлення аномальних значень проводили за методом Ірвіна. Для прогнозування показника «захворюваність на скарлатину» використали модель авторегресії та проінтегрованого ковзного середнього ARIMA (1,0,0) у програмі “Statistica 12.0”. За допомогою інструментарію програми “Statistica 12.0” “Spearman Rank Order Correlations” проводили пошук параметрів взаємозв’язку між частотою реєстрації випадків скарлатини і міграційними процесами. У випадку, якщо коефіцієнт кореляції становив — 0, вважали, що зв’язок між явищами — відсутній; від 0,1 до 0,29 зв’язок оцінювали, як слабкий; від 0,30 до 0,69 — помірний; від 0,70 до 0,99 — сильний; 1 — повний.
Результати дослідження. Аналіз багаторічної динаміки захворюваності на скарлатину за 1986–2019 роки до пандемії COVID-19 показав коливання в межах від 136,7 на 100 тис. населення (1986 р.) до 15,6 (2016 р.), водночас значення медіани за останні 10 років було 25,7 на 100 тис. населення. Захворюваність серед дітей від 0 до 17 років у 2019 році була у сотні разів вищою, ніж серед дорослих (відповідно 188,8 на 100 тис. дитячого населення та 0,4 на 100 тис. дорослих). Найвищі показники спостерігали у вікових групах 1–4 роки (278,7 на 100 тис. дітей 1–4 роки) та 5–9 років (335,2 на 100 тис. дітей 5–9 років), тоді як захворюваність у вікових групах 10–14 років та 15–17 років була значно нижчою і становила відповідно 61,4 та 17,1 на 100 тис. певних вікових груп.
Наразі через пандемію COVID-19 (2020–2023 роки) та війну в Україні, яка розпочалася з 2022 року, не можна за рівнем захворюваності адекватно оцінити епідемічну ситуацію із скарлатини. Зокрема, у 2021 році захворюваність на скарлатину становила 3,9 на 100 тис. населення, що у 5,6 раза нижче за середній показник захворюваності за останні 10 років (22,0), що може свідчити про благополучну епідемічну ситуацію. Але водночас існують умови поширення інфекцій з аерозольно-аспіраційним механізмом передачі збудника інфекції, зокрема активізація внутрішніх та міждержавних міграцій. Встановлений прямий сильний кореляційний зв’язок (r=0,7) між міграційним приростом та захворюваністю на скарлатину (р<0,05) підтверджує висунуту гіпотезу щодо можливого впливу соціальних факторів.
Розрахований прогноз захворюваності на скарлатину на наступні два роки свідчить про незначну тенденцією до зниження (з 32,76 до 32,37 на 100 тис. населення) при визначеному довірчому інтервалі [Δ=0,20; 64,53], який також свідчить про ризик ускладнення епідемічної ситуації із скарлатини при дії несприятливих факторів.
Отже, спалахи скарлатини в західних областях України та міграція за кордон 5–8 млн населення, переважно жінок та дітей, дозволяють оцінити епідемічну ситуацію із скарлатини як нестійку.
Висновки
- Скарлатина залишається неконтрольованою засобами специфічної профілактики дитячою інфекцією з провідним аерозольно-аспіраційним механізмом передачі збудника інфекції.
- Наразі в Україні існує високий ризик розвитку епідемічного процесу скарлатини та її поширення через активізацію міжнародних міграційних процесів, ускладнення епідемічної ситуації в країнах західної Європи та спалахи в Україні. Тож необхідно посилити епідеміологічний нагляд за скарлатиною та іншими стрептококови- ми інфекціями групи А, розробити та впровадити інструктивно-методичні документи з цих питань.
- Рекомендовано організувати вебінари, заняття в медичних навчальних закладах щодо профілактики (виявлення та ізоляція хворих, вентиляція приміщення, гігієна рук та органів дихання), діагностики (клінічні, епідеміологічні та лабораторні критерії), лікування та проведення протиепідемічних заходів в осередку скарлатини.
О. А. Ракша-Слюсарева1, О. А. Слюсарев1, Т. Л. Богданова1, В. П. Власенко2, Н. В. Шейченко2, А. С. Неретя1, І. А. Тарасова3
ПРЕДИКТОРИ ПРОГНОЗУВАННЯ ВИХОДУ З ІНФЕКЦІЇ, ПОВ’ЯЗАНОЇ З SARS-COV-2
1. Донецький національний медичний університет, м. Лиман, Україна
2. Комунальне некомерційне підприємство «Інфекційна лікарня м. Костянтинівки», м. Костянтинівка, Україна
3. ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
Е-mail: rakshslusareva@gmail.com
Епідемія COVID-19 стала викликом для системи охорони здоров’я всіх країн світу й України, зокрема. Клінічна симптоматика є досить ненадійним прогностичним показником імовірного завершення будь-якої інфекції, включаючи й інфекцію, пов’язану з SARS-CoV-2. У зв’язку з цим актуальним є пошук об’єктивованих предикторів прогнозування перебігу та завершення нової коронавірусної інфекції (одужання, хронізації, трагічного завершення). Як об’єктивовані предиктори виходу хвороби вже запропоновані такі показники, як білки гострої фази, рівень прокальцитоніну, інтерлейкінів, D-димеру та багато інших (Боброва О. В. та співавт., 2020; Мельник А. А., 2020; Ai T. et al, 2020; Henderson L. A. et al., 2020; Zhang J. et al.). Але отримані результати цілком не задовольняють запити лікарської практики й вимагають продовження досліджень щодо більш точних предикторів, які дозволяють проводити моніторинг та оцінку стану хворих за ступенем важкості перебігу захворювання. Клінічним проявам будь-якої хвороби передують порушення психонейроімунної регуляції, а такий її компартамент, як система імунітету, насамперед та більш тонко віддзеркалює зміни в організмі й одночасно є доступними та швидкими для дослідження за допомогою імунологічних методів. В зв’язку з цим є сенс дослідити як предиктори прогнозування тяжкості перебігу COVID-19 такі елементи лейкограми: вміст тромбоцитів, паличкоядерних та сегментоядерних нейтрофілів, еозинофілів, базофілів, моноцитів, лімфоцитів, природних кілерів та їх співвідношення з маркерами циркуляції в організмі вірусу SARS-CoV-2 (білків вірусу, антигену (Аг), антитіл (АТ) — IgM або IgG).
Мета дослідження полягала у пошуку надійних, доступних, маловитратних, швидких та відносно ранніх критеріїв визначення перспективи завершення хвороби при тяжкому перебігу інфекції, що зумовлена вірусом SARS-CoV-2.
Матеріали та методи. У 118 хворих на COVID-19 з тяжким перебігом, які знаходились на лікуванні у Комунальному некомерційному підприємстві «Інфекційна лікарня м. Костянтинівки», м. Костянтинівки, і виписувались зі стаціонару в задовільному стані, досліджували показники стану системи імунітету та маркери вірусу SARS-CoV-2. У хворих в динаміці хвороби аналізували частоту відхилень від норми та середній вміст показників неспецифічної резистентності (тромбоцитів, паличкоядерних та сегментоядерних нейтрофілів, еозинофілів, базофілів, моноцитів) та системи імунітету (лімфоцитів). Наявність та елімінацію вірусу SARS-CoV-2 з організму хворих визначали за допомогою ІФА (антигени) та ПЛР (генетичний матеріал вірусу) та IgM і IgG (Сito test IgM+IgG COVID). Матеріали дослідження були статистично оброблені з використанням параметричного та непараметричного аналізу. Накопичення та систематизація результатів клінічного дослідження щодо кожного з елементів лейкограми та наявності в організмі хворих антигену вірусу SARS-CoV-2 або генетичного матеріалу вірусу виконувалась з використанням електронних таблиць “Microsoft Office Excel”. Як кількісну міру оцінювання взаємозв’язку між наявністю збудника інфекції та вмісту елементів лейкограми хворих було використано відношення шансів (OR), що визначалося, як відношення ймовірності відхилення від норми кількості досліджуваних елементів лейкограми в групі пацієнтів з ознаками наявності збудника в організмі до ймовірності відхилення від норми елементів лейкограми у пацієнтів з відсутністю збудника в організмі або наявністю антитіл до нього. Взаємозв’язок між наявністю збудника та відхиленням від норми вмісту елементів лейкограми вважався доведеним у випадку знаходження довірчого інтервалу за межами відсутності ефекту, що був прийнятий за 1 (95% CI).
Результати та обговорення. Проведений статистичний аналіз показав, що шанс виявити антиген вірусу SARS-CoV-2 при зниженні вмісту лімфоцитів в крові пацієнтів, хворих на COVID-19 дорівнює 3,6. Значення отриманого показника дає змогу стверджувати, що присутність в крові антигену SARS-CoV-2 й вміст лімфоцитів, менший за норму, пов’язані між собою. В цілому шанс виявити антиген вірусу SARS-CoV-2 при відхиленні лімфоцитів від норми дорівнює 2,7, що також підтверджує взаємозв’язок між цими показниками. Водночас шанс виявити антиген вірусу SARS-CoV-19 при підвищенні вмісту лімфоцитів до показників норми дорівнює 0,37, що є статистично не значимим Таким способом можна стверджувати, що існує зв’язок між циркуляцією антигену вірусу SARS-CoV-2 та зниженням лімфоцитів в крові пацієнтів, що хворіють та перехворіли на COVID-19.
Висновки
- Виявлено тісний обернений зв’язок між вмістом лімфоцитів осіб, хворих на інфекцію, пов’язану з вірусом SARS-CoV-2, й наявністю збудника в організмі (Ag та РНК вірусу).
- Встановлено, що при зниженні вмісту лімфоцитів в організмі хворих реєструється присутність вірусу, а при підвищенні їх вмісту присутність вірусу не виявляється, але частково реєструються АТ до цього вірусу.
- Вміст лімфоцитів можна розглядати, як основний предиктор прогнозування перебігу та завершення тяжкої форми інфекції, пов’язаної з SARS-CoV-2.
- Відновлення вмісту лімфоцитів до норми (1,6 Г в 1 л й вище) в межах 8–17 доби (до 2,5 тижня) захворювання може розцінюватись, як показник завершення перебігу тяжкої форми COVID-19 одужанням з перспективою формування імунітету.
- Реєстрація імунної недостатності після 17 доби (2,5 тижня хвороби) ймовірно свідчить про затяжний перебіг захворювання, можливе формування носійства вірусу й вимагає одночасно з продовженням терапії та її інтенсифікації більш глибокого обстеження щодо стану імунної системи організму.
О. А. Ракша-Слюсарева1, О. А. Слюсарев1, Т. Л. Богданова1, В. П. Власенко2, Р. П. Кліманський1, П. Г. Коваленко1,
Н. В. Шейченко2, І. А. Тарасова3, І. Л. Маричев3, А. О. Неретя1
СТАН НЕСПЕЦИФІЧНОЇ РЕЗИСТЕНТНОСТІ В ІНФІКОВАНИХ SARS-COV-2 ХВОРИХ ДОНЕЦЬКОГО РЕГІОНУ З ПОЗИТИВНИМ ПЕРЕБІГОМ ЗАХВОРЮВАННЯ, ЩО ЗАВЕРШИЛОСЯ ОДУЖАННЯМ
1. Донецький національний медичний університет, м. Лиман, Україна
2. Комунальне некомерційне підприємство «Інфекційна лікарня м. Костянтинівки», м. Костянтинівка, Україна
3. ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
Е-mail: rakshslusareva@gmail.com
Населення Донецького регіону підпадає під вплив сукупності багатьох негативних природних та техногенних факторів довкілля, що зумовило зміни в гемато-імунологічному, неврологічному та психоемоційному станах. У зв’язку з вторгненням рф з 2014 р. в регіоні відбувались послідовно АТО, ООС, а з лютого 2022 р. — повномасштабні військові дії. Все це безперечно впливає на психонейроімунну регуляцію організму кожного мешканця та створює негативне тло для розвитку будь-яких патологічних процесів, ускладнюючи їх перебіг. Важливу роль у протидії хворобі COVID-19 відіграє неспецифічна резистентність. Механізми неспецифічної резистентності поєднують фізіологічні реакції (гарячку, запалення), механічні біобар’єри, бактерицидні сполуки сироватки, слизових оболонок, систему фагоцитарних мононуклеарів тощо.
Метою роботи було дослідження змін показників неспецифічної резистентності у хворих на COVID-19, які мешкають у Донецькому регіоні, мали легкий та середній ступінь тяжкості перебігу хвороби та одужали.
Матеріали та методи. В динаміці хвороби досліджувались показники стану неспецифічної резистентності в 327 осіб у віці 18–60 років, хворих на COVID-19 легкого та середнього ступеня тяжкості, які одужали. Дослідження проводились у хворих, що знаходились на стаціонарному лікуванні у Комунальному некомерційному підприємстві «Інфекційна лікарня м. Костянтинівки», та стаціонарі «вдома». Дослідження клітинної ланки показників неспецифічної резистентності проводили імунологічними методами І рівня, визначаючи вміст лейкоцитів та абсолютний вміст елементів, що формують клітинну ланку неспецифічної резистентності: паличкоядерних та сегментоядерних нейтрофілів, еозинофілів та моноцитів. Маркери вірусу SARS-CoV-2 визначались методами ІФА та ПЛР. Отримані результати оброблялися методами варіаційної статистики і рангової кореляції з використанням PCL. Були використані програми “Statistica Windows” і пакет відповідних програм вимірювань.
Результати та обговорення. У хворих на COVID-19 з легкою та середньою важкістю перебігу хвороби й одужанням виявлені різноспрямовані зміни неспецифічної резистентності, що ймовірно пов’язано з її різним вихідним станом та конституційними спадковими особливостями хворих. Моноцити виявлялись у всіх хворих протягом перебігу захворювання. Їх вміст в першу добу хвороби відповідав показникам норми. На другу добу було зареєстровано підвищення вмісту моноцитів у (5,9±0,69)% хворих. До кінця першого тижня хвороби (7 доба) частота виявлення осіб з підвищеним вмістом моноцитів поступово збільшилась від (5,6±0,6)% до (29,4±2,68)%. На восьму добу хвороби підвищений вміст моноцитів не було виявлено у жодного хворого. До 13 доби захворювання у (8,5±0,34)% хворих інколи, без будь-яких закономірностей, виявлялись моноцити в підвищеній кількості. На 12 добу з початку захворювання відсоток осіб з підвищеним вмістом моноцитів складав (21,4±2,9)%. На 13 добу відсоток осіб з підвищеним вмістом досяг максимуму — (54,5±2,1)%. Проте на 14 добу знову знижувалася до (25±3,6)%. На 15 добу хвороби особи з підвищеним вмістом моноцитів не виявлялись. В подальшому до 3 тижнів підвищений вміст моноцитів інколи, без будь яких закономірностей, реєструвався у (4,6±1,5)% осіб. Вміст еозинофільних гранулоцитів, які реєструвались у частини хворих, підвищувався протягом хвороби у (9,69±0,1)%. Закономірності у підвищенні вмісту еозинофілів щодо динаміки хвороби не були виявлені. Базофіли виявлялись інколи й не перевищували за вмістом показники норми. Зв’язок між частотою виявлення та коливанням вмісту еозинофілів та базофілів й циркуляцією в крові маркерів вірусу SARS-CoV-2 не був виявлений. Вміст сегментоядерних нейтрофілів у перші дні хвороби знижувався нижче норми у (21,7±1,6)% й підвищувався у (17,4±1,7)%. В середньому вміст нейтрофілів в першу добу хвороби становив (2,97±0,5) Г в 1 л й був біля нижньої межі норми. Поступово вміст нейтрофілів підвищувався, і досягав свого піку — (4,39±0,86) Г в 1 л на 8 добу захворювання, незначно виходячи за верхню межу норми і, залишаючись без зміни протягом 3–4 діб. У більшості хворих на 12–13 добу реєстрували зниження вмісту нейтрофілів до верхньої межі норми. Після 13 доби хвороби вміст нейтрофілів продовжував знижуватись з тенденцією до нормалізації, але не досягав показників середньої норми — (2,88±1,02) Г в1 л залишаючись на рівні 3,6–3,05 Г в 1 л навіть після одужання. Зв’язок між коливанням вмісту нейтрофілів й циркуляцією в крові маркерів вірусу SARS-CoV-2 не був виявлений. У 18% хворих вміст нейтрофілів не мав тенденції до нормалізації після 12–13 доби, а періодично підвищувався, виходячи за верхні межі норми. Найбільші зміни спостерігались в популяції паличкоядерних нейтрофілів, вміст яких був значно збільшеним з першого дня хвороби у (78,3±1,8)% обстежених протягом всього часу хвороби. Особливо високі показники вмісту паличкоядерних нейтрофілів, що перевищували показники середньої регіональної норми — (0,12±0,01) Г в 1 л, реєструвалися на 1 та 2 тижні захворювання, відповідно: (0,54±0,09) Г в 1 л та (0,65±0,09) Г в 1 л. Зниження вмісту паличкоядерних нейтрофілів співпадало зі зменшенням частоти виявлення антигенів, появою антитіл до вірусу та збільшенням вмісту лімфоцитів. При затяжній формі інфекції показники неспецифічної резистентності коливались, виходячи за межі норми в той чи інший бік, й не нормалізувались протягом 3 тижнів.
Висновок. Отримані результати можуть бути використані як додаткові критерії при розробці способів прогнозування завершення інфекції, пов’язаної з SARS-СоV-19.
Т. А. Сергеєва1, Н. С. Бугаєнко2,1
ЕПІДЕМІЧНА СИТУАЦІЯ З HBV-ІНФЕКЦІЇ В УКРАЇНІ НА ТЛІ ЕПІДЕМІЇ COVID-19 ТА ПІД ЧАС ВОЄННОГО СТАНУ
1. ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
2. ДУ «Центр громадського здоров’я МОЗ України», м. Київ, Україна
Е-mail: tas1960@ukr.net
HBV-інфекція, або гепатит В (ГВ), залишається однією з найактуальніших інфекційних хвороб попри багаторічне вивчення і розроблення питань клініко-епідеміологічних особливостей цієї інфекції та впровадження широких профілактичних заходів, зокрема специфічної вакцинопрофілактики. Щоб подолати глобальний вплив ГВ на здоров’я населення у 2016 р. ВООЗ ухвалила першу Глобальну стратегію сектору охорони здоров’я, спрямовану на ліквідацію HBV-інфекції до 2030 р., що передбачало зниження нових випадків на 90% і смертей на 65% порівняно з базовим 2015 роком. Але безпрецедентний вплив COVID-19 на всі ланки охорони здоров’я викликав занепокоєння щодо можливості досягнення мети ліквідації HBV-інфекції через те, що були зірвані кампанії вакцинації; відбулось порушення динаміки передачі HBV (як і інших збудників, що передаються з інфікованою кров’ю); суттєво скоротилось скринінгово-діагностичне забезпечення; зменшився доступ до лікування хронічних гепатитів та догляду у закладах охорони здоров’я тощо. Був розроблений новий програмний документ, що пропонує ключові стратегічні та оперативні зрушення, необхідні для елімінації HBV і HCV як загроз громадському здоров’ю до 2030 року. Але в Україні, на тлі незавершеної на той час епідемії COVID-19, з’явились додаткові, м’яко кажучи, несприятливі умови через повномасштабне вторгнення рф з усіма відомими факторами щодо полегшення передачі й поширення багатьох збудників, зокрема вірусів парентеральних гепатитів.
Мета роботи: порівняння епідеміологічних особливостей HBV-інфекції в Україні за 5 допандемічних років (2015–2019 рр.), під час епідемії COVID-19 та воєнного стану (2020 — 8 місяців 2023 рр.).
Матеріали і методи. Динаміку параметрів і тенденцій розвитку епідемічного процесу ГВ і серопревалентності HBV-інфекції аналізували за матеріалами форм звітності МОЗ України: Ф. 1, 2 («Звіт про окремі інфекційні та паразитарні захворювання») та Ф. 40-здоров. («Звіт про роботу санітарно-епідеміологічної станції») із застосуванням комплексу описово-оціночних та аналітичних прийомів епідеміологічного методу дослідження у поєднанні з методами математичної статистики.
Результати. В динаміці 2015–2019 рр. показники захворюваності на гострий ГВ (ГГВ) всього населення коливались в межах від 3,57 до 4,09 на 100 тис., в середньому — 3,29 (95% ДІ: 3,10–3,48), характеризувались стабільною епідемічною тенденцією (Тсер. = -0,6% на рік). Показники захворюваності на хронічний ГВ (ХГВ) за ті ж роки у середньому дорівнювали 3,73 (3,47–3,99) на 100 тис. населення, і відмічався помірний спад (-1,9% на рік) захворюваності, що реєструється. Починаючи з 2020 р., захворюваність на ГГВ зменшилась у 1,8 раза, порівняно із 2019 р., а на ХГВ — у 2,1 раза; у 2021 і 2022 рр. показники захворюваності на ГГВ були стабільними, а на ХГВ, після зниження у 2021 р., зросли, перевищивши показник 2020 р. (2,2 ↔ 1,5 на 100 тис. населення). Констатуємо практично відсутню або дуже незначну різницю в абсолютних та інтенсивних показниках захворюваності на ГГВ та ХГВ у 2015–2021 рр.: співвідношення випадків ХГВ:ГГВ було від 1,1:1 до 1,3:1. Є всі підстави стверджувати про серйозний недооблік хронічних форм HBV-інфекції, що спостерігався в минулі роки. Загалом у 2015–2021 рр. захворюваність на ГГВ населення України, згідно з офіційною статистикою МОЗ, була вищою, ніж в країнах ЄС/ ЄЕЗ, а на ХГВ, навпаки, нижчою, і останнє викликає певні сумніви.
У 2022 р. можна відмітити значний приріст захворюваності на ГГВ порівняно з 2021 р. у Західних (+69,2%) та Південних (+32,2%) регіонах України; щодо ХГВ, то приріст фіксувався для всіх територій, окрім Східного регіону — від +125,1% сумарно в Західних областях до +13,5% у Північних. Отже, попри воєнний стан, значні міграційні потоки, неможливість отримання повної статистичної інформації з усіх регіонів України, відносно низькі показники захворюваності на ГВ, що відмічались під час обмежувальних заходів через COVID-19, поступово починають зростати, що підтверджується й цифрами 2023 року. Зокрема, за січень–вересень 2023 р. середньомісячні показники захворюваності на ГГВ перевищили аналогічні за 2021 р. у 1,5 раза, а за 2022 р. – в 1,6 раза, складаючи 0,74 на 100 тис. населення; на ХГВ – в 2,1 та 1,8 раза відповідно, в середньому – 1,33 на 100 тис. населення. Протягом усіх означених періодів часу спостерігались виражені середньомісячні темпи зростання захворюваності на обидві форми HВV-інфекції, найвищі — за 9 місяців 2022 р.
У віковій структурі хворих на ГГВ і ХГВ у середньому за 2015 — 8 місяців 2023 рр. превалювали дорослі: 97,3% проти 2,7% та 98,1,9% ↔ 1,9% відповідно, і захворюваність дорослого населення також була вищою як в допандемічні, так і в наступні роки в середньому у 2,5 раза як для ГГВ, так і ХГВ. У статевій структурі стабільно переважали особи жіночої біологічної статі: співвідношення чоловіків і жінок серед хворих на ГГВ складало 1:1,5, на ХГВ — 1:1,3.
Протягом всього аналізованого періоду в структурі шляхів передачі HBV (для тієї меншості випадків, коли вони були встановлені) переважали незахищені сексуальні стосунки (в середньому 57,4% при ГГВ та 48,3% при ХГВ) та інфікування через вживання ін’єкційних наркотиків (27,4% та 35,8% відповідно). Виражених змін у структурі шляхів передачі HBV у динаміці не встановлено.
Відмітимо суттєве зменшення обсягів обстеження населення на маркери інфікування HBV як з діагностичною метою, так і з ціллю епіднагляду. Зокрема, з 2015 р. по 2022 р. кількість обстежених на наявність HBsAg осіб зменшилась з 1 728 827 до 982 210 на рік (у 1,8 раза). Спостерігався також спад у частоті виявлення цього маркеру — з 1,6% у 2015 р. до 0,9% у 2022 р. Але більшість обстежених осіб складають донори крові та вагітні, яких зазвичай розглядають як представників умовно здорових груп населення, і серед яких показники виявлення маркерів мінімальні. Якщо в 2015 р. частка донорів і вагітних складала 52,5% від всіх обстежених на HBsAg, то у 2022 р. їх пропорція зросла до 58,1%.
Слід зазначити, що багато осіб з HBsAg не проходять підтверджувальної діагностики, не потрапляють до офіційної статистики, можуть залишатися поза медичним спостереженням. За простими розрахунками, співвідношення кількості виявлених HBsAg-позитивних осіб до числа зареєстрованих випадків ГВ в Україні в середньому за 2015–2019 рр. становило 7:1, за 2020–2021 рр. зросло до 9:1, у 2022 р. повернулось до показника допандемічного періоду — 7:1.
Вакцинація проти ГВ є ключовою стратегією елімінації HBV-інфекції. Під час пандемії COVID-19 у глобальному масштабі спостерігалось суттєве зменшення обсягів щеплень проти ГВ. На цьому тлі охоплення вакцинами проти ГВ в Україні у 2020–2021 рр. було навпаки, вищим, ніж за 5 років до COVID-19: 79,3% від плану в середньому за 2 роки, тоді як у 2015–2016 рр. цей показник не сягав 30%, а в 2017–2019 в середньому дорівнював 73,8%. Однак, рівень охоплення вакцинацією проти ГВ в Україні нижчий, ніж у більшості країн ЄС/ЄЕЗ, і нижче рекомендованого для цілі ліквідації. У 2022 р. виконання обсягів щеплень проти ГВ в Україні зменшилось до 62,4%, що кореспондується з відомою тезою щодо часової кореляції між падінням рівня охоплення вакцинацією та національними кризами.
На завершення необхідно підкреслити, що епідемічна ситуація з парентеральних вірусних гепатитів загалом і HBV-інфекції зокрема обтяжується цілою низкою чинників, пов’язаних із війною: обмеження доступу до медичних послуг (зокрема до лікування, призначеного раніше); підвищений ризик травмування та контакту з кров’ю інших осіб; нестача медичного персоналу; не завжди належні умови стерилізації медичного обладнання; ускладнення отримання медичної допомоги у польових умовах тощо.
Висновки.
- Епідемічна ситуація з ГВ в Україні залишається недооціненою в кількісному вимірі; втрачені під час COVID-19 та в наступні роки можливості скринінгу на маркери інфікування HBV — один із факторів цієї недооцінки.
- Відбулось зниження кількості зареєстрованих випадків HBV-інфекції під час пандемії COVID-19 при помірному підвищенні показників захворюваності у 2022 р. — 8 місяців 2023 р. порівняно з 2020–2021 роками. Зростання захворюваності на ГВ у 2022 р. було інтенсивнішим в регіонах України, в яких реєструється найбільша кількість внутрішньо переміщених осіб.
- Не встановлено змін у структурі шляхів передачі HBV та в статево-віковій структурі хворих на ГВ у динаміці 2015 — 8 місяців 2023 рр.
- Багато осіб з HBsAg не проходять підтверджувальної діагностики, не потрапляють до офіційної статистики, можуть залишатися поза медичним спостереженням тривалий час, депонуючи HBV серед населення.
- Вірусний гепатит В відносять до групи інфекційних захворювань, актуальних під час воєнного стану. Епідемічна ситуація з парентеральних вірусних гепатитів в Україні під час війни залишається напруженою, не виключена тенденція до її погіршення. Недостатні обсяги та ефективність профілактичних заходів можуть у найближчому десятилітті проявитися зростанням числа осіб із хронічними ураженнями печінки НВ-вірусної етіології.
Т. В. Чабан, Н. В. Верба, В. М. Бочаров, Л. В. Ткач
ПОКАЗНИКИ СИСТЕМИ ЦИТОКІНІВ У ХВОРИХ НА ХРОНІЧНИЙ ГЕПАТИТ С ТА ЇХ КОРЕКЦІЯ
Одеський національний медичний університет, м. Одеса, Україна
Е-mail: nataliia.verba@onmedu.edu.ua
Застосування прямого противірусного лікування хронічного гепатиту С (ХГС) стало справжнім проривом у його терапії. Однак, не всі хворі мають можливість її отримати, особливо в умовах воєнного стану. Дуже часто хворі на ХГС звертаються до лікаря зі скаргами, не пов’язаними із безпосереднім ураженням печінки вірусом гепатиту С (HCV). В патогенезі прогресування фіброзних змін у печінці велика роль відводиться різноманітним цитокінам. Зокрема, IL-6 виявляє подвійну дію: стимулює синтез TNF, а при надмірній продукції TNF пригнічує цей синтез. Тож функціонування цитокінової мережі у хворих на ХГС має бути врахованим при пошуку підходів лікування.
Мета дослідження: вивчити показники цитокінової мережі у хворих на ХГС (IFN-cив, IFN-α, IFN-β, IFN-γ, IL-6 та TNF) та можливість їх корекції.
Матеріали та методи. Під нашим спостереженням знаходились 106 хворих на ХГС, з яких було 55 (51,89%) жінок і 51 (48,11%) чоловік. Діагноз ХГС підтверджували виявленням у сироватці крові хворих специфічних антитіл методом імуноферментного аналізу (ІФА) та РНК HCV (RNA HCV) за допомогою полімеразної ланцюгової реакції (ПЛР). Всі хворі на ХГС були поділені на 2 групи. До І групи ввійшли 54 хворих, яким призначали лікування софосбувіром по 0,4 г один раз на добу протягом 12 тижнів. ІІ групу складали 52 хворих на ХГС, у яких використовували софосбувір по 0,4 г один раз на добу протягом 12 тижнів та метадоксин у дозі 0,5 г двічі на добу протягом 12 тижнів, впродовж наступних 12 тижнів по 0,5 г один раз на добу.
Результати та їх обговорення. Рівень IFN-сив при зверненні хворих до гепатоцентру був нижчим за показники у здорових осіб на 41,21% в І групі та на 40,38% в ІІ групі (р<0,001). Низький рівень IFN-сив на початку лікування діагностовано у 38 (69,09%) хворих І та 36 (70,58%) хворих ІІ групи. Під час обстеження в динаміці спостерігалась нормалізація рівня IFN-сив у хворих І групи, тоді як у хворих ІІ групи рівень цього цитокіну залишався нижчим, ніж у здорових осіб на 35,56%.
Слід зазначити, що у хворих на ХГС при первинному обстеженні спостерігалось зниження рівня IFN-α, IFN-β i IFN-γ. Зокрема, рівень IFN-α був нижчим за фізіологічні показники на 36,59% в І групі та на 35,48% в ІІ групі (р<0,001). Рівень IFN-β i IFN-γ також був нижчим, ніж у здорових осіб, відповідно на 37,99% і на 35,51% у хворих І групи та на 37,99% і на 30,67% у хворих ІІ групи (р<0,001). В динаміці кількість хворих, у яких діагностовано зниження рівня IFN-α, IFN-β i IFN-γ, зменшувалась в ІІ групі та залишалась на тому ж рівні в І групі. Зокрема, при обстеженні через 1 місяць знижений рівень IFN-α діагностовано у 24 (43,63%) хворих І та у 12 (23,53%) хворих ІІ групи. При обстеженні через 3 місяці зниження рівня IFN-α встановлено у 17 (30,91%) хворих І та у 4 (7,84%) хворих ІІ групи. Через 12 місяців спостерігалась нормалізація цього показника у 49 (96,07%) хворих ІІ групи та у 5 (9,09%) хворих І групи він залишався зниженим. Рівень IFN-β при зверненні був нижчим за фізіологічні показники у 21 (38,18%) хворого І групи та у 20 (39,21%) хворих ІІ групи. Через місяць нормалізація цього показника відбувалась у 9 (16,36%) хворих І групи та у 18 (35,29%) хворих ІІ групи. Через 3 місяці у всіх хворих І рівень цього цитокіну підвищився до норми, тоді як в І групі — лише у 2 (3,63%) хворих. Такі ж зміни спостерігались і на 12 місяці від початку лікування. Рівень цитокінів IL-6 і TNF мав тенденцію до зниження у хворих обох груп, проте більшою мірою нормалізація відбувалась у хворих ІІ групи, які отримували комплексне лікування. Зокрема, при зверненні IL-6 перевищував фізіологічні показники у 2,9 раза в І групі та у 2,6 раза в ІІ групі. На 1 місяці лікування рівень даного цитокіну перевищував рівень у здорових осіб у 1,8 раза в І групі і у 1,2 раза — в ІІ групі. На 3 місяці відбувалась нормалізація рівня IL-6 у хворих ІІ групи, а в І групі він був вищим, ніж у здорових осіб, у 1,5 раза, без позитивної динаміки і на 12 місяці лікування. TNF також був більшим, ніж у здорових осіб, у 6,2 раза у хворих І групи та у 6,0 раза у хворих ІІ групи при зверненні. Через місяць рівень цього цитокіну перевищував рівень у здорових осіб у 4,3 раза в І і 3,1 раза — в ІІ. Через 3 місяці рівень TNF досягав норми у хворих ІІ групи, при цьому у хворих І групи залишався високим та був більшим, ніж у здорових осіб, у 2,0 раза.
Висновок. Отже, при призначенні хворим на ХГС лікування із застосуванням метадоксину у сироватці крові відбувалась нормалізація синтезу цитокінів. Зокрема, рівень сироваткового інтерферону, який має противірусну та антифібротичну дію підвищувався, а вміст IL-6 і TNF, які стимулюють процеси фіброзоутворення в печінці, знижались до норми.
Т. В. Чабан, К. М. Усиченко, А. І. Черкашина, Ю. І. Бердник
Одеський національний медичний університет, м. Одеса, Україна
Е-mail: kateryna.usychenko@onmedu.edu.ua
В останні роки проведено низку досліджень з вивчення генетичних факторів, що визначають характер взаємодії збудника та макроорганізму, впливають на процеси хронізації та швидкість фіброгенезу. Враховуючи, що цитокіни є найважливішими учасниками імунопатогенезу вірусних гепатитів, дослідження функціональної значущості поліморфізму в промоторній зоні є актуальним питанням.
Мета дослідження — встановити частоту зустрічальності поліморфізмів генів IL-4 (rs2243250), IL-10 (rs1800896), TNFα (G308A) у хворих на хронічний гепатит В (ХГВ) та хронічний гепатит С (ХГС), які проживають в Одеському регіоні.
Матеріали та методи. Обстежено 82 хворих на ХГВ та 100 хворих на ХГС у віці від 18 до 62 років. Для підтвердження діагнозу ХГВ та ХГС були використані біохімічні показники та серологічні маркери. Молекулярно-генетичні дослідження включали визначення поліморфних варіантів генів IL-4 (rs2243250), IL-10 (rs1800896), TNF (rs1800620) із застосовуванням полімеразної ланцюгової реакції. Ідентифікацію проводили на базі лабораторного комплексу «Німецький діагностичний центр Св. Павла» (Одеса, Україна).
Результати. При вивченні поліморфної ділянки IL-4 (rs2243250) виявлено переважання гомозиготного варіанту СС IL-4 (rs2243250) як у групі хворих на ХГВ (60,98%), так і в групі хворих на ХГС (66,0%) (χ2=0,58). Практично рівною мірою виявлено гетерозиготний варіант генотипу ТС IL-4 (rs2243250): 39,02% у хворих на ХГВ і 30,0% у хворих на ХГС (χ2=1,1).
При вивченні поліморфної ділянки IL-10 (rs1800896) виявлено деяке переважання гомозиготного варіанту GG IL-10 (rs1800896) у групі хворих на ХГВ (31,7%) у порівнянні з групою хворих на ХГС (19,0%) (χ2=2,7). Практично рівною мірою виявлено гетерозиготний варіант генотипу GA IL-10 (rs1800896): 60,0% у хворих на ХГВ і 53,0% у хворих на ХГС (χ2=0,7).
При вивченні поліморфної ділянки TNF (rs1800620) виявлені виражені відмінності. У хворих на ХГВ переважав гомозиготний варіант GG TNF (rs1800620) — 85,37%, а у хворих на ХГС цей генотип виявлений лише у 19,0% пацієнтів (χ2=54,2). Гетерозиготний варіант GA TNF (rs1800620) переважав у пацієнтів із ХГС (77,0%), у пацієнтів із ХГВ він спостерігався лише у 14,36% (χ2=47,6).
Відсутність достовірної різниці частоти генотипів IL-4 (rs2243250) та IL-10 (rs1800896) може бути підтвердженням важливості саме цієї складової генетичного профілю. Істотні відмінності в поліморфізмі генів TNFα (rs1800620) у хворих на ХГС і ХГВ вказують на можливість індивідуалізації генетичного профілю.
Висновок. Отримані результати можуть використовуватись з метою індивідуального підходу до лікування хворих.
В. Р. Шагінян1, І. В. Фільчаков1, О. В. Максименок1, О. М. Кислих1, Т. А. Сергеєва1, Ю. В. Круглов1, А. М. Чугрієв2
1. ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
2. КНП «Житомирський обласний Центр крові», ВГО «Асоціація служби крові України»
Е-mail: vrs1808@gmail.com
Пандемія COVID-19 завершилась, залишивши багато питань, які потребують свого вирішення. Значна кількість з них пов’язана з розвитком імунної відповіді внаслідок перенесеного захворювання або вакцинації. Несподіваною виявилась невідповідність між високим рівнем захисних антитіл у осіб після нещодавнього захворювання (<6 місяців) та поширенням серед них інфекції. В іншому дослідженні не було виявлено різниці в частоті інфікування SARS-CoV-2 між серопозитивними та серонегативними особами. Визначення специфічних антитіл, які вважали протективними, виявилось малоінформативним для розуміння розвитку як інфекційного, так і епідемічного процесу COVID-19. Це підтверджує теза, що рутинне тестування на індуковану вакциною гуморальну імунну відповідь на SARS-CoV-2 не рекомендується використовувати як параметр «захисного імунітету» після вакцинації проти COVID-19. Отже питання діагностичної цінності виявлення специфічних антитіл для епідеміологічного нагляду та оцінки індивідуального захисту від захворювання на COVID-19 дотепер остаточно не з’ясовані.
Мета роботи: оцінити інформативність тестування на наявність специфічних антитіл до SARS-CoV-2 на різних етапах розвитку епідемічного процесу COVID-19.
Матеріали і методи. Проведено обстеження на наявність антитіл до SARS-CoV-2 (далі — Ат) 114 співробітників Інституту. Обстеження проведені протягом травня 2020 р. — травня 2021 р. та у січні–березні 2023 р. Також у січні–березні 2023 р. обстежено 481 людину, яка живе з ВІЛ (ЛЖВ). Показник кількості CD4 (медіана) у ЛЖВ склав 567,5 (кл/мкл), отримували антиретровірусну терапію 95,2% пацієнтів. Проаналізовані результати обстеження 1 503 донорів крові (ДК) Житомирського обласного центру крові, які були проведені у червні–жовтні 2021 року. Обстеженню всіх осіб зазначених категорій передувало анкетування, яке для ДК та ЛЖВ було анонімним. Співробітники Інституту, обстежені у 2020–2021 р., та ДК не були щеплені проти COVID-19. Для визначення Ат використовували імуноферментні тест-системи для визначення IgG до нуклеокапсидного антигену SARS-CoV-2 “DIA-SARS-CoV-2-NP-IgG”, виробництва АТЗТ НВК «Діапроф-Мед» (Україна). При обстеженні ДК застосовували діагностичні набори для виявлення IgG до нуклеокапсидного та спайк-антигенів збудника “EQUI SARS-CoV-2 IgG swift”, виробництва ТОВ «Еквітестлаб» (Україна).
Результати. Згідно з даними анкетування співробітників Інституту на початку епідемії (травень 2020 р. — травень 2021 р.) перехворіли на COVID-19 45 із 76 (59,2%) осіб, при обстеженні Ат були виявлені у 41 із 76 — (54,0±5,7)%. Серед тих, хто перехворів на COVID-19, Ат виявлені практично в однаковому відсотку в тих, у кого діагноз був підтверджений лабораторно (68,8%) та в кого не було лабораторного підтвердження діагнозу (69,0%). Отже, у 30% перехворілих був негативний результат тестування на Ат, водночас у 10 працівників (13,2%), які не вважали себе перехворілими на COVID-19, були виявлені Ат.
За результатами обстеження ДК, які були проведені пізніше (червень–жовтень 2021 р.) частота виявлення Ат була достовірно вищою: (68,4±1,2)%, р<0,05. Згідно з даними анкетування ДК, захворювання на COVID-19 відмічали лише 15,8% респондентів.
При обстеженні медичного персоналу Інституту, який працював безпосередньо із хворими на COVID-19 (обстеження проведено у січні–березні 2023 р.), Ат були виявлені у всіх обстежених, але слід зазначити, що 65,8% працівників були щеплені проти COVID-19. Згідно з даними анкетування, перехворіли на COVID-19 92,1% цих співробітників.
Було проведено обстеження та анкетування ЛЖВ, яких вважають групою ризику щодо захворювання та тяжких наслідків COVID-19. На відміну від медичних працівників, вважали себе перехворілими на COVID-19 54,5% ЛЖВ, антитіла були виявлені у 85,9% обстежених. Охоплення щепленнями ЛЖВ склало 59,9%. При майже однаковому охопленні щепленнями медичні працівники, за даними анкетування, хворіли на COVID-19 частіше, ніж ЛЖВ, також у всіх медиків спостерігалась гуморальна імунна відповідь на антигени SARS-CoV-2. Отже, медичні працівники, які працюють з хворими на COVID-19, дійсно є групою ризику, не дивлячись на використання засобів індивідуального захисту. Крім того, постійні контакти з хворими підтримують активність імунної відповіді. Тому оцінювати поширеність інфекції та захищеність від COVID-19 на підставі тестування на наявність Ат у період проведення вакцинації не можливо. Крім того, наявність Ат не є критерієм захищеності від інфекції. Зокрема, за результатами обстеження ЛЖВ не захворіли на COVID-19 (60,7±3,4)% нещеплених ЛЖВ проти (45,4±3,0)% щеплених, (р<0,05). Також нами відмічені повторні випадки захворювання на COVID-19 після щеплення. Частота повторних випадків серед щеплених медиків склала 8,0%, серед не щеплених — 7,7%, серед ЛЖВ — 6,4% та 3,5%, відповідно.
Висновки. До початку проведення вакцинації проти COVID-19 виявлення антитіл до SARS-CoV-2 давало можливість простежувати динаміку поширення інфекції. На тлі подальшого розповсюдження вірусу та широкого впровадження вакцинації тестування на Ат втратило свою значимість для епідеміологічного нагляду. Виявлення антитіл до SARS-CoV-2 не є підставою вважати дану особу захищеною від захворювання, про що свідчать повторні випадки захворювань як у перехворілих, так і у щеплених. Наявність Ат у населення не свідчить про формування колективного імунітету, а виявлення Ат на тлі масової вакцинопрофілактики не дозволяє оцінювати серопревалентність інфекції COVID-19 у теперішній час. Отже, обстеження на наявність та рівень Ат перехворілих або щеплених втрачає свою актуальність.
Г. А. Шишова, С. Л. Скрипнік, Т. А. Біломеря, О. О. Берегова
МОНІТОРИНГ ЕПІДЕМІЧНОЇ СИТУАЦІЇ ЩОДО КОРУ ТА СТАНУ РЕАЛІЗАЦІЇ НАЗДОГАНЯЮЧОЇ «CATCH-UP» КАМПАНІЇ З ВАКЦИНАЦІЇ ПРОТИ КОРУ ЕПІДЕМІЧНОГО ПАРОТИТУ ТА КРАСНУХИ В ДОНЕЦЬКІЙ ОБЛАСТІ В СУЧАСНИХ УМОВАХ
ДУ «Донецький обласний центр контролю та профілактики хвороб МОЗ України», м. Краматорськ, Україна
Е-mail: epidslavses@ukr.net
На початку 2000-х років ВООЗ поставила за мету елімінацію кору в країнах Європи. Проте у 2017–2019 роках у багатьох країнах, зокрема в Україні, через низку причин, провідною з яких було недостатнє охоплення вакцинацією, було відзначено зростання захворюваності на кір до епідемічного рівня. За цих обставин особливістю спалахів кору стало переважання захворілих серед дорослих.
Мета: проаналізувати рівень захворюваності кором та стан реалізації «наздоганяючої» catch-up кампанії з вакцинації проти кору, епідемічного паротиту та краснухи серед дитячого населення Донецької області.
Матеріали та методи: використані дані форми №2 «Звіт про окремі інфекційні та паразитарні захворювання» за 2014 — 7 місяців 2023 рр., форми 70 «Звіт про профілактичні щеплення» 2021–2022 рр., електронно-статистичної звітності «УкрВак-08» за 2021 — 7 місяців 2023 рр. Аналіз проводили за допомогою програм “Excel” та “Statistica v.6.1”.
Результати. У Донецькій області епідемічний підйом захворюваності на кір почався в 2017 р., коли було зареєстровано 154 випадки захворювання, показник становив 7,9 на 100 тисяч населення, тоді як у попередньому році захворюваність на кір не реєструвалася. Стрімке зростання захворюваності продовжилося в 2018 р., показник становив 23,8 на 100 тис. нас., що в 3 рази перевищило рівень 2017 року. Пік захворюваності в регіоні, як і в країні, відмічався в 2019 р.: показник склав 49,3 на 100 тис. населення, що в 2,1 раза більше, ніж у попередньому році. Слід зазначити, що захворюваність на кір в області (навіть в рік її пікового значення — 2019 р.) була значно нижчою (на 63,7%) від державного рівня.
Протягом 2-х наступних років в регіоні зареєстровано по 1 випадку кору серед дорослих, показник склав за кожен рік 0,06 на 100 тис. населення. Випадки кору в 2022 р. та за минулі місяці 2023 р. в Донецькій області не зареєстровані.
В Україні в 2023 р. зареєстровано 30 випадків кору, що більше на 25 випадків, ніж минулого року.
Упродовж останніх років відзначається значне зниження рівнів охоплення плановою вакцинацією проти кору, епідемічного паротиту та краснухи серед дитячого населення держави. За результатами проведеного прогнозу, встановлено факт можливої реєстрації спалаху кору в країні в 2023–2024 роках.
У Донецькій області в 2022 р. виконання обсягу щеплень проти кору та краснухи дітей у віці 1 рік становило 70,5%, що нижче рівня 2021 р. на 22,9% та державного рівня охоплення цими щепленнями на 3,6%. Обсяг ревакцинації вакциною КПК у віці 6 років виконаний на 63,9%, що нижче рівня 2021 р. на 22% та державного рівня на 5,2%.
За 7 місяців 2023 р. показник своєчасності охоплення щепленнями проти кору, краснухи та епідпаротиту дітей у віці 1 рік становить 50,8%, що нижче цільового показника на 7,5% та на 4,0% нижче рівня охоплення минулого року.
Обсяг ревакцинації КПК (у віці 6 років) виконаний на 46,1%, що нижче рівня цільового показника на 12,2% та нижче минулого року на 6,8%.
За результатами аналізу охоплення щепленнями проти кору дитячого населення Донецької області визначені найбільш уразливі щодо виникнення можливого спалаху кору 4 адміністративно-територіальні одиниці.
За результатами аналізу стану реалізації «наздоганяючої» catch-up кампанії з вакцинації проти кору, епідемічного паротиту та краснухи серед дитячого населення встановлено, що вакцина на тижні 11.09–16.09.2023 р. є в наявності в 61 пункті щеплень. За даними моніторингу фахівців ДУ «ДОНЕЦЬКИЙ ОЦКПХ МОЗ», з початку кампанії станом на 15.09.2023 р проведено 1 140 щеплень, зокрема за тиждень щеплено 56 осіб, динаміка з попереднім тижнем від’ємна та складає -0,3%. Виконання плану щеплень в області складає 51,5%. Кількість зроблених щеплень за тиждень знижується.
Найбільш активно проводяться щеплення серед дітей від 2 до 6 років, відсоток охоплення КПК 1 у даній віковій групі склав 58,5%. Найменше охоплені щепленнями діти вікової категорії 7–17 років, яким планувалось зробити І дозу вакцини КПК. Виконання плану щеплень цих дітей складає тільки 22,8%.
За тиждень 11.09–16.09.2023 р. запрошено на щеплення в межах catсh-up кампанії з вакцинації проти кору, епідемічного паротиту та краснухи 192 особи, не з’явилися на щеплення 136 осіб, що складає 70,8% та більше на 1,5% порівняно з попереднім тижнем.
Серед тих, хто не з’явився на щеплення перебувають за межами області 66,9%, що більше на 0,8% в порівнянні з попереднім тижнем. Відмовилися від щеплення внаслідок недовіри до вакцинації 11% осіб, що більше на 1,1% в порівнянні з попереднім тижнем; через релігійні переконання — 1,4% осіб, що більше на 0,7% в порівнянні з попереднім тижнем; мають медичні протипоказання 2,9% осіб, що більше на 0,1% в порівнянні з попереднім тижнем; з інших причин — 16,1% осіб, що більше на 4,3% в порівнянні з попереднім тижнем.
Основними проблемами у сфері імунопрофілактики та захисту мешканців Донецької області від інфекційних хвороб, яким можна запобігти шляхом проведення імунопрофілактики, є такі:
- велика міграція населення області внаслідок активних бойових дій;
- скорочення мережі первинної ланки;
- недостатність сімейних лікарів;
- втрата вірусологічної лабораторії Маріупольської філії ДУ «Донецький ОЦКПХ МОЗ», що негативно впливає на здійснення епідеміологічного нагляду за кором та іншими хворобами вірусної етіології.
Висновок. Донецька область має високий ризик виникнення спалаху кору серед дітей, як за рахунок місцевих випадків хвороби, так і за рахунок «завізних» випадків.
М. В. Shulyk, D. A. Sobchenko, А. S. Anchev, H. M. Ursol
STREPTOCOCCUS PYOGENES AS A BACTERIAL INFECTION IN THE SURGEON’S PRACTICE
Donetsk National Medical University, Kropyvnytskyi, Ukraine
Е-mail: cddasobchenko@dnmu.edu.ua
Ecthyma is an infectious skin condition that affects the skin and can involve deeper structures, including lymphatic pathways. It is characterized by a well-demarcated, raised erythematous area and often affects the lower extremities. The face is the second most commonly affected area. Infectious disease caused by the bacterium Streptococcus pyogenes.
This pathological condition is associated with a high incidence of complications and recurrences, leading to significant healthcare costs. The treatment process is not complex from a surgical perspective; however, due to the high recurrence rate, the widespread nature of the process, and its pathogenetic classification, it remains unaddressed.
To analyze the clinical work conducted at the Medical University and compile the data obtained from the treatment at the district level in patients suffering from ecthyma, with the aim of improving treatment effectiveness and achieving better clinical outcomes.
Materials and Methods: A total of 72 ecthyma patients were under observation. The age of patients ranged from 29 to 79 years, with a predominance of elderly patients.
More than half of them had comorbidities:
Diabetes mellitus — 13 (26%), peripheral arterial occlusive disease — 17 (34%), varicose veins — 10 (20%), obesity — 10 (20%).
In numerous cases, the presence of traumatic factors such as blows, blunt traumas, and superficial wounds in the patients’ medical history was observed. Primary ecthyma inflammation was detected in 55 patients, while recurrent inflammation was diagnosed in 12 patients. In 5 patients, a genetic predisposition to this infectious disease was identified. During medical examination, it was determined that the forms of the disease were distributed as follows: erythematous form was observed in 52 patients (57,4%), erythematous-bullous in 13 patients (18,5%). Bullous and necrotic forms were found in an equal number of 7 patients (11,1%).
Results. The clinical course of the disease was characterized by an acute and pronounced onset, high fever from the first hours of the disease, and the development of symptoms of intoxication (general weakness, headache, and muscle pain). Symptoms of ecthyma may include fever, chills, headache, erythema (red skin), lymphadenopathy (enlargement of lymph nodes), and lymphangitis (inflammation of lymphatic vessels).
The characteristics of the disease include the following main features. The initial manifestations of the disease include a feeling of tingling and paresthesia in the affected area. Within the first hours after the onset of the disease, areas of hyperemia appear on the skin of the shins, which have a bluish-red color. Hemorrhages may develop on these areas over time.
The localization of ecthyma has distinctive features; typically, it is located on the posterior medial surface of the shin. In many cases, this condition can spread to the shin-foot joint. It is important to note that this problem is often observed in patients with obesity and concomitant chronic venous insufficiency of the lower extremities.
A detailed clinical assessment was conducted in patients to determine the level of fever and the overall toxic effect on the body. For this purpose, various general laboratory tests were performed, including the determination of indicators of the complete blood count and urine analysis, as well as the measurement of levels of total protein and its fractions, bilirubin, the activity of enzymes ALT (alanine aminotransferase) and AST (aspartate aminotransferase), coagulogram parameters, concentration of creatinine, urea, and blood glucose.
The treatment strategy was initiated immediately after the patients’ hospitalization and included a range of measures. In particular, parenteral detoxification-infusion therapy was applied, aimed at removing toxins and other harmful substances from the body, along with forced diuresis (increased urine output). In addition, anticoagulation therapy was administered, and antioxidant and antibacterial therapy was provided. Patients were prescribed antiplatelet agents to prevent thrombus formation and immunomodulatory drugs to enhance the body’s defense mechanisms.
Surgical interventions were applied in cases of complicated forms of the disease, such as bullous and necrotic forms, as well as in cases where purulent-inflammatory processes were observed, such as abscesses, phlegmons, and widespread tissue necrosis. Performing surgical intervention at the early stages of the disease contributed to reducing the manifestations of endogenous intoxication and lowering the risk of deep tissue necrosis.
Necrotomy was performed at early stages, typically within the first 1–2 days, while necrectomy was carried out after determining the depth of necrotic lesions, which usually occurred within 4–6 days. In cases where inflammation spread to the subcutaneous tissue, the operation was performed on the 2nd or 3rd day. During the operation, the maximally visible necrotic tissues were excised, and residual cavities and pockets were actively drained.
Local treatment included the use of sorbents, hydrophilic ointments, and proteolytic enzymes. In cases where pronounced edge epithelization and active granulation were observed, secondary sutures were applied, or autodermoplasty was used.
As a result of the treatment, a positive effect was observed in the majority of patients 62 (86.1%), while 10 (13.9%) experienced a recurrence of the disease, complicated by impaired lymphatic drainage.
Conclusions. The pathology described in the study is characterized by an acute onset and pronounced clinical manifestations, such as high fever, general weakness, and pain. The treatment was comprehensive and included infusion therapy for detoxification, antibacterial therapy, anticoagulant therapy, and immunomodulatory therapy. Surgical interventions were performed in cases of complicated forms of the disease and in the presence of purulentinflammatory processes. A generally positive treatment effect was observed in the majority of patients; however, recurrences were recorded in a smaller number of cases.
А. М. Щербінська, М. Г. Люльчук, В. Ф. Марієвський
ВНЕСОК ІНСТИТУТУ ІМ. Л. В. ГРОМАШЕВСЬКОГО В СПРАВУ БОРОТЬБИ З ЕПІДЕМІЄЮ ВІЛ/СНІДУ В УКРАЇНІ
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
Е-mail: scherbinska@ukraids.gov.ua
В 1981 році щотижневик “Weekly Report“ опублікував статтю про поширення нової хвороби, названої синдромом набутого імунодефіциту людини. Висока смертність і незрозумілий перебіг хвороби прикував до себе увагу медичної спільноти. В СРСР лише в 1987 р. Міністерство охорони здоров’я звернуло увагу на появу ВІЛ-інфекції, рішення цієї проблеми МОЗ УРСР поклав на Київський НДІ епідеміології та інфекційних хвороб ім. Л. В. Громашевського (далі — Інститут). Перші дослідження, спрямовані на виявлення ВІЛ-інфікованих людей в Україні, не викликали особливої тривоги, адже у 1987 році було діагностовано ВІЛ-інфекцію у невеликої кількості людей (81 особи), передусім у студентів з країн Африки, які навчались у ВУЗах України.
В 1991 році відбувся розпад Радянського Союзу і утворення самостійної держави Україна. Одним з перших законів у сфері охорони здоров’я в кінці того ж року був прийнятий Верховною Радою Закон України «Про протидію поширенню хвороб, зумовлених вірусом імунодефіциту людини (ВІЛ), та правовий і соціальний захист людей, які живуть з ВІЛ», де в Статті 2 зазначено про проведення фундаментальних і прикладних наукових досліджень, розвиток міжнародного співробітництва у цій сфері. Ці положення актуальні і сьогодні, вони постійно розвиваються і удосконалюються, боротьба з епідемією ВІЛ/СНІДу стала державною політикою в сфері охорони здоров’я відповідно до законодавчих нормативів та урядових рішень.
За розробку нової проблематики, пов’язаної з поширенням смертельної на той час хвороби ВІЛ-інфекції/ СНІДу, взялись наукові підрозділи Інституту. Також в структурі Інституту був створений Республіканський центр СНІДу, реформований в 1992 р. в Український центр профілактики і боротьби зі СНІДом, що взяв на себе організацію протиепідемічної, лікувальної та профілактичної роботи в областях країни, навчання працівників служби СНІДу сучасним технологіям в зазначених сферах діяльності.
Провідну роль у рішенні наукових проблем було покладено на лабораторію загальної вірусології, науковий пошук проводився в кількох напрямах, а саме: моніторинг за субтиповою структурою популяції ВІЛ, що циркулювала в Україні, організація та проведення системного нагляду за формуванням резистентності ВІЛ до антиретровірусних препаратів у хворих на ВІЛ-інфекцію.
Молекулярно-генетичні дослідження здійснювали у співпраці з різними установами світового рівня, такими як Американське військово-медичне наукове об’єднання NAMRU-3 (м. Каїр, Єгипет), Університет Монпельє (Франція), а в останні роки — з фахівцями Університетів міст Кембридж та Оксфорд (Велика Британія), Каліфорнійського університету (США). За результатами цих досліджень побудовано систему епіднагляду за субтиповою структурою циркулюючої в країні популяції ВІЛ-1, до Кабінету Міністрів подано стратегію моніторингу за формуванням резистентності ВІЛ до АРВ-препаратів в країні.
Інший напрям наукового пошуку взяла на себе лабораторія епідеміології вірусних гепатитів та ВІЛ-інфекції, фахівці якої займались вивченням закономірностей і тенденцій розвитку епідемічного процесу ВІЛ-інфекції в сучасних умовах, передусім особливостей перинатальної ВІЛ-інфекції, розробленням стратегії і тактики її діагностики, якості специфічних досліджень.
Результати наукових досліджень фахівців лабораторій стали основою для розробки низки нормативних та методичних документів, затверджених наказами МОЗ України, вони ввійшли до Державної стратегії у сфері протидії ВІЛ-інфекції/СНІДу, туберкульозу та вірусним гепатитам на період до 2030 року.
Цікавий напрям досліджень проводився науковцями лабораторії діагностики інфекційних хвороб, які провели аналіз паразитологічної палітри хворих на ВІЛ-інфекцію в умовах масштабної АРТ, а також перебігу COVID-19 у людей, які живуть з ВІЛ і отримують АРТ: тяжкість хвороби у ВІЛ-інфікованих пацієнтів, які були вакциновані проти COVID-19, не була більш тяжкою, ніж серед інших груп населення, не встановлено позитивного впливу вакцинації на захворюваність на COVID-19 ВІЛ-інфікованих осіб.
Фахівці лабораторії експериментальної хіміотерапії вірусних інфекцій доклали зусиль до створення низки ефективних композицій противірусних препаратів проти опортуністичних інфекцій з урахуванням їх механізму дії, пов’язаного з антигенною мімікрією пептидів ВІЛ-1 та вуглеводвмісних біополімерів мікроорганізмів у взаємодії ВІЛ-1 з клітинами.
З перших днів появи хворих на ВІЛ-інфекцію на території України Інститут взяв на себе лікування пацієнтів. Клінічне відділення вірусних гепатитів прийняло в 1988 р. перших хворих на СНІД. В подальшому клініцисти започаткували організацію і діяльність клініки СНІДу, широко відомої в країні та поза її межами як клініка «Лавра». Вона стала навчальною базою з лікування хворих на ВІЛ-інфекцію/СНІД для лікарів-інфекціоністів усієї країни. Клініка «Лавра» першою в країні впровадила антиретровірусну терапію, розпочала з 10 хворих, а згодом кількість пролікованих зросла і на кінець 2021 р. досягла 3 112 осіб. Лікарі клініки СНІДу стали досвідченими спеціалістами в галузі лікування найбільш важких станів у хворих на ВІЛ-інфекцію, за безпосередньої участі наших фахівців були розроблені національні протоколи антивірусної терапії дорослих, підлітків та дітей, хворих на ВІЛ-інфекцію.
Сьогодні Україна виконує задачі, поставлені ЮНЕЙДС/ВООЗ щодо подолання епідемії ВІЛ/СНІДу в світі до 2030 року. Науковці Інституту, які багато років тому розпочали боротьбу з ВІЛ/СНІДом в країні, докладають зусиль для досягнення поставлених цілей шляхом розширення і поглиблення наукового пошуку, спрямованого на розробку вирішальних стратегій протидії ВІЛ-інфекції/СНІДу, передусім під час війни та згодом — в післявоєнний час.
Yakovleva1, G. Kovalenko2,3, M. Redlinger3, Smyrnov4, O. Tymets4, A. Korobchuk4, L. Kotlik5, Kolodiazieva5, A. Podolina5, S. Cherniavska5, A. Strathdee6, S. R. Friedman7, I. Goodfellow2, O. Wertheim6, E. Bortz3, L. Meredith2, T. I. Vasylyeva6
HEPATITIS C VIRUS TRANSMISSION IN INTERNALLY DISPLACED PEOPLE WHO INJECT DRUGS IN ODESA, UKRAINE
1. Medical Sciences Division, University of Oxford, Oxford, UK
2. Division of Virology, Department of Pathology, University of Cambridge, Cambridge, UK
3. Department of Biological Sciences, University of Alaska Anchorage, AK, USA
4. Alliance for Public Health, Kyiv, Ukraine
5. Odessa Regional Virology Laboratory, Odessa, Ukraine
6. Division of Infectious Diseases and Global Public Health, University of California San Diego, La Jolla, CA, USA
7. Department of Population Health, NYU Grossman School of Medicine, NY, USA
Е-mail: tvasylyeva@health.ucsd.edu
Due to practical challenges associated with genetic sequencing in low-resource environments, the burden of hepatitis C virus (HCV) in forcibly displaced people is understudied. We examined the use of field-applicable HCV sequencing methods and phylogenetic analysis to determine HCV transmission dynamics in internally displaced people who inject drugs (IDPWID) due to war in eastern Ukraine.
Methods. In this cross-sectional study, we used modified respondent-driven sampling to recruit IDPWID who have settled in Odessa, Ukraine. We generated partial and near full length genome (NFLG) HCV sequences using Oxford Nanopore MinION in a simulated field environment. Maximum likelihood and Bayesian methods were used to establish phylodynamic relationships.
Findings. Between June and September 2020, we collected epidemiological data and whole blood samples from 164 IDPWID. Rapid testing identified an HIV, anti-HCV, and HIV/HCV co-infection prevalence of 39%, 67.7%, and 31.1%, respectively. We generated 57 partial or NFLG HCV sequences and identified eight transmission clusters, of which at least two originated within a year and a half post-settlement. Unstable housing post-settlement was associated with more reports of injection drug use in the past 30 days (p=0·048).
Interpretation. Local generation of viral sequencing data and phylogenetic analysis in rapidly changing lowresource environments, such as those faced by forcibly displaced people, can inform timely adaptation of infection prevention and treatment.
