Підходи до діагностики атипової пневмонії

УДК: 616.24-039-07
DOI: https://doi.org/10/61948/prevmed-2025-2-18
О. А. Ракша-Слюсарева1, В. І. Трихліб2, О. А. Слюсарев1, В. І. Задорожна3, І. А. Тарасова4, І. Л. Маричев3 , С. С. Боєва5, І. Г. Кононова3
1Донецький національний медичний університет, м. Лиман, Україна
2Українська військово-медична академія, м. Київ, Україна
3ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
4Комунальне некомерційне підприємство «Центр первинної медико-санітарної допомоги № 1 Святошинського району», м. Київ, Україна
5Литовський університет наук здоров’я, м. Каунас, Литва
Резюме. З метою розробки додаткового швидкого та доступного способу диференційної діагностики атипової пневмонії та гострих респіраторних захворювань у динаміці хвороби обстежено 149 осіб, серед яких: хворих на гострі респіраторні захворювання 84 особи та атипову пневмонію 65 осіб і 150 умовно здорових осіб у віці 19-45 років. У обстежених вивчали вміст лейкоцитів периферичної крові, відносний та абсолютний вміст елементів лейкограми за допомогою звичайних імунологічних методів І рівня. В пулі нейтрофілів досліджували: кількість клітинних розпадів, клітин із розривами цитоплазматичної мембрани і набуханням ядра, клітин із ворсинчастим, гіпо- і гіперсегментованим та фрагментованим хроматином, вміст клітин з токсогенною зернистістю цитоплазми та адгезованих нейтрофілів. У пулі лімфоцитів вивчали кількість розпадів Боткіна-Гумпрехта, вміст ворсинчастих, витягнутих, веретеноподібних лімфоцитів, незрілих та молодих форм Т- і В-лімфоцитів, NK-клітин та їх попередників, Ріддерівських і деградованих лімфоцитів. Приховану недостатність системи імунітету визначали за способом О. А. Ракша-Слюсаревої та співавт. (2016).
У результаті проведених досліджень встановлено, що в якості диференційно діагностичних критеріїв атипової пневмонії та гострих респіраторних захворювань можуть бути використані такі: співвідношення абсолютного вмісту паличкоядерних нейтрофілів до сегментоядерних; відносний вміст нейтрофілів із гіпосегментованим ядром у пулі сегментоядерних нейтрофілів; абсолютний вміст лімфоцитів, які за морфологією відповідають нормі. Діагноз атипової пневмонії у перші дні захворювання може бути підтверджений при зменшенні співвідношення абсолютного вмісту паличкоядерних нейтрофілів до сегментоядерних, як 1:4 й нижче, збільшенні відносного вмісту нейтрофілів з гіпосегментованим ядром до 20% й більше та зменшенні абсолютного вмісту морфологічно незмінених лімфоцитів нижче за 1,6 Г в 1 л.
Ключові слова: атипова пневмонія, гострі респіраторні захворювання, диференційна діагностика, нейтрофіли, лімфоцити, цитоморфологія, військовослужбовці.
APPROACHES TO THE DIAGNOSTICS OF ATYPICAL PNEUMONIA
A. Raksha-Slyusareva1, V. I. Trykhlib2, O. A. Slyusarev1, I. Zadorozhna3, I. A. Tarasova4, I. L. Marychev3, S. Boeva5, I. G. Kononova3
1Donetsk National Medical University, Lyman, Ukraine
2Ukrainian Military Medical Academy, Kyiv, Ukraine
3State University “L. V. Gromashevskyi Institute of Epidemiology and Infectious Diseases of National Academy of Medical Sciences of Ukraine”, Kyiv, Ukraine
4Community Non-profit Enterprise “Center of Primary Medical and Sanitary Care No. 1 of Svyatoshynskyi District”, Kyiv, Ukraine
5Lithuanian University of Health Sciences, Kaunas, Lithuania
Summary. In order to develop an additional rapid and accessible method for differential diagnosis of atypical pneumonia and acute respiratory diseases in the dynamics of the disease, 149 people were examined, including: 84 people with acute respiratory diseases and 65 people with atypical pneumonia, and 150 relatively healthy people aged 19–45 years. The subjects were examined for peripheral blood leukocyte content, relative and absolute content of leukogram elements using conventional level I immunological methods. In the neutrophil pool, the following were examined: the number of cell lysis, cells with cytoplasmic membrane ruptures and nuclear swelling, cells with villous, hypo- and hyper-segmented and fragmented chromatin, the content of cells with toxogenic cytoplasmic granularity, and adhered neutrophils. In the lymphocyte pool, the number of Botkin-Gumprecht disintegrations, the content of villous, elongated, spindle-shaped lymphocytes, immature and young forms of T and B lymphocytes, NK cells and their precursors, Ridder and degraded lymphocytes were studied. Latent insufficiency of the immune system was determined according to the method of O. A. Raksha-Sliusareva et al. (2016).
As a result of the conducted studies, it was found that the following can be used as differential diagnostic criteria for atypical pneumonia and acute respiratory diseases: the ratio of the absolute content of rod-nucleated neutrophils to segmented neutrophils; the relative content of neutrophils with hyposegmented nuclei in the pool of caminonucleated neutrophils; absolute content of lymphocytes, which are morphologically normal. The diagnosis of atypical pneumonia in the first days of the disease can be confirmed by a decrease in the ratio of the absolute content of rod-nucleated neutrophils to segmented neutrophils to 1:4 and below, an increase in the relative content of neutrophils with hyposegmented nuclei to 20% and more, and a decrease in the absolute content of morphologically unchanged lymphocytes below 1.6 G per 1l.
Keywords: atypical pneumonia, acute respiratory diseases, differential diagnosis, neutrophils, lymphocytes, cytomorphology, military personnel.
Актуальність. Атипові пневмонії відрізняються стертою клінікою, відсутністю характерних показників фізикальних даних й недостатньо діагностуються сучасними інструментальними методами дослідження, за винятком магнітно-резонансної томографії [1–5]. Ці пневмонії часто є позалікарняними й пов’язуються з різними інфекційними агентами, серед яких: Chlamydia pneumoniae, Mycoplasma pneumonia, Legionella pneumophila, різні віруси тощо [1, 4–7]. У зв’язку з цим диференціальна діагностика атипових пневмоній в перші дні захворювання, а отже і призначення адекватної терапії є досить складним завданням [1, 2–6, 8]. Діагностика атипової пневмонії особливо утруднена у військово-польових умовах при відсутності багатьох спеціальних методів дослідження [8–9]. Водночас своєчасна діагностика цього інфекційного захворювання є запорукою ефективності лікування, відсутності ускладнень та хронізації.
Цитоморфологічні методи разом із тестами І рівня імунологічних досліджень дають можливість одночасної оцінки стану та функцій багатьох систем організму (неспецифічної резистентності, імунної системи, системи детоксикації, антиоксидантної системи, системи контролю генетичного гомеостазу організму тощо). Починаючи з 60-х років минулого століття, методи оцінки гемато-імунологічного стану як комплексного показника стану організму були вдосконалені саме аналізом цитоморфології клітин крові Е. Д. Гольдберг і співавт. [9]. Цей напрям отримав подальший розвиток в роботах К. П. Зака та співавт. [10], Д. Ф. Глузмана та співав. [11], Е. М. Михайловської [12], В. В. Талько [13], О. А. Ракші-Слюсаревої [14– 15]. Останнім часом дослідження в цьому напрямі поновились, значно збільшились й використовуються для визначення предикторів прогнозування для різних нозологій: Г. Г. Касрашвілі та співавт. [16], П. Г. Коваленко та співавт. [17–18], та низки закордонних авторів. Це стосується і діагностики атипової пневмонії [19–22].
Наші попередні розробки, виконані за допомогою імунологічних методів І рівня та доповнені цитоморфологічними дослідженнями основних елементів лейкограми, виявили значні відмінності їх вмісту та морфології у хворих на гострі респіраторні захворювання (ГРЗ) та атипову пневмонію (АП), що асоціюються із особливостями змін неспецифічної резистентності та імунної системи при цих захворюваннях і можуть мати діагностичне значення [8, 9, 23, 24].
Метою роботи була розробка простого додат- кового способу диференціальної діагностики атипової пневмонії та гострих респіраторних захворювань за допомогою визначення вмісту, морфології окремих пулів нейтрофілів та лімфоцитів периферичної крові в перші дні захворювання.
Матеріали та методи. Проаналізовано лейкограми крові 149 осіб мобілізованих та військовослужбовців, з яких: хворих на гострі респіраторні захворювання 84 особи (ГР3) та атипову пневмонії 65 осіб (АП) і 150 умовно здорових осіб (УЗН) у віці 19–45 років. Вміст лейкоцитів периферичної крові, відносний та абсолютний вміст елементів лейкограми периферичної крові визначали за допомогою звичайних імунологічних методів І рівня [25]. Додатково досліджували зміни цитоморфології нейтрофілів та лімфоцитів. У пулі нейтрофілів досліджували: кількість клітинних розпадів, клітин із розривами цитоплазматичної мембрани і набуханням ядра (НЯН), клітин з ворсинчастим хроматином (ВЯХ), гіпо- (ГпСЯН) і гіперсегментованим (ГрСЯН), та фрагментованим (ФЯН) ядром, вміст клітин з токсогенною зернистістю цитоплазми (ТЗН) та адгезованих нейтрофілів (АдН) [26–28]. У пулі лімфоцитів вивчали кількість розпадів Боткіна-Гумпрехта (РБГ), вміст ворсинчастих лімфоцитів (ВОЛ), витягнутих (ВитЛ), веретеноподібних (ВЛ); вміст незрілих Т-лімфоцитів: аберантних (АбЛ), лімфоцитів у вигляді дзеркала з ручкою (ДРЛ), молодих форм лімфоцитів (МФЛ), вміст клітин, що асоціюються з В-лімфоцитами: плазмоцитів (ПЛ), широкоплазменних (ШПЛ) та фестончатих лімфоцитів (ФЛ); великих гранульованих лімфоцитів (ВГЛ), що асоціюються з NK та їх попередників з бобоподібним ядром (ЛБЯ); Ріддерівських лімфоцитів (РЛ) і з ядром у вигляді сухого листа (СЛ) [24, 28, 29]. Отримані дані порівнювали з показниками умовно здорового населення [20–21]. Визначали співвідношення різних пулів нейтрофілів та лімфоцитів при АП та ГРЗ. Приховану недостатність системи імунітету визначали за різницею звичайних (з незміненою морфологією) й цитоморфологічно відмінних лімфоцитів за способом О. А. Ракша- Слюсаревої та співавт. [30].
Дослідження препаратів мазків крові проводили за допомогою імерсійного мікроскопу-тринокуляру MICROmed XS-4130 на базі Донецького національного медичного університету МОЗ України. Отримані результати оброблялися методами варіаційної статистики і рангової кореляції з використанням PCL. Аналіз та статистична обробка даних проводилися в статистичній програмі Statistica 12.0 (3BA94C4ED07A)
Результати досліджень та їх обговорення. Проведені дослідження показали кількісні та якісні відмінності щодо вмісту та цитоморфології елементів лейкограми при захворюванні на АП та ГРЗ в перші дні хвороби. Вміст лейкоцитів периферичної крові у хворих на АП у середньому становив (9,00±0,15) г/л і був вірогідно вищим за показники хворих з ГРЗ — (6,60±0,98) г/л (P<0,05). Середній вміст лейкоцитів у хворих на АП був також вірогідно вищим за показники УЗН — (5,3±0,1) г/л (Р>0,05). Вірогідних відмінностей між середніми показниками вмісту лейкоцитів в УЗН і хворих на ГРЗ не виявлено (Р>0,05). Основне збільшення вмісту лейкоцитів відбувалося за рахунок гранулоцитів.
Встановлено, що показники вмісту елементів лейкограми, пов’язаних з неспецифічною резистент- ністю, мали особливості, як у хворих на АП, так і при ГРЗ. Зокрема, у (33,0±0,57)% хворих на АП реєструвався підвищений вміст еозинофілів, що було вірогідно вище, ніж у хворих на ГРЗ — (9,0±0,34)% (Р< 0,05). В УЗН підвищені показники вмісту еозинофілів не виявлялись. Середній вміст еозинофілів становив у групі хворих на АП та ГРЗ, відповідно, (0,19±0,09) г/л та (0,14±0,06) г/л при показниках УЗН — (0,08±0,01) г/л. У периферичній крові (21,5±0,63)% хворих на АП та (6,0±0,29)% хворих на ГРЗ реєструвались метамієлоцити, середній вміст яких становив, відповідно, (0,08±0,008) г/л та (0,016±0,06) г/л (Р<0,05). Середній вміст паличкоядерних нейтрофілів при АП становив (1,01±0,067) г/л й був вірогідно вищим за такий у хворих на ГРЗ — (0,65±0,14) г/л та в УЗН — (0,11±0,01) г/л (Р<0,05), переважаючи показники норми у 10 разів. Середній вміст сегментоядерних нейтрофілів збільшувався у хворих на АП до (4,47± 0,02) г/л, був вірогідно вищим за показники ГРЗ — (3,31±0,07) г/л та УЗН — (2,67±0,36) г/л (Р<0,05). При АП у перші дні захворювання у (83,07±0,58)% хворих співвідношення вмісту паличкоядерних нейтрофілів щодо загального вмісту нейтрофілів, як 1:22 змінювалось, до показників, як 1:4 й менше. У хворих на ГРЗ співвідношення вмісту паличкоядерних нейтрофілів також змінюва- лось, але у значно меншої частини хворих — (26,6±0,53)%. Найбільш значущі зміни співвідношення паличкоядерних нейтрофілів до загального вмісту нейтрофілів становили, як 1:7, що було вірогідно вищим за такі показники у хворих на АП.
Частота виявлення осіб з вмістом моноцитів вищим за показники норми становила у хворих на АП (83±0,57)%, авосіб,хворихнаГРЗ— 100%.Середнійвмістмоноцитіву хворих на АП становив (0,80±0,19) г/л, а у хворих на ГРЗ — (0,69±0,10) г/л і був значно й вірогідно вищим за показники УЗН — (0,15±0,01) г/л. Вірогідних відмін- ностей щодо вмісту моноцитів при АП та ГРЗ не було виявлено (P>0,05).
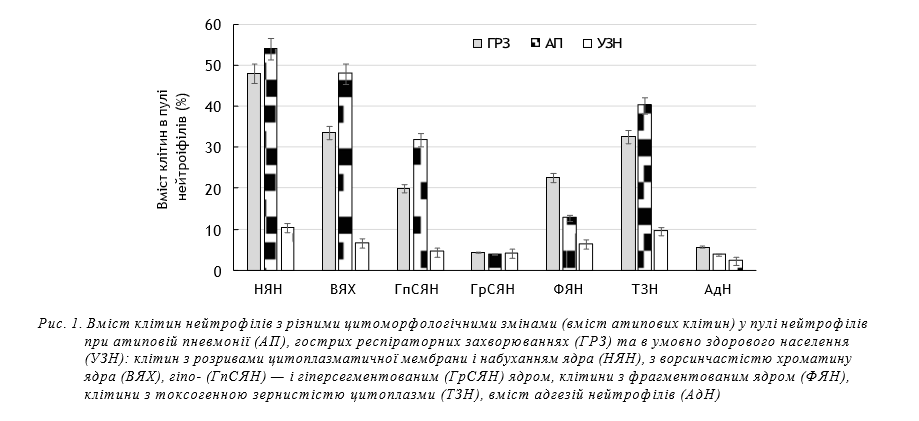
На рисунку 1 наведено дані щодо цитоморфо- логічних змін постійних клітин периферичної крові, що представляють неспецифічну резистентність — нейтрофілоцитів.
Як видно з даних, наведених на рисунку 1, цито- морфологічні зміни пулу нейтрофілів мали різну вираженість у хворих на АП та ГРЗ.
Вміст клітин з НЯН, наявність яких свідчить про порушення цілісності клітинної й ядерної мембрани внаслідок підвищення перекісних процесів, у пулі нейтрофілів у хворих на АП був трохи вищим, порівняно з хворими на ГРЗ, і становив, відповідно, (53,97±4,7)% та ГРЗ — (48±5,4)%. Показники НЯН при АП та ГРЗ були значно та вірогідно вищі ніж в УЗН — (10,3±1,34)%, переважаючи останні більш ніж у чотири–п’ять разів (P<0,05). Вміст клітин ВЯХ, наявність яких свідчить про зниження контролю генетичного гомеостазу організму з боку імунної системи щодо мутаційних процесів, у хворих на АП в середньому становив (46,9±7,1)% й був значно, але не вірогідно вищим за ці показники у хворих на ГРЗ — (33,26±1,62)% (P>0,05). В УЗН цей показник становив, (6,0±0,65)% й був значно та вірогідно меншим за такий у групах осіб з АП й ГРЗ (P<0,05). Середній вміст клітин з гіпосегментованим ядром, тобто молодих сегментоядерних нейтрофілів, у пулі нейтрофілів хворих на АП становив (35,9±6,8)%. Найменший вміст цих клітин складав ¼ пулу нейтрофілів, а максимально сягав більше 40% пулу. У хворих на ГРЗ вміст нейтрофілів з гіпосегментованим ядром у середньому складав — (19,88±3,87)%, а в УЗН — (4,45±0,05)%, що було значно та вірогідно нижче за показники АП (P<0,05). Вміст гіпосегметованих нейтрофілів у перші дні захворювання збільшувався при АП майже втричі, порівняно з ГРЗ й така ознака є предиктором диференційної діагностики між АП та ГРЗ. Вміст нейтрофілів з фрагментованим ядром, в середньому становив при АП, в середньому, (12,8±4,6)% й був значно нижчим за цей показник при ГРЗ — (22,6±5,6)%, але зареєстровані відмінності не були вірогідними (P>0,05). У контингенту УЗН вміст клітин з фрагментованим ядром у популяції нейтрофілів був значно та вірогідно нижчим (P<0,05). Частка клітин з гіперсегментованим ядром у пулі нейтрофілів у хворих на АП, ГРЗ та УЗН практично не відрізнялась й становила (3,9±1,65)%, (4,43±1,1)% та (4,1±0,8)% відповідно. Вміст клітин з токсогенною зернистістю, що віддзеркалює рівень токсико-запального процесу, в пулі нейтрофілів хворих на АП у середньому становив (40,48±8,53)% й був вищим, але не вірогідно за такий при ГРЗ — (32,64±4,7)%. В обох випадках частка клітин з ТЗ була значно й вірогідно вищою при АП й ГРЗ, порівняно з показниками УЗН — (9,5±0,91)% (P<0,05). Вміст адгезованих нейтрофілів, поява яких вважається ознакою запального процесу, у хворих на АП складав (3,81±1,36)% й був трохи нижчим за такий при ГРЗ — (4,8±0,73)% та перевищував показники УЗН — (2,3±0,3)%. Але відмінності між цими показниками в досліджуваних групах були невірогідними (P>0,05). Серед досліджуваних цитоморфологічних змін не всі були постійними в пулі нейтрофілів хворих на АП та ГРЗ. Але такі, як: НЯН, ВЯХ, ГсЯН та ТЗН були виявлені у 100% хворих на АП та ГРЗ. За даними статистичної обробки, цінність у якості предиктора АП при диференційній діагностиці з ГРЗ має збільшення в пулі нейтрофілів хворих на АП клітин з ГпСЯН, вміст яких у окремих хворих складав більше 1/3 пулу, і, мінімально зазвичай більше 20% — (23±5,8)%.
За абсолютними показниками вмісту лімфоцитів, лейкограма периферичної крові хворих на АП та ГРЗ не мала відмінностей. Середні показники вмісту лімфоцитів у хворих на АП становили (2,10±0,72) г/л, були трохи вищими за показники при ГРЗ — (1,82±0,02) г/л і не мали відмінностей від показників УЗН — (2,20±0,08) г/л.
Але NLR індекс (співвідношення нейтрофілів до лімфоцитів значно змінювався у хворих на АП та ГРЗ, зростаючи з показника 1,28 в УЗН до 2,5 при ГРЗ і 3,5 у хворих на АП. Тобто збільшення NLR індексу більше 2,5 є додатковим показником АП.
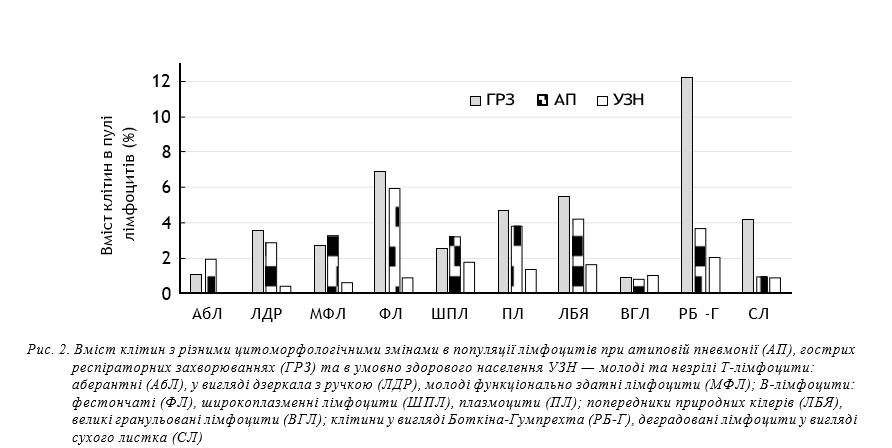
На рисунку 2 наведено дані щодо цито- морфологічних змін клітин у пулі лімфоцитів.
Як видно з даних, наведених на рисунку 2, частота виявлення й вираженість цитоморфологічних змін у пулі лімфоцитів, у хворих на АП були меншими, порівняно з ГРЗ, що особливо стосується клітин у процесі руйнації та деградації.
Вміст пулу незрілих Т-лімфоцитів у вигляді аберантних форм (АбЛ) не реєструвався в УЗН. Вміст АбЛ в популяції лімфоцитів хворих на АП становив (1,90±1,52)% і не мав вірогідних відмінностей порівняно з хворими на ГРЗ — (1,01±0,46)% (P<0,05), але в обох групах був вірогідно вищим за норму (0,02±0,001)%. Вміст незрілих монофункціональних Т-лімфоцитів у пулі клітин у вигляді дзеркала з ручкою (ДРЛ), у хворих на АП був вірогідно (14,2±4,9)% вищим за показники УЗН — (0,4±0,19)%, але значно нижчим за показники хворих на ГРЗ — (30±1,5)% (Р<0,05). Вміст МФЛ у хворих на АП, ГРЗ та УЗО становив, відповідно, (3,3±1,4)%, (2,7±1,34)% та (1,6±0,2)%. Ці показники не мали вірогідних відмінностей (P>0,05). Середній вміст у пулі лімфоцитів, клітин, пов’язаних з В-ланкою імунної системи, таких як широкоплазменні лімфоцити (ШПЛ) у хворих на АП та ГРЗ становив, відповідно, (3,23±1,3)% та (2,56±0,58)%, (Р>0,05) при показниках УЗН — (1,7±0,5)% і відсутності вірогідних відмінностей не мав вірогідних відмінностей (Р>0,05). Середній вміст фестончатих лімфоцитів у пулі цих клітин при АП та ГРЗ становив, відповідно, (6,0±0,50)% та (6,98±0,97)% практично не відрізнявся і порівняно з УЗН був значно та вірогідно більшим — (0,84±0,22)%. Вміст плазмоцитів у пулі лімфоцитів у хворих на АП та ГРЗ в середньому становив, відповідно, (3,75±1,47)% та (4,65±0,89)% й не мав вірогідних відмінностей. В УЗН середній вміст плазмоцитів в пулі лімфоцитів — (1,8±0,5)% був значно та вірогідно нижчим (Р <0,05). Середній вміст лімфоцитів з бобоподібним ядром (БЯЛ), що є попередниками природних кілерів у пулі клітин був трохи меншим у хворих на АП — (4,22±2,07)%, порівняно з хворими на ГРЗ – (5,56±1,57)% (Р>0,05) й значно переважав цей показник в УЗН — (1,6±0,3)%. Вміст великих гранульованих лімфоцитів (ВГЛ), що асоціюються з природними кілерами в середньому становив при АП (0,8±0,7)%, а при ГРЗ (0,88±0,43)% й майже не відрізнявся від показників УЗН — 0,96±0,22% (Р>0,05).
Найбільші відмінності у хворих на АП та ГРЗ проявлялись у вмісті характерних для лімфоцитів клітин у стані розпаду — тіней Боткіна-Гумпрехта. Середній вміст цих клітинних розпадів лімфоцитів у хворих на АП становив (3,69±1,52)%, був майже втричі меншим за такий при ГРЗ — (12,27±4,57)% (P<0,05), і мало відрізнявся від показників УЗН — (2,0±0,45)%, у яких вони виявлялись зрідка. Вміст деградуючих клітин у вигляді сухого листка при ГРЗ (4,21±1,04)% і був значно та вірогідно вищим за показники хворих на АП (0,93±0,78)% при та УЗН (0,85±0,27)% (P<0,05). Проведені дослідження показали зміни вмісту окремих пулів лімфоцитів у їх загальній популяції при АП та ГРЗ.
Зокрема, при АП порівняно з ГРЗ виявлена тенденція до підвищення вмісту в популяції лімфоцитів пулу молодих клітин Т-лімфоцитів й вірогідне зниження вмісту клітин, асоційованих з В-лімфоцитами, та плазмоцитів при їх значному й вірогідному підвищенні, порівняно з показниками УЗН. Ці зміни імунної системи віддзеркалюють відмінності патогенезу АП та ГРЗ на рівні імунної системи, але не можуть бути використані, як предиктори АП.
Аналіз комплексу цитоморфологічних змін у пулі лімфоцитів хворих на АП та ГРЗ дав можливість визначити наявну та приховану недостатність імунної системи.
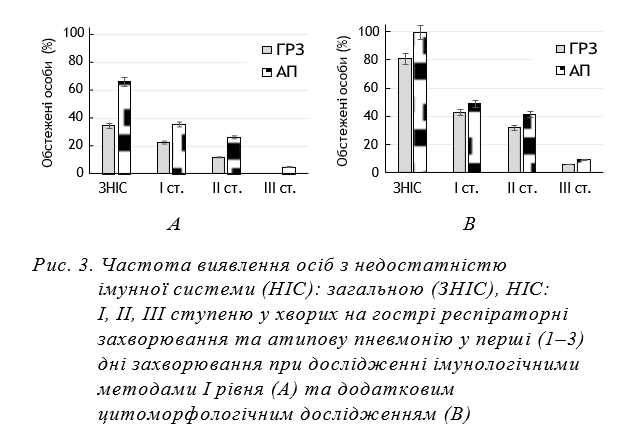
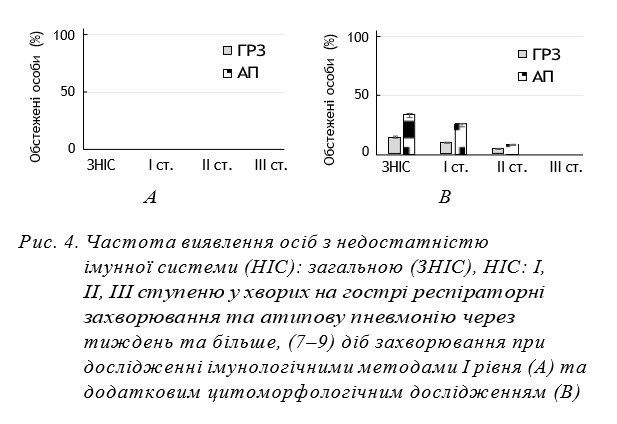
На рисунках 3 та 4 наведено дані щодо частоти виявлення осіб з показниками імунної системи, що відповідають нормі та такі, що свідчать про загальну недостатність імунної системи та недостатність імунної системи І–ІІІ ступеню при визначенні звичайними методами (А) та з додатковим застосуванням цитоморфологічних досліджень (В) на 1–3 добу та на 7–9 добу захворювання.
При визначенні звичайним методом за показником абсолютного вмісту лімфоцитів (вміст лімфоцитів менше 1,6 Г в 1 л) наявна недостатність імунної системи (НІС) в перші три доби захворювання у хворих на АП становила (66,15±0,72)% й була вірогідно вищою за таку у хворих на ГРЗ (34,50±0,57)% (Р<0,05). Недостатність імунної системи І, ІІ та ІІІ булазареєстрована, відповідно, у (35,4±0,73)%, (26,1±0,67)%, (4,6±0,32)% хворих на АП та у (22,6±0,64)%, (11,9±0,34)%, 0% хворих на ГРЗ. При визначенні прихованої недостатності імунної системи за допомогою цитоморфологічних досліджень, її було додатково виявлено ще у (33,85±0,72)% хворих на АП та (45,45±0,59)% хворих на ГРЗ. Недостатність імунної системи І, ІІ та ІІІ була зареєстрована при цитоморфологічному дослідженні, відповідно, у (13,80±0,53)%, (15,40±0,56)%, (4,60±0,32)% хворих на АП та у (20,30±0,47)%, (11,90±0,39)%, (5,90±0,28)% хворих на ГРЗ. Загалом (сумарна) недостатність імунної системи в перші три дні захворювання при АП становила 100,0, а при ГРЗ (80,95±0,47)%. Частота виявлення осіб з недостатністю імунної системи І, ІІ та ІІІ у хворих на АП становила (49,2±0,77)%, (41,5±0,76)%, (9,2,±0,44)%, а у хворих на ГРЗ — (42,9±0,59)%, (32,1±0,56)%, (5,9±0,28)%.
Визначення стану імунної системи у хворих на АП та ГРЗ на 7–9 день хвороби за допомогою звичайних методів показало, що у всіх обстежених вміст лімфоцитів у периферичній крові або відновився до 1,6 Г в 1 л, або був вищим, що віддзеркалювало відсутність імунної недостатності. Додаткове цитоморфологічне дослідження свідчило, що у (32,3±0,72)% хворих на АП і (14,3±0,41)% хворих на ГРЗ зберігалась недостатність імунної системи. Недостатність І та ІІ ступеню реєструвалась, відповідно, у (24,60±0,66)% і (7,80±0,41)% хворих на АП та (9,50±0,35)% і (4,80±0,25)% хворих на ГРЗ. Недостатність ІІІ ступеню у хворих обох груп на цей період хвороби не була виявлена. Тобто у всіх хворих на АП, на відміну від хворих на ГРЗ, виявлялася недостатність імунної системи, яка зберігалась у третини хворих і на другому тижні хвороби.
Таким чином, аналіз проведених досліджень дозволив відібрати критерії щодо розробки способу диференціальної діагностики атипової пневмонії та гострих респіраторних захворювань за допомогою визначення вмісту та змін морфології окремих клітин у пулах нейтрофілів та лімфоцитів периферичної крові в перші дні захворювання. Такими критеріями виявилися: співвідношення абсолютного вмісту паличкоядерних нейтрофілів до сегментоядерних, як 1:4 й нижче; відносний вміст нейтрофілів 20% й більше з гіпосегментованим ядром у пулі сегментоядерних нейтрофілів; та недостатність імунної системи за показником зниження абсолютного вмісту (нижче 1,6 г/л) морфологічно незмінених лімфоцитів. Виконання способу не потребує дорогого та дефіцитного обладнання, реактивів, спеціального приміщення та спеціальної підготовки фахівців, є дешевим, так як є розрахунковим. Використання даного способу діагностики атипової пневмонії дозволяє провести діагностику в будь-якій лабораторії, підвищити виявлення випадків захворювання на атипові пневмонії на 30%, відповідно своєчасно призначати адекватне лікування хворим на атипову пневмонію, попередити ускладнення та хронізацію процесу.
Висновки
Діагноз атипової пневмонії у перші дні захворювання може бути підтверджений при зменшенні співвідношення абсолютного вмісту паличкоядерних нейтрофілів до сегментоядерних, як 1:4 й нижче, збільшенні відносного вмісту нейтрофілів з гіпосегментованим ядром до 20% й більше та зменшенні абсолютного вмісту морфологічно незмінених лімфоцитів нижче за 1,6 г/л.
Література
-
Miyashita N. Atypical pneumonia: Pathophysiology, diagnosis, and treatment. Respir Investig. 2022;60(1):56-67. DOI: 10.1016/j. resinv.2021.09.009.
-
Collaborators G. L. Age-sex differences in the global burden of lower respiratory infections and risk factors, 1990-2019: Results from the Global Burden of Disease Study 2019. Lancet Infect. Dis. 2022; 22: 1626–1647. DOI:https://doi.org/1010.1016/S1473-3099(22)00510-2.
-
Garin N., Marti C., Lami A. S., Prendki V. Atypical Pathogens in Adult Community-Acquired Pneumonia and Implications for Empiric Antibiotic Treatment: A Narrative Review. Microorganisms. 2022; 12 (10): 2326-2338. DOI: https://doi.org/10.3390/ microorganisms10122326.
-
Klepikov I. Why is Pneumonia Becoming Increasingly Atypical Med Clin Res. 2024; 2 (9): 01-05. DOI:10.33140/MCR.09.02.0.
-
Adamczyk P., Parkolap J., Kiryszewska-Jesionek A., Pastuszak- Lewandoska D. Diagnostics of atypical pulmonary infections. Medical Studies/Studia Medyczne. 2023;39 (1): 65-72. DOI :https:// doi.org/10.5114/ms.2023.126297.
-
Georgakopoulou V. E., Lempesis I. G. , Tarantinos K., Sklapani P., Trakas N., Spandidos D. A. Atypical pneumonia (Review). Exp Ther Med. 2024; 28(5):424. DOI: 10.3892/etm.2024.12713.
-
Yoo I. Y., Seok H. S., Kwon J. A., Lee J., Jo S., Kim S. Y. Et al. Evaluation of the BioFire® FilmArray® Pneumonia Panel with Conventional Bacterial Culture in Conjunction with Leukocyte Esterase Test. Diagnostics (Basel). 2023 May 25;13 (11):1847. DOI:10.3390/ diagnostics13111847.
-
Raksha-Slіusareva O. A., Trykhlib V. I., Slіusarev O. A., Tarasova I. A., Alekseenko V. V. Comparative analysis of immunity system indicators among patients with infectious diseases of the respiratory system. Aktual’naâ Infektologiâ. 2019;7(5):259-263. (in Ukrainian) DOI:10.22141/2312-413x.7.5.2019.183705.
-
Гольдберг Е. Д. и соавт. Лабораторные методы исследования системы гемостаза. — Томск, 1980. — 313 с
-
Зак К. П. Большие гранулосодержащие лимфоциты в патологии [Текст] / К. П. Зак, Л. П. Киндзельский, А. К. Бутенко ; Акад. наук Украины, Ин-т эндокрин. и обмена веществ. – Київ : Наук. думка, 1992. – 164 с. : рис. – Библиогр.: с. 134-160. – ISBN 5-14-003250-8: 4.30 р
-
Глузман Д. Ф., Абраменко И. В, Скляренко Л. М., Писнячевская Г. В. Иммуноцитохимическая диагностика злокачественных экссудатов. Киев: Наук, думка, 1993. 11
-
Михайловська Е. В. Клітинні реакції строми кровотворних органів при дії на організм іонізуючої та неіонізуючої радіації [Текст] : автореф. дис.. д-ра біол. наук : 03.00.01 / Михайловська Елеонора Володимирівна ; Нац. акад. наук України, Ін-т експерим. патології, онкології і радіобіології ім. Р. Є. Кавецького. – К., 1994. – 35 с.
-
Талько В. В. Морфоцитохімічна характеристика імунокомпе- тентних клітин периферичної крові осіб, що зазнали впливу іонізуючого випромінювання внаслідок аварії на Чорнобильській АЕС [Текст]: дис. д-ра мед. наук: 14.00.36 / Талько Вікторія Василівна; АМН України, Науковий центр радіаційної медицини. – К., 1993. – 323 с.
-
Raksha-Sliusareva O. A , Serkyiz Ya Yi, Yindik V. M, Lyipska A. Yi. Risks of remoted consequences in animals permanently living in Chernobyl zone.; Riziki vyiddalenikh naslyidkyiv u tvarin, shcho postyijno znakhodilisya v zonyi ChAES.1996/12/31
-
Ракша-Слюсарева О. А., Ластков Д. О., Партас О. В., Асланова Е. А Вплив іонізуючої радіації на гематоімунологічний стан гірників вугільних шахт (перші підсумки)Український радіологічний журнал 1999: 7 (3), 279-281.
-
Kasrashvili H., Ksonz I., Hiulmamedov P., Sliusarev О., Raksha- Slіusareva О. Search for new criteria among the blood hemogram indices to assess the condition of patients with chronic wounds and efficacy of their treatment. Georgian Medical New. 2021;5(314):30-34. PMID: 34248024.
-
Коваленко П. Г. Дослідження впливу комбінованого з техногенним природного іонізуючого опромінення на показники червоної крові. Природничий Альманах. 2022.20-27 DOI: 10.32999/ ksu2524-0838/2022-32-2
-
Raksha-Slіusareva О. А., Kovalenko P. G., Slіusarev О. А., Kots S. М., Boyeva S. S. Correction of the indicators of the immune system with the help of bee pollen in conditions of the continuous combined effect of low-intensity ionizing radiation of natural and man-made origin. Nucl Phys. At. Energy 2023, volume 24, issue 2, pages 138-147. https://doi.org/10.15407/jnpae2023.02.138
-
Tkachuk S. I., Trykhlib V. I., Sliusarev O. A., Raksha-Sliusareva O. A. Examination of immune system state among mobilized militaries and contract servicemen with acute respiratory infections during ATO. Journal of Infectious Diseases. 2017;1(87):35-41. (in Ukrainian) DOI:10.11603/1681-2727.2017.1.7769.
-
Shojaan H., Kalami N., Alamdari M. G., Alorizy S. M., Ghaedi A. Е., Bazrgar A. at al. Diagnostic value of the Neutrophil Lymphocyte Ratio in discrimination between tuberculosis and bacterial community acquired pneumonia: A meta-analysis. J Clin Tuberc Other Mycobact Dis. 2023; 23 (33):100395-407. DOI:https://doi. org/10.1016/j.jctube.2023.100395.
-
Zawiah M., Khan H. A., Farha R. А., Usman A., Bitar A. N. Neutrophil- lymphocyte ratio, monocyte-lymphocyte ratio, and platelet- lymphocyte ratio in stroke-associated pneumonia: a systematic review and meta-analysis. Curr Med Res Opin. 2023; 39(3):475-482. DOI: 10.1080/03007995.2023.2174327.
-
Zhang G. M., Gu Y-Y. Diagnostic value of Procalcitonin, C-reactive protein-to-lymphocyte ratio (CLR), C-reactive protein and neutrophil-to-lymphocyte ratio (NLR) for predicting patients with Bacteraemia in the intensive care unit. J Crit Care. 2024; 81:154538-154547. DOI: 10.1016/j.jcrc.2024.154538.
-
Raksha-Slіusareva O. A., Trуkhlib V. I., Slіusarev O. A., Tarasova I. A., Boyeva S. S. Peculiarities of cytomorphological changes in the population of neutrophils in the development of differential diagnostic criteria for atypical pneumonia. Current Infectology. 2020; 8 (5-6): 29-34 DOI: https://doi.org/10.22141/2312-413x.8.5-6.2020.217957.
-
Raksha-Slyusareva O. A., Trichlib V. I., Slyusarev O. A., Zadorozhna V. I., Kovalenko P. G. Cytomorphological changes in the lymphocyte population as an additional differential diagnostic criterion of atypical pneumonia. World of medicine and biology. 2024;2(88):119-123 (in Ukrainian) DOI: 10.26724/2079- 8334-2024-2-88-119-123.
-
Lutsyk B. D., Lapovets L. Y., Lebed G. B., Akimova V. M., Mishunin I. F., authors; Lutsyk B. D., editor. Klinichna laboratorna diahnostyka : navch. posib [a textbook: Clinical laboratory diagnostics]. Kyiv: Medytsyna; 2018, 288 р. (in Ukrainian).
-
Nahornaia N. V., Raksha-Slіusareva O. A, Dmytruk В. І. Cytomorphological indicators of blood as a reflection of the body’s detoxification system in children with neurocirculatory dystonia. In:. Current issues of pharmaceutical and medical science and prevention. A collection of articles. Zaporozhye: ZDMU. 1999;5:161- 164 (in Russian).
-
Raksha-Slіusareva O. A, Tarasova I. A, Slіusarev O. A, Chernyshova O. E, Zadorozhna V. I., Boyeva S. S. at al. Cytomorphological studies in monitoring the effectiveness of treatment of acute respiratory diseases complicated by obstructive syndrome. World of medicine and biology. 2022; 2 (80):125-129. DOI: https://doi.org: 10.26724/2079-8334-2022-2-80-125-129.
-
Raksha-Slіusareva О. А, Sliusarev О. А, Boieva S. S, et al. Dynamics of nonspecific resistance indicators in the population of Ukraine in the territories of hostilities during the war with the Russian Federation. Concepts for the Development of Society’s Scientific Potential. 2023;34(159):209-219. DOI: https://doi.org/10.51582/ interconf.19-20.06.2023.021.
-
Raksha-Slіusareva О. А, Sliusarev О. А, Boieva S. S, Sierykh N. O, Stryzhak N. V. Predictors of the blood and immune system in the conditionally healthy population of the Donetsk region during the Joint Operational Operations. In: Scientific research of the XXI century. Volume 1. collective monograph. Compiled by V. Shpak; Chairman of the Editorial Board S. Tabachnikov. Sherman Oaks, Los Angeles: GS publishing service. 2021;162-166 р. (in Ukrainian). DOI : 10.51587/9781-7364-13302-2021-001.
-
Raksha-Slіusareva О. А, Sliusarev О. А, Sliusarev M. О, Tarasova I. A, Samarin D. В, Yukhymenko О. О. Method for detecting hidden immune system deficiency (PNSI). Newsletter. Supplement to the Journal of the National Academy of Medical Sciences of Ukraine. 2017;43: 46. (in Ukrainian). DOI: 10.13140/RG.2.2.18096.20488.
Відомості про авторів:
Ракша-Слюсарева О. А. — к. мед. н., д. б. н., професор, професор кафедри мікробіології, вірусології, імунології та медичної біології Донецького національного університету, м. Лиман, Україна. ORCID: 0000-0003-2144-6792
Трихліб В. І. — д. мед. н., професор, професор кафедри військової терапії Української військово-медичної академії, м. Київ. ORCID: 0000-0001-9250-4385
Слюсарев О. А. — к. мед. н., доцент, завідувач кафедри мікробіології, вірусології, імунології та медичної біології Донецького національного університету, м. Лиман, Україна. ORCID: 0000-0002-2968-9388
Задорожна В. І. — чл.-кор. НАМН України, доктор медичних наук, професор, директор ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України, м. Київ, Україна. ORCID: 0000-0002-2746-2007
Тарасова І. А. — лікар загальної практики сімейної медицини КНП «Центр первинної медико-санітарної допомоги № 1 Святошинського району», м. Київ, Україна.
Маричев І. Л. — к. мед. н., старший науковий співробітник, завідувач лабораторії вакцинокерованих інфекцій та вакцинопрофілактики ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна, ORCID: 0009-0008-0845-8493
Боєва С. С. — к. мед. н., доцент Литовського університету наук здоров’я. ORCID: 0000-0002-2691-1895
Кононова І. Г. — к. мед. н., вчений секретар ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна. ORCID: 0009-0000-9344-1435
Конфлікт інтересів: конфлікт інтересів авторів відсутній.
Information about the authors:
Raksha-Slіusareva О. А. — Cand. of Med. Sciences, Doctor of Biological Sciences, Full Professor, Professor at the Microbiology, Virology, Immunology and Medical biologyDepartment of Donetsk National Medical University, Lyman, Ukraine. ORCID ID: 0000-0003-2144-6792
Trykhlib В. І. — Doctor of Medical Sciences, Professor, Professor of the Department of Military Therapy of the Ukrainian Military Medical Academy, Kyiv. ORCID ID: 0000-0001-9250-4385
Sliusarev О. А. — Cand. of Med. Sciences, Docent, Head of the Department of Microbiology, Virology, Immunology and Medical biology of Donetsk National Medical University, Lyman, Ukraine. ORCID: 0000-0002-2968-9388
ZadorozhnaV. I. — corresponding member оf NAS of Ukraine, Doctor of Medical Sciences, Professor, head of SІ “L. V. Hromashevskyi National Academy of Sciences of Ukraine”, Kyiv, Ukraine. ORCID: 0000-0002-2746-2007
Tarasova I. А. — general practitioner of family medicine, KNP “Center for Primary Medical and Sanitary Care No. 1 of Svyatoshynskyi District”, Kyiv, Ukraine.
Boieva S. S. — Cand. of Med. Sciences, Docent, Lithuanian University of Health and Science. ORCID: 0000-0002-2691-1895
Marichev I. L. — Cand. of Med. Sciences, Senior researcher, Head of the Laboratory of Vaccine-Controlled Infections and Vaccine Prevention of SІ “L. V. Hromashevskyi National Academy of Sciences of Ukraine”, Kyiv, Ukraine. ORCID: 0009-0008-0845-8493
Kononova I. H. — Cand. of Med. Sciences, learned secretary SI “L. V. Hromashevskyi Institute of Epidemiology and Infectious Diseases of National Academy of Sciences of Ukraine”, Kyiv, Ukraine.ORCID: 0009-0000-9344-1435
Conflicts of interest: аuthors have no conflict of interest to declare.
