Зоонозний грип у сезоні 2023/2024 років (аналітичний огляд)

УДК: 616.921.5
DOI: https://dоi.org/10.61948/prevmed-2024-3-2
В. І. Задорожна, Н. П. Винник, В. Р. Шагінян
2023/2024 РОКІВ (аналітичний огляд)
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ
Е-mail: vrs1808@gmail.com
Протягом останніх сезонів спостерігається тенденція до зростання випадків пташиного і свинячого грипу в людей, що може бути пов’язано як із ефективністю епідеміологічного нагляду за тяжким гострим респіраторним синдромом, що суттєво посилився на тлі пандемії COVID-19, так і з невиключеною можливістю активізації епізоотичних процесів та підвищення ризику інфікування людей. Зважаючи на це, метою роботи був аналіз захворюваності та збудників зоонозного грипу періоду 2023/2024 рр., що проведений на підставі існуючих офіційних та літературних джерел. Випадки цього сезону були викликані підтипами пташиних вірусів А(H5N1), А(H5N2), А(H9N2), А(H10N5) та вірусами свиней підтипів А(H1N1)v, А(H1N2)v та А(H3N2)v. При цьому два пташиних віруси виявилися новими для людини — А(H10N5) (2023 р.) та А(H5N2) (2024 р.). Для вірусу А(H5N1) останніми роками показано адаптаційний потенціал щодо розширення кола біологічних хазяїв, зокрема ссавців (великої рогатої худоби), що зі свого боку підвищує ризики інфікування людей. Для вірусів грипу свиней спостерігається розширення ареалу їх визначення, зокрема три випадки зареєстровані в європейських країнах (Велика Британія, Нідерланди, Іспанія). Висувається припущення щодо гіподіагностики цієї інфекції серед людей, що може бути зумовлено легким перебігом захворювань. Протягом сезону 2023/2024 рр. випадків передачі пташиних та свинячих вірусів від людини до людини зареєстровано не було, що дозволяє оцінити їх пандемічний потенціал на даний момент як низький. Водночас, ураховуючи постійну реасортацію генів зоонозних вірусів грипу в природі, зокрема і з міжвидовою їх передачею, та історичний досвід пандемій грипу, не виключено в будь-який момент формування емерджентного варіанту зоонозного вірусу грипу з пандемічним потенціалом. Зазначене потребує постійного вірусологічного моніторингу циркуляції вірусів грипу з позиції концепції «Єдиного здоров’я». Готовність у світовому масштабі до потенційної пандемії грипу визначається функціонуванням системи вірусологічного моніторингу грипу, наявністю ефективних технологій виробництва вакцин та штамів вірусів зоонозного грипу, що визначені як кандидати для отримання вакцин. Однак, ці напрями мають постійно удосконалюватися.
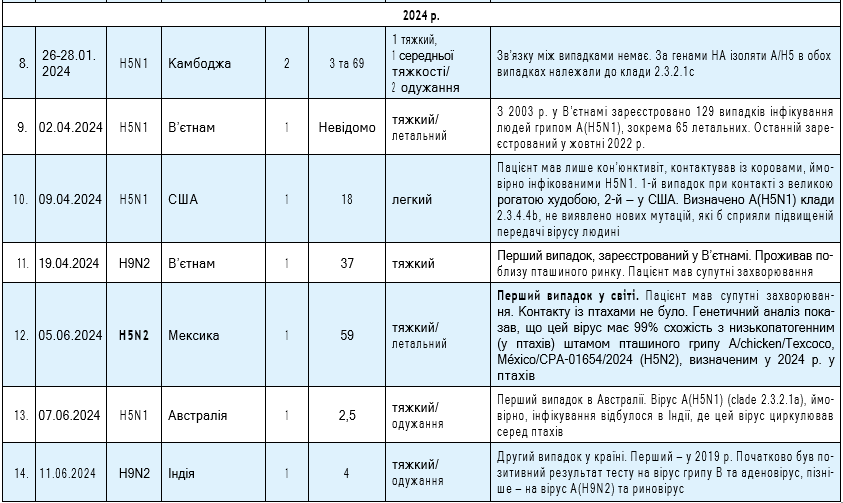
Ключові слова: зоонозний грип, пташині віруси грипу, свинячі віруси грипу, вірусологічний моніторинг, віруси — кандидати для вакцин проти зоонозного грипу.
V. I. Zadorozhna, N. P. Vynnyk, V. R. Shahinian
ZOONOTIC INFLUENZA IN THE SEASON
OF 2023/2024 (analytical review)
State Institution “L. V. Hromashevskyi Institute of Epidemiology and Infectious Diseases of National Academy of Medical Science of Ukraine”, Kyiv
Е-mail: vrs1808@gmail.com
In recent seasons, there has been an upward trend in human cases of avian and swine influenza, which may be due to the effectiveness of epidemiological surveillance of severe acute respiratory syndrome, which occurred against the backdrop of the COVID-19 pandemic, and the possibility of intensifying epizootic processes and increasing the risk of human infection. Based on this, the purpose of the study was to analyze the incidence and causative agents of zoonotic influenza in 2023/2024, based on existing official and literary sources. Cases of this season were caused by avian virus subtypes A(H5N1), A(H5N2), A(H9N2), A(H10N5) and swine virus subtypes A(H1N1)v, A(H1N2)v and A(H3N2)v. At the same time, 2 avian viruses were new to humans — A(H10N5) (2023) and A(H5N2) (2024). In recent years, the A(H5N1) virus has shown an adaptive potential to expand the range of biological hosts, in particular mammals (cattle), which in turn increases the risk of human infection. For swine influenza viruses, there is an expansion of the area of their detection, in particular, 3 cases were registered in European countries (UK, Netherlands, Spain). There is an assumption that this infection is underdiagnosed among humans, which may be due to the mild course of the disease. During the 2023/2024 season, no cases of human-to-human transmission of avian and swine viruses were reported, which allows us to assess their pandemic potential as low at the moment. At the same time, given the constant reassortment of zoonotic influenza virus genes in nature, including interspecies transmission, and the historical experience of influenza pandemics, it is possible that an emergent variant of a zoonotic influenza virus with pandemic potential may emerge at any time. This requires constant virological monitoring of the circulation of influenza viruses from the perspective of the One Health concept. Global preparedness for a potential influenza pandemic is determined by the functioning of the influenza virological monitoring system, the availability of effective vaccine production technologies and zoonotic influenza virus strains identified as candidates for vaccines. However, these areas must be constantly improved.
Key words: zoonotic influenza, avian influenza viruses, swine influenza viruses, virological monitoring, viruses — candidates for vaccines against zoonotic influenza.
Міжнародна система моніторингу за вірусами грипу FluNet (як сезонного, так і зоонозного) функціонує з 1997 р., тобто фактично з того часу, коли були виявлені перші зоонозні пташині віруси грипу А(H5N1). Вона розглядається як глобальний веб-інструмент для вірусологічного нагляду за грипом [1]. Вірусологічні дані, введені у FluNet, використовуються для відстеження циркуляції вірусів у всьому світі та інтерпретації епідеміологічних даних. Дані надаються дистанційно Національними центрами з грипу Глобальної системи епіднагляду та реагування на грип (GISRS), національними референс-лабораторіями з грипу або завантажуються з регіональних баз даних ВООЗ.
Глобальне швидке розповсюдження SARS-CoV-2 та пандемія COVID-19 безпосередньо вплинули на інтенсивність епідемічного процесу грипу та інших ГРВІ. Під час пандемії COVID-19 інтенсивність циркуляції вірусів сезонного грипу різко знизилася, що було пов’язано, з одного боку, з обмежувальними протиепідемічними заходами, з іншого — з активним розповсюдженням вірусу SARS-CоV-2. Але, якщо розглядати динаміку захворюваності на зоонозний грип, привертає увагу тенденція до зростання випадків як пташиного, так і свинячого грипу у людей протягом останніх сезонів, що може бути пов’язано як із ефективністю епідеміологічного нагляду за тяжким гострим респіраторним синдромом, що відбулося на тлі пандемії COVID-19, так і з невиключеною можливістю активізації епізоотичних процесів та підвищення ризику інфікування людей.
Зважаючи на вищесказане, метою роботи був аналіз захворюваності та збудників зоонозного грипу періоду 2023/2024 рр.
Матеріали та методи. При виконанні роботи використані епідеміологічні, аналітичні та інформаційні методи дослідження. Під час аналізу результатів досліджень використовували описово-оціночні й аналітичні підходи епідеміологічного методу дослідження. Проаналізовано дані за період сезону грипу 2023/2024 рр. у Північній півкулі щодо зоонозного грипу відповідно до інформації, наданої ВООЗ на сайті «Disease Outbreak News» [2], матеріалів щотижневих бюлетенів ВООЗ [3], Центрів контролю та профілактики захворюваності (США) [4], Європейського центру контролю та профілактики захворюваності [5], результатів вірусологічного моніторингу за період 40-го тижня 2023 р. — 29-го тижня 2024 р. [6], а також дані доступних наукових джерел, в яких надано нову інформацію про властивості пташиних та свинячих вірусів грипу.
Захворюваність на зоонозний пташиний грип та її етіологія. Після появи в 1997 р. перших повідомлень про випадки грипу у людей, викликані високопатогенними пташиними вірусами (ВППВ) A(H5N1), натепер уже відомо про 14 підтипів пташиних вірусів, які здатні інфікувати людей. При цьому чотири нові віруси були визначені, починаючи з 2021 р., тобто на тлі пандемії COVID-19. Також треба пам’ятати й про ризики, пов’язані з вірусами грипу свиней, особливо, якщо пригадати пандемію свинячого грипу 2009–2010 рр., викликаного вірусом A(H1N1)pdm09, що є постійним патогеном людини, набувши характеристики сезонного вірусу грипу.
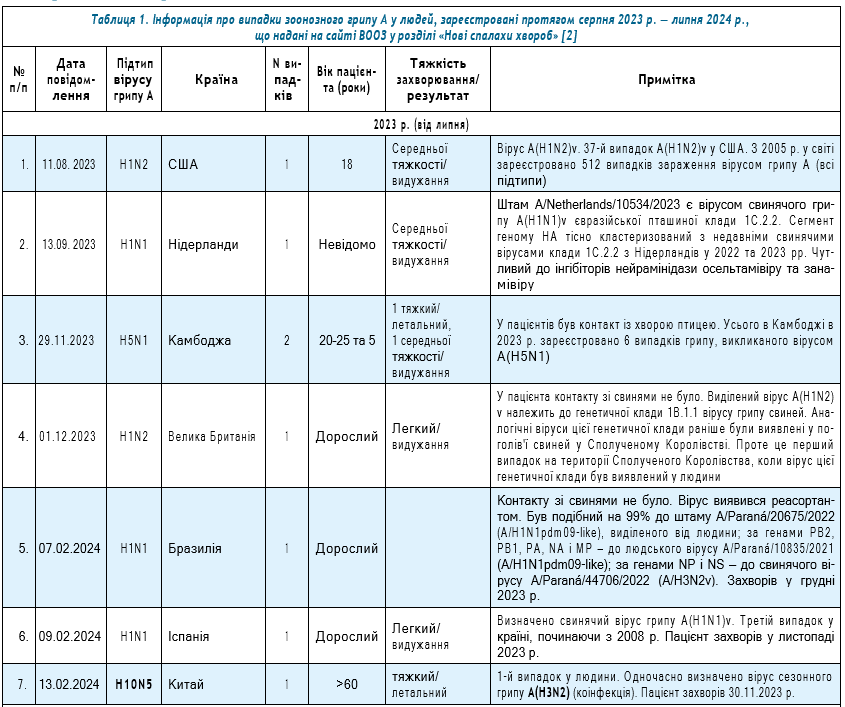
Інформацію про випадки зоонозного грипу, яка була оприлюднена на сайті ВООЗ «Новини про спалах хвороби», та характеристику їх збудників подано в таблиці 1 [2]. Серед 16 описаних випадків 11 були викликані вірусами пташиного грипу, зокрема 7 — вірусом А(H5N1). За аналізований період було визначено два нових для людини віруси — А(H10N5) (2023 р.) та А(H5N2) (2024 р.), а загальна кількість випадків пташиного грипу серед людей становила 21 (14 — А(H5N1), 1 — А(H5N2), 3 — А(H5N6), 1 — А(H9N2), 1 — А(H10N3), 1 —
А(H10N5)) [3]. У даній роботі ми надаємо характеристику вірусів пташиного грипу саме тих підтипів, які були причиною захворювань людей у сезоні 2023/2024 рр. і описуємо ті випадки, про які є доступна інформація. Насправді випадків зоонозного пташиного грипу було значно більше, ніж представлено в таблиці 1, і лише від січня до кінця липня 2024 р. їх кількість становила 20. Детальна характеристика відомих підтипів зоонозних вірусів грипу була нами надана раніше [7].
Віруси А(H5N1). Натепер віруси А(H5N1) є найчастішою етіологічною причиною зоонозного грипу у людей. Здебільшого вони виникають при контакті людей із птицею. Протягом 1997 — травня 2024 рр. у світі зареєстровано 889 випадків грипу А(H5N1), зокрема 463 летальних (52,1%) [8]. Віруси А(H5N1) широко циркулюють у світі серед птахів і ссавців. Наприклад, у період з 16 березня до 14 червня 2024 р. було зареєстровано 42 випадки виявлення вірусу ВППВ A(H5) у домашніх (15) і диких (27) птахів у 13 країнах Європи. Більшість випадків інфікування домашньої птиці спричинено непрямим контактом з дикими птахами, але також було і вторинне поширення. Особливо несприятливою ситуація виявилася в 12 штатах США, де новий генотип вірусу A(H5N1) (B3.13) був ідентифікований більш ніж у 130 молочних стадах. Також ВППВ було вперше визначено в 2 інших видів ссавців (альпаки та моржі). Ризик зараження вірусами пташиного грипу A(H5) класу 2.3.4.4b, що зараз циркулюють у Європі, залишається низьким для населення в ЄС/ЄЕЗ. Водночас ризик інфікування залишається від низького до помірного для тих, хто професійно чи у інший спосіб контактує з інфікованими тваринами або забрудненим середовищем [9]. Що стосується ВППВ підтипу H5 клади 2.3.4.4b, то багато їх різних генотипів неодноразово викликали спалахи в Німеччині. Чотири нових генотипи з’явилися в листопаді 2023 р. після перегрупування з низькопатогенними попередниками, замінивши генотип BB, який домінував у Європі з 2022 р. [10].
Натепер опубліковані результати дослідження про визначення нуклеїнової кислоти вірусу клади 2.3.4.4b у 36,3% досліджуваних зразків пастеризованого коров’ячого молока, придбаного в торговій мережі по всій території США. Хоча вірусне навантаження в зразках виявилося високим, будь-які ознаки життєздатності вірусу підтверджені не були. Автори наголошують на тому, що молоко може бути використано як об’єкт моніторингу еволюції вірусу [11]. З іншого боку, така інформація свідчить про епідемічне значення як молока, так і великої рогатої худоби загалом, як фактору передачі та джерела інфекції цього пташиного вірусу.
Як підтвердження описаних вище ризиків став випадок грипу А(H5N1) у 2024 р. у США (штат Техас) у пацієнта, що контактував із коровами, які, ймовірно, були інфіковані цим вірусом. Клінічно випадок супроводжувався лише кон’юнктивітом. Було визначено вірус A(H5N1) клади 2.3.4.4b, однак нових мутацій, які б сприяли підвищеній передачі вірусу людині, не виявлено. Це був перший випадок у світі, пов’язаний з інфікуванням цим вірусом людини від великої рогатої худоби. За даними Служби інспекції здоров’я тварин і рослин Міністерства сільського господарства США, у 2022 р. надходили повідомлення про спорадичні спалахи, пов’язані з вірусом A(H5) серед свійської птиці та в присадибних стадах великої рогатої худоби, а також про спорадичні випадки виявлення вірусу у ссавців та вуличних кішок на молочних підприємствах [12]. У подальшому було виявлено два випадки інфікування вірусом А(H5N1) робітників коров’ячої ферми в штаті Мічиган. При аналізі виділених штамів (A/Michigan/90/2024 та A/Michigan/91/2024) показано, що обидва віруси тісно пов’язані з вірусами ВППВ клади 2.3.4.4b A(H5N1), визначеними у молочної худоби. Штам A/Michigan/90/2024 на основі повногеномного аналізу був віднесений до генотипу B3.13. Генетична подібність з вірусами молочної худоби опосередковано свідчить про пряму передачу вірусу від великої рогатої худоби до людини. Також було визначено відмінність між штамами, виділеними від людей в Техасі і Мічигані, у геномному сегменті PB2. Штам A/Texas/37/2024 містив нуклеотидну послідовність E627K, якої не було у штама A/Michigan/90/2024, але останній мав M631L. Обидві ці послідовності пов’язані з адаптацією вірусу пташиного грипу до ссавців. При цьому послідовність M631L спостерігалася в 99% послідовностей вірусів молочної худоби з початку спалаху A(H5N1) у березні 2024 р., але набагато рідше — у пташиних вірусів [13]. Загалом протягом сезону 2023/2024 рр. у США було зареєстровано 13 випадків грипу A(H5N1) у людей [14]. У 2023 р. у Чилі було зафіксовано великий спалах грипу А(H5N1) серед свійської та сільськогосподарської птиці, диких птахів і морських ссавців. Тоді ж вірус А(H5) був виділений від пацієнта під час рутинного епіднагляду за тяжкими гострими респіраторними інфекціями [15]. Того ж року в Польщі фіксувався спалах цієї інфекції серед котів [16]. Хоча на теперішній час передачі від людини до людини вірусу А(H5N1) не спостерігається, його широка циркуляція серед птахів та розширення видового розмаїття хазяїв потребують постійного моніторингу щодо молекулярно-генетичних властивостей вірусу, еволюційних особливостей та ризиків адаптації до організму людини.
Вірус грипу A(H5N2). Вірус вперше визначено в 2024 р. у Мексиці у 59-річного пацієнта, який протягом 2–3 тижнів перед захворюванням на грип був прикутим до ліжка у зв’язку із супутньою патологією. Захворювання розпочалося з лихоманки, задишки, діареї, нудоти, загального нездужання і закінчилося летально через ускладнення. За результатами генетичного аналізу, вірус виявився на 99% ідентичним із низькопатогенним для птахів штамом пташиного грипу A/chicken/Texcoco, México/CPA-01654/2024 (H5N2), отриманим у 2024 р. від птахів [17].
Однак ще в 2013 р. під час спалаху пташиного грипу A(H5N2) на пташиних фермах у Тайвані у 6 осіб із 141 обстежених, які мали контакт зі свійською птицею, інфікованою вірусом A(H5N2), визначено сероконверсію специфічних антитіл, хоча віруси від людей виділені не були [18]. Тобто фактично в даному випадку можна говорити про перше повідомлення щодо безсимптомного інфікування людей вірусом A(H5N2), що вже опосередковано свідчило про можливий подальший ризик адаптації цього варіанту вірусу до людського організму.
Про ВППВ A(H5N2) було відомо ще в 1983 р., коли його циркуляція супроводжувалася руйнівними наслідками для птахівництва Пенсильванії, а потім його визначали в Мексиці (1994–1995 рр.) та в Італії (1997–1998 рр.). При цьому спалахи в Пенсильванії і Мексиці чітко демонстрували появу ВППВ А(H5N2) від низькопатогенного попередника. У зв’язку з цим ще в 2012 р. було наголошено на тому, що варто приділити увагу широкому епідеміологічному нагляду за вірусом А(H5N2), щоб запобігти можливій пандемії [19]. Крім того, було показано в експерименті, що при низці пасажів низькопатогенного вірусу А(H5N2) на курчатах його патогенність підвищується [20].
У 2014 р. у Британській Колумбії (Канада) було визначено новий реасортантний ВППВ А(H5N2). Він мав 5 генних сегментів (PB2, PA, HA, M і NS), пов’язаних із євразійським ВППВ А(H5N8), і решти генних сегментів (PB1, NP і NA), пов’язаних із північноамериканськими вірусами грипу водоплавних птахів. Таким чином, мігруючі водоплавні птахи були відповідальними за перенесення євразійського вірусу грипу А(H5N8) до Північної Америки, де згодом відбулося формування нового реасортанту з місцевими вірусами [21].
Оскільки випадок пташиного грипу, викликаний вірусом А(H5N2), є першим, подальший моніторинг його циркуляції та генетичного порівняння з вірусами цього типу, що циркулюють серед птахів, дозволить робити висновки щодо його епідемічного/пандемічного потенціалу.
Вірус грипу A(H9N2). Протягом останніх 2 десятиліть віруси пташиного грипу А(H9N2) набули глобального поширення серед домашньої птиці та становлять загрозу як для світової птахівницької галузі, так і для людей. Їх вважають гіперендемічними для багатьох країн і останніми роками вони були виявлені у домашньої птиці в багатьох нових регіонах. Перші два випадки цієї інфекції у людей були зареєстровані в Гонконзі в 1999 р., у більшості випадків захворювання мають легкий перебіг [22].
На сьогодні у світі зареєстровано 104 випадки грипу A(H9N2) у людей (98 — у Китаї, 2 — у Камбоджі, 1 — у В’єтнамі, 2 — в Індії), зокрема 2 летальних у пацієнтів із супутньою патологією (1,9%) [3, 23, 24]. Два останніх випадки були у В’єтнамі (37-річний пацієнт із супутніми захворюваннями) та Індії (4-річна дитина) і супроводжувалися важким клінічним перебігом. У дитини на тлі дистрессиндрому в міській лікарні при обстеженні був позитивний тест на вірус грипу В та аденовірус. Через один місяць при повторному перебуванні в реанімаційному відділенні та повторному обстеженні тест був позитивний на вірус грипу А (без субтипу) та риновірус. Надалі в лабораторії національного рівня методом ПЛР у реальному часі визначено вірус грипу А(H9N2).
Такі неоднозначні вірусологічні результати свідчать про великий ризик невстановлення діагнозів пташиного грипу та необхідність посилення ефективності вірусологічного моніторингу. З іншого боку, ця інформація є підтвердженням здатності вірусу А(H9N2) до тривалої персистенції в організмі людини, тобто високий потенціал щодо адаптації до нового видового хазяїна та формування нових вірусів-реасортантів.
Про підвищену здатність до реасортації вірусу А(H9N2) повідомляється багатьма дослідниками. Внутрішні гени цього підтипу вірусу визначають у нових зоонозних підтипів пташиних вірусів грипу. При дослідженні потенціалу внутрішніх генів вірусу А(H9N2) (ліній G1 та BJ94) до генерації нових реасортантних пташиних вірусів А(H7N9) при циркуляції серед курей було показано, що перевагу мають гени варіанту BJ94. Також генерація нових реасортантних вірусів мала здатність до ефективної репродукції в клітинах людини. Автори роблять висновок про те, що такі емерджентні реасортантні генотипи можуть становити підвищену загрозу поширення зоонозних вірусів [25].
Важливим є повідомлення про визначення в 2017 р. вірусу А A(H9N2) у єгипетського фруктового кажана (штам A/bat/Egypt/381OP/2017(H9N2)). На відміну від інших вірусів грипу кажанів, цей вірус був споріднений із пташиним вірусом і, ймовірно, був результатом передачі від птаха до кажана. При визначенні його міжвидового потенціалу було показано, що вірус має профіль інактивації й активність нейрамінідази (NA), подібні до пташиних вірусів грипу, адаптованих до людини. Незважаючи на перевагу рецепторів α2, α3 сіалової кислоти, він не здатний реплікувати в організмі качок, однак він легко культивується в респіраторних клітинах людини, розмножується в легенях самок мишей та у верхніх дихальних шляхах самців тхорів. Ці дані свідчать про те, що вірус кажанів A(H9N2) має ознаки, пов’язані з підвищеним ризиком для людей без зміни переваги рецепторів α2, α6 сіалової кислоти [26].
Спостереження за еволюцією вірусу A(H9N2) та ризиком набуття зоонозного потенціалу продовжуються. У Малі було проведено комплексну генетичну характеристику вірусів цього підтипу, які були отримані при обстеженні ринків живої птиці в період 2021–2022 рр. За даними філогеографічного аналізу було показано, що віруси належали до лінії G1, подібної до вірусів, циркулюючих у Західній і Північній Африці, і мали численні молекулярні маркери, пов’язані з підвищеним потенціалом зоонозної передачі та вірулентності. При цьому деякі штами мали молекулярні особливості, що переважно спостерігаються у вірусів А(H9N2) в Азії. Це підтверджує можливість розповсюдження вірусу на великі відстані. Автори підкреслюють необхідність постійного спостереження за циркуляцією вірусів А(H9N2) у популяціях свійської птиці в Західній Африці, що має вирішальне значення для кращого розуміння еволюції вірусу та контролю потенційної появи його зоонозного варіанту [27].
Отже, хоча натепер летальність при грипі, викликаному вірусом А(H9N2), є достатньо низькою порівняно з іншими пташиними вірусами грипу, треба пам’ятати про постійну еволюцію всіх вірусів грипу та їх здатність до реасортації генів із утворенням нових підтипів вірусу, а також можливості підвищення адаптаційного і вірулентного потенціалу.
Вірус грипу А(H10N5). Відомо, що віруси пташиного грипу підтипу A(H10) поширені серед домашніх та диких видів птахів. Вони належать до низькопатогенних і зрідка вражають ссавців (наприклад, свиней). Ураховуючи спорадичний характер зараження людини вірусами А(H10Nx), це не є несподіваною подією. Поки що немає жодних доказів стійкої передачі вірусу від людини до людини [28].
У 2012 р. з’явилося повідомлення про міжвидову передачу вірусу А(H10N5) домашнім свиням у природних умовах. Штам A/swine/Hubei/10/2008/H10N5 був виділений від свиней у 2008 р. у провінції Хубей (Китай). Було показано, що штам мав повністю пташине походження та був гомологічний євразійському пташиному вірусу грипу [29]. У результаті аналізу геному вірусу грипу А(H10N5), отриманому від диких птахів, було виявлено новий реасортантний вірус із внутрішніми генами кількох підтипів і різного походження. Після послідовного пасування на мишах були отримані адаптовані до мишей віруси з мутаціями PB2-E627K і HA-G218E. Ці віруси спричиняли різку втрату маси тіла та смерть, а також реплікувалися в мозку миші. Зазначене свідчить про те, що здатність викликати захворювання низькопатогенного вірусу А(H10N5) у курчат може посилюватися після пасажів в організмі ссавців. Автори підкреслюють: ці дані свідчать про те, що віруси А(H10N5) можуть становити потенційний ризик для здоров’я людини, тому важливо проводити постійний моніторинг за ними та дотримуватися вимог біозахисту [30].
Перший і поки що єдиний випадок грипу в людини, викликаний вірусом A(H10N5), зареєстровано в листопаді 2023 р. у Китаї. Захворіла жінка-фермер віком старше 60 років. Одночасно у пацієнтки також було визначено сезонний вірус грипу A(H3N2). Захворювання закінчилося летально. У пацієнтки в анамнезі був контакт із живою птицею, зокрема покупка качки. Подальше дослідження качиного м’яса, яке зберігалося в холодильнику, показало, що 7 зразків дали позитивний результат на вірус А(H10N5), а 2 — на А(N5). Зразки навколишнього середовища, зібрані в її будинку, були негативними. Зусилля медичного спостереження та нагляду за тісними контактами в провінціях Чжецзян і Аньхой не виявили жодних додаткових підозрюваних випадків [3, 28, 31]. Той факт, що у пацієнтки спостерігалася коінфекція, етіологічно пов’язана з вірусами грипу A(H10N5) та A(H3N2), міг стати причиною тяжкого перебігу захворювання з летальним наслідком.
Подальший генетичний аналіз нуклеотидних послідовностей вірусів А(H10N5), виділених із зразків м’яса качки та від пацієнтки, показав, що гени гемаглютиніну (НА) і NA мали спорідненість на 96,2% і 99,9% відповідно. Гени HA відповідали американській лінії А(H10N5) і були на 95,2% гомологічними штаму A/Anser albifrons/South Korea/22JN-163-1/2022 (H10N7) (GenBank: OQ296824.1).
І навпаки, гени NA належали до євразійської лінії з найвищою гомологією (97,82%) зі штамом A/Spot-billed duck (Anas poecilohyncha)/Korea/KNU17/2022 (H6N5) (GenBank: OR674089.1). Мутацій, які надають стійкість до інгібіторів NA або полімерази (наприклад, балоксавіру) не було виявлено, що свідчить про ефективність противірусних засобів проти цього варіанту вірусу [32].
Підсумовуючи розглянуті питання щодо пташиних вірусів грипу, можна стверджувати, що їх еволюція в останні роки пришвидшилася (поява нових зоонозних вірусів, як-от реасортантів із генами вірусів із різних географічних територій, їх епізоотичне поширення, визначення адаптаційного потенціалу до нових видових хазяїв тощо), що пов’язано з багатьма факторами, зокрема економічними та зміною клімату. Водночас стійкої передачі вірусів від людини до людини натепер не спостерігається, що підтверджується функціонуванням GISRS, яка є достатньо ефективною системою моніторингу циркуляції вірусів грипу і яка продовжує розвиватися. При кожному випадку зоонозного грипу проводиться належне епідеміологічне розслідування із широким вірусологічним обстеженням контактних осіб та дослідженням проб із біотичних та абіотичних об’єктів. Це дозволяє ВООЗ оцінювати на даний момент ризик для населення, пов’язаний з пташиними вірусами грипу, як низький [2]. Але водночас ризики формування емерджентних вірусів грипу з пандемічним потенціалом існують постійно, що вимагає стабільного належного епідеміологічного нагляду. Держави-учасниці Міжнародних медико-санітарних правил (2005) зобов’язані негайно повідомляти ВООЗ про будь-який лабораторно підтверджений випадок нещодавнього зараження людини, викликаного новим підтипом вірусу грипу.
Зоонозні віруси грипу свиней. Усі зоонозні віруси грипу свиней, як і віруси птахів, належать до типу А та поділяються на такі підтипи: А(H1N1)v, А(H1N2)v, А(H3N2)v. Віруси грипу А у свиней мають значну генетичну різноманітність і продовжують становити загрозу пандемії для людей через потенційну відсутність імунітету на популяційному рівні [33]. Крім того, треба пам’ятати, що всі відомі пандемії грипу за останні 130 років були викликані вірусами, які походять від вірусів H1, H2 і H3 (рис.). Хоча щорічно повідомляється про невелику кількість випадків зоонозного свинячого грипу серед людей у США та світі загалом, але вони, безсумнівно, трапляються частіше, ніж про них повідомляють. Більшість людей, у яких розвиваються грипоподібні симптоми, не проходять тестування, тому багато «нових» випадків, ймовірно, залишаються поза увагою [34].
Згідно з даними, наданими ВООЗ на сайті «Новини про спалах хвороби», протягом сезону 2023/2024 рр. представлена інформація про 5 випадків, які сталися в 2023 р. (3 випадки, викликані вірусом А(H1N1)v, 2 — А(H1N2)v) [2] (табл. 1). Випадки були зареєстровані у США, Великій Британії А(H1N2)v, Бразилії, Нідерландах та Іспанії А(H1N1)v. 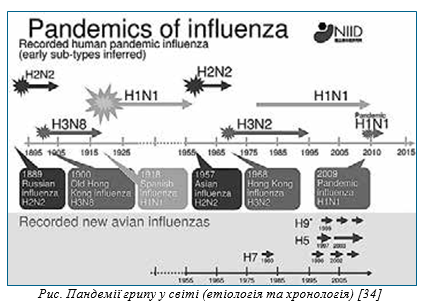
Вірус грипу А(H1N1)v. Як ми пам’ятаємо, саме свинячий вірус цього підтипу А(H1N1pdm09) став причиною пандемії 2009–2010 рр. Циркуляція вірусів А(H1N1)v, як й інших вірусів грипу, потребує постійного моніторингу з метою вчасного виявлення реасортантів із пандемічним потенціалом. В останні роки спостерігається тенденція до розширення територій, де реєструються випадки зоонозного грипу, зокрема й викликані А(H1N1)v. Протягом сезону 2023/2024 рр. такі випадки були зареєстровані в двох європейських країнах у 2023 р. — Нідерландах та Іспанії.
Збудником захворювання у дорослого в Нідерландах, яке супроводжувалося перебігом середньої тяжкості, став штам A/Netherlands/10534/2023, що виявився вірусом свинячого грипу A(H1N1)v євразійської пташиної клади 1C.2.2. Сегмент його геному HA мав високу спорідненість із свинячими вірусами клади 1C.2.2, що були виявлені в Нідерландах у 2022 та 2023 рр. Вірус мав чутливість до інгібіторів нейрамінідази осельтамівіру та занамівіру [35]. Це був перший випадок у Нідерландах, викликаний вірусом А(H1N1)v.
Того ж року зоонозний грип А(H1N1)v було зареєстровано і в Іспанії (3-й випадок у країні, починаючи з 2008 р.). Треба відмітити, що 2-й випадок також був в 2023 р. (у січні) у 63-річного пацієнта з пневмонією та імунодепресивним станом в анамнезі. Інфікування відбулося під час відвідування свиноферми [36, 37]. Цікавим є випадок, викликаний вірусом грипу А(H1N1) v, що виник у Бразилії у дорослого наприкінці 2023 р. Контакту зі свинями встановлено не було. Вірус виявився реасортантом. Він був подібний на 99% до штаму A/Paraná/20675/2022 (A/H1N1pdm09-like), виділеного від людини; за генами PB2, PB1, PA, NA і MP — до людського вірусу A/Paraná/10835/2021 (A/H1N1pdm09-like); за генами NP і NS — до свинячого вірусу A/Paraná/44706/2022 (A/H3N2v). Підкреслюється, що такі дані можуть вказувати на поширення вірусу серед тварин із подальшим його впливом на людей [38].
Вірус грипу А(H1N2)v. Відомо, що віруси свинячого грипу A(H1N2)v циркулюють серед популяцій свиней по всьому світу. Інфікування людини зазвичай відбувається через прямий або опосередкований контакт зі свинями або їх забрудненим середовищем, що призводить до таких симптомів, як лихоманка, втома, зниження апетиту, кашель, а іноді й нежить, біль у горлі, подразнення очей, нудота, блювання та діарея [39].
Обидва випадки у людей, про які повідомлялося на сайті ВООЗ, викликані цим вірусом, сталися в 2023 р. Випадок грипу у пацієнта віком менше 18 років, який виник у США, мав відносно легкий перебіг і не потребував госпіталізації. Хворому було призначено озельтамівір. За 10 днів до появи симптомів пацієнт контактував зі свинями на місцевому сільськогосподарському ярмарку. Інші випадки інфікування людей виявлені не були. З 2005 р. у країні було зареєстровано 512 випадків інфікування вірусом грипу А (всіх підтипів), зокрема 37 випадків інфікування людей вірусами грипу A(H1N2)v [40]. Загалом у США в сезоні 2023/2024 рр. у людей зареєстровано 3 випадки грипу A(H1N2)v [14]. Випадок у дорослого пацієнта, який був зареєстрований у Великій Британії, також мав легкий перебіг. Він виник за відсутності безпосереднього контакту зі свинями. Виділений вірус A(H1N2)v належав до генетичної клади 1B.1.1. Аналогічні віруси цієї генетичної клади раніше були виявлені серед свиней у цій країні. Однак це був перший випадок виявлення вірусу цієї генетичної клади у людини у Великій Британії [41]. Подальше молекулярно-генетичне дослідження вірусу, виділеного від пацієнта, показало його тісну спорідненість за генами НА, NA та внутрішніми генами вірусів свиней A(H1N2)v із навколишнього регіону без утворення будь-яких нових варіантів [42].
З метою оцінки пандемічного потенціалу свинячих вірусів грипу A(H1N2)v було вивчено два широко розповсюджені варіанти вірусів свинячого походження. Показано, що панель людських сироваток, зібраних у здорових дорослих у 2020 р., не містила перехресно-реактивних нейтралізуючих антитіл проти штаму клади α-H1 (α-swH1N2), але містила проти штаму клади γ-H1 (γ-swH1N1). Вірус α-swH1N2 ефективно розмножувався в культурах дихальних шляхів людини та демонстрував фенотипові ознаки, подібні до пандемічного штаму людини А(H1N1pdm09). Крім того, α-swH1N2 був здатний ефективно передаватися повітряно-крапельним шляхом як наївним тхорам, так і тим, що мали імунітет проти сезонного грипу. У тхорів з імунітетом до А(H1N1pdm09) спостерігалося знижене виділення вірусу α-swH1N2 і менш важкі ознаки захворювання, однак вони продовжували передавати вірус α-swH1N2 з ефективністю 50%. Такі результати вказують на вищий, хоча і помірний, пандемічний потенціал штаму α-swH1N2 порівняно з γ-swH1N1 [33].
Вірус грипу А(H3N2)v. Останнім випадком зоонозного грипу описуваного сезону став випадок у Колорадо (США) у 18-річного пацієнта, що виник у липні 2024 р. та був етіологічно пов’язаний з вірусом A(H3N2)
Як виявилося, до початку захворювання пацієнт відвідав сільськогосподарський захід. При обстеженні не виявлено інфікованих серед осіб, з якими контактував хворий. Результатів молекулярно-генетичного дослідження вірусу на даний момент немає [14]. Це не перший випадок інфікування саме вірусом A(H3N2)v під час таких заходів. Зокрема, у 2022 р. у Західній Вірджинії (США) було зареєстровано три випадки грипу A(H3N2)v після відвідування сільськогосподарської ярмарки. За результатами генетичного секвенування три віруси грипу від людей виявилися більш ніж на 99% ідентичними тим, які були отримані від інфікованих свиней на тому ж ярмарку [43]. Водночас віруси A(H3N2)v є досить мінливими, при цьому їх мінливість при інфікуванні вакцинованих і невакцинованих свиней була більш вираженою на тлі вакцинації, що демонструє швидку адаптивність цих вірусів у різних середовищах [44].
У літературному огляді, присвяченому оцінці пандемічного потенціалу свинячих вірусів грипу, зазначається про необхідність урахування таких факторів, які підвищують цей ризик: щільність свиней та населення, що впливає на ризики їх контактів; спорадичні зоонозні випадки і навіть локалізовані спалахи серед людей будуть і надалі траплятися, це не виключає ризику, що один із них викличе нову пандемію; постійне виявлення вірусів грипу людського походження у свиней з невеликим або непередбачуваним антигенним дрейфом не виключає того, що ізольовані популяції свиней можуть діяти як антигенні архіви вірусів грипу людини, що підвищує ризик повторного інфікування людей уже зміненими вірусами [45].
Штами-кандидати для вакцин проти зоонозного грипу на сезон 2024/2025 рр. для Північної півкулі. З метою підвищення готовності в масштабах світу до потенційної пандемії грипу відбувається відбір вірусів-кандидатів для вакцин проти грипу (ВКВГ) на підставі постійного моніторингу циркуляції зоонозних вірусів грипу за координації ВООЗ. Вони переглядаються щосезону з урахуванням інтенсивності циркуляції тих чи інших генетичних варіантів кожного підтипу, розмаїття існуючих генетичних клад та їх адаптаційного потенціалу до людського організму.
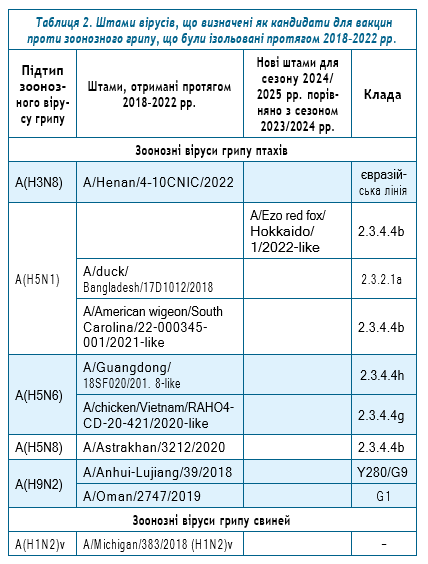
Ознайомитися із списком ВКВГ на кожний сезон, зокрема і на сезон 2024/2025 рр. можна на сайті ВООЗ [46]. Список таких штамів поповнюється щороку. У таблиці 2 наведено штами, які були ізольовані, починаючи із 2018 р., що були визначені як ВКВГ. Порівняно з сезоном 2023/2024 рр. до списку ВКВГ було додано лише 1 штам вірусу A(H5N1) клади 2.3.4.4b — A/Ezo red fox/Hokkaido/1/2022-like.9+
Хоча, здавалося б, такий короткий список штамів міг свідчити про низьку мінливість зоонозних вірусів грипу, насправді значна кількість штамів знаходиться ще в процесі їх вивчення та підготовки до включення до цього списку. Наприклад, тільки проти свинячого грипу А(H1N1)v натепер опрацьовуються 4 штами, виділені в 2020–2023 рр., а для А(H1N2)v — 3 штами, що були отримані в 2021 р.
Загалом наявність відпрацьованої десятиріччями ефективної технології виробництва вакцин проти сезонного грипу, досвід швидкого отримання вакцин проти пандемічного грипу А(H1N1pdm09) та наявність ВКВГ значно підвищують готовність до протидії потенційній пандемії грипу.
Висновки.
- Серед 14 відомих натепер підтипів зоонозних пташиних вірусів грипу 4 нові віруси були визначені, починаючи з 2021 р., тобто на тлі пандемії COVID-19, із них 2 — протягом сезону 2023/2024 рр., а саме А(H10N5) (2023 р.) та А(H5N2) (2024 р.). За 7 міс. 2024 р. зареєстровано 20 випадків пташиного грипу у людей. Випадки цього сезону були викликані підтипами вірусів А(H5N1), А(H5N2), А(H9N2) та А(H10N5). Для вірусу А(H5N1) останніми роками показано адаптаційний потенціал щодо розширення кола біологічних хазяїв, зокрема ссавців, що, зі свого боку, підвищує ризики інфікування людей.
- Незважаючи на опосередковані ознаки пришвидшення еволюції зоонозних пташиних вірусів грипу, стійкої передачі вірусів від людини до людини натепер не спостерігається, що дозволяє оцінювати ризик для населення щодо відомих на даний час вірусів як низький.
- Протягом сезону 2023/2024 рр. у світі зареєстровано випадки грипу в людей, викликані всіма відомими підтипами вірусів свиней (А(H1N1)v, А(H1N2)v, А(H3N2)v), зокрема випадки зафіксовано і в європейських країнах (Велика Британія, Нідерланди, Іспанія). Легкий клінічний перебіг грипу у людей, викликаний вірусами грипу свиней, сприяє гіподіагностиці цієї хвороби через відсутність належного обстеження. У цьому сезоні також не було виявлено випадків передачі вірусів грипу свиней від людини до людини.
- Ураховуючи постійну реасортацію генів зоонозних вірусів грипу в природі, зокрема і з міжвидовою їх передачею, та історичний досвід пандемій грипу, не виключено в будь-який момент формування емерджентного варіанту зоонозного вірусу грипу з пандемічним потенціалом. Зазначене потребує постійного вірусологічного моніторингу циркуляції вірусів грипу з позиції концепції «Єдиного здоров’я».
- Готовність у світовому масштабі до потенційної пандемії грипу визначається функціонуванням системи вірусологічного моніторингу грипу, наявністю ефективних технологій виробництва вакцин та штамів вірусів зоонозного грипу, що визначені як кандидати для отримання вакцин. Однак, ці напрями мають постійно удосконалюватися.
Література
- FluNet. https://www.who.int/tools/flunet
- Disease Outbreak News (DONs). — https://www.who.int/ emergencies/disease-outbreak-news/1
- Office for the Western Pacific. (2024). Avian Influenza Weekly Update 2024. WHO Regional Office for the Western Pacific. https:// iris.who.int/handle/10665/375483
- 2023-2024 U.S. Flu Season: Preliminary In-Season Burden Estimates. Last Reviewed: June 21, 2024. https://www.cdc.gov/flu/ about/burden/preliminary-in-season-estimates.htm
- Influenza virus characterization: summary report, Europe, March Copenhagen: WHO Regional Office for Europe and Stockholm: European Centre for Disease Prevention and Control; 2024. Licence: CC BY 3.0 IGO. https://www.ecdc.europa.eu/en/ publications-data/influenza-virus-characterization-summary-europe-march-2024
- European Respiratory Virus Surveillance WHO European Region Summary, Week 29/2024 (15–21 July 2024). https://erviss.org
- Задорожна В. І., Сергеєва Т. А., Некрасова Л. С. Нові віруси грипу та пов’язані з ними ризики (огляд літератури та власних досліджень). Журнал НАМН України. 2016; 1 (22): 45–55.
- Cumulative number of confirmed human cases for avian influenza A(H5N1) reported to WHO, 2003–2024, 3 May 2024. Emergency Situational Updates. https://www.who.int/ publications/m/item/cumulative-number-of-confirmed-human-cases-for-avian-influenza-a(h5n1)-reported-to-who–2003-2024-3-may-2024
- Avian influenza overview March–June 2024. EFSA Journal. 19 July https://doi.org/10.2903/j.efsa.2024.8930.
- Ahrens A. K., Pohlmann A., Grund C., Harder T., Beer M. Novel Genotypes of Highly Pathogenic Avian Influenza H5N1 Clade 3.4.4b Viruses, Germany, November 2023. Emerg Infect Dis. 2024 Aug;30(8):1737–1739. DOI: 10.3201/eid3008.240103
- Tarbuck , Jones J., Franks J., Kandeil A., DeBeauchamp J., Miller & Bowman A. Detection of a(h5n1) influenza virus nucleic acid in retail pasteurized milk. Biological Sciences. 2024. https://doi. org/10.21203/rs.3.rs-4572362/v1.
- WHO (9 April 2024). Disease Outbreak News; Avian Influenza A (H5N1) — the United States of America. Available at: http:// www.who.int/emergencies/disease-outbreak-news/iten/ 2024-DON512.
- Morse J., Coyle J., Mikesell L. et al. Influenza A(H5N1) virus infection in two dairy farm workers in Michigan. N Engl J Med. August 7, 2024. DOI: 1056/NEJMc2407264
- Weekly U.S. Influenza Surveillance Report. Updated August 9, 2024. https://www.cdc.gov/flu/weekly/index.htm.
- Human infection caused by Avian Influenza A (H5) – Chile. 6 April 2023. — https://www.who.int/emergencies/disease-outbreak-news/item/2023-DON453.
- WHO (16 July 2023). Disease Outbreak News;Influenza A(H5N1) in cats in Available at https://www.who.int/emergencies/ disease-outbreak-news/item/2023-DON476.
- WHO (14 June 2024). Disease Outbreak News; Avian Influenza A(H5N2) in Mexico. Available at: http://www.who.int/emergencies/ disease-outbreak-news/iten/2024-DON524.
- Wu S., Yang J. R., Liu M. T., Yang C. H., Cheng M. C., Chang F. Influenza A(H5N2) virus antibodies in humans after contact with infected poultry, Taiwan, 2012. Emerg Infect Dis. 2014 May;20(5):857– 60. DOI: https://doi.org/10.3201/eid2005.131393.
- Jiao P., Wei L., Yuan R. & Liao M. Complete genome sequence of an H5N2 avian influenza virus isolated from a parrot in southern J Virol. 2012 Aug;86(16):8890-1. https://doi.org/10.1128%2FJVI.01189-12.
- Soda K., Cheng M. C., Yoshida H. et al. A low pathogenic H5N2 influenza virus isolated in Taiwan acquired high pathogenicity by consecutive passages in J Vet Med Sci. 2011 Jun;73(6):767- 72. doi: 10.1292/jvms.10-0532.
- Pasick , Berhane Y., Joseph T. et al. Reassortant Highly Pathogenic Influenza A H5N2 Virus Containing Gene Segments Related to Eurasian H5N8 in British Columbia, Canada, 2014. Sci Rep. 20155; 9484. https://doi.org/10.1038/srep09484.
- Peacock T. P., James J., Sealy J. E., Iqbal M. A Global Perspective on H9N2 Avian Influenza Virus. Viruses. 2019; 11(7):620. https://doi. org/10.3390/v11070620.
- WHO (19 April 2024). Disease Outbreak News; Avian Influenza A(H9N2) in Viet Available at: https://www.who.int/emergencies/ disease-outbreak-news/item/2024-DON514
- WHO (11 June 2024). Disease Outbreak News; Avian Influenza A (H9N2) in Available at: https://www/who.int/emergencies/ disease-outbreak-news/item/2024-DON523.
- James J., Bhat S., Walsh S. K. et al. The Origin of Internal Genes Contributes to the Replication and Transmission Fitness of H7N9 Avian Influenza Virus. J Virol. 2022 Nov 23;96(22):e0129022. http://dx.doi.org/10.1128/jvi.01290-22.
- El-Shesheny R., Franks J., Kandeil A. et al. Cross-species spill-over potential of the H9N2 bat influenza A virus. Nat Commun 2024; 15: https://doi.org/10.1038/s41467-024-47635-4.
- Sanogo I. N., Guinat C., Dellicour S. et al. Genetic insights of H9N2 avian influenza viruses circulating in Mali and phylogeographic patterns in Northern and Western Africa, Virus 2024; 10 (1): veae011, https://doi.org/10.1093/ve/veae011.
- WHO (13 February 2024). Disease Outbreak News; Avian Influenza A(H10N5) and Influenza A(H3N2) coinfection — Available at https://www.who.int/emergencies/disease-outbreak-news/item/ 2023-DON504.
- Wang N., Zou W., Yang Y. et al. Complete Genome Sequence of an H10N5 Avian Influenza Virus Isolated from Pigs in Central China. J. Virol. 2012 Dec; 86(24): 13865–66 https://doi.org/10.1128/jvi.02687-12.
- Jia , Yang J., Wang Z. et al. Genetic properties and pathogenicity of a novel reassortant H10N5 influenza virus from wild birds. Arch.Virol. 2017;162:1349–1353. https://doi.org/10.1007/s00705-017-3234-3Lai CC, Hsueh PR. Human infection caused by avian influenza A (H10N5) virus. J Microbiol Immunol Infect. 2024 Jun;57(3):343-345. DOI: 10.1007/s00705-017-3234-3
- He J., Gong L., Chen X. et al. A Retrospective Investigation of a Case of Dual Infection by Avian-Origin Influenza A (H10N5) and Seasonal Influenza A (H3N2) Viruses — Anhui Province, China, December 2023-January 2024. China CDC Wkly. 2024 Jun 21;6(25):605–613. DOI: 10.46234/ccdcw2024.106.
- Le Sage V., Rockey N. C., French A. J. & Lakdawala S. S. Potential pandemic risk of circulating swine H1N2 influenza viruses. Nat Commun. 2024;15:5025. https://doi.org/10.1038/s41467-024-49117-z.
- WHO Update & Risk Assessment: Influenza A (H1N1) variant virus — the Netherlands. Thursday, September 14, 2023. https://afludiary. blogspot.com/2023/09/who-update-risk-assessment-influenza. html.
- WHO (13 September 2023). Disease Outbreak News; Influenza A(H1N1) variant virus — the Netherlands. Available at: https://www.who.int/ emergencies/disease-outbreak-news/item/2023-DON486.
- WHO (9 February 2024). Disease Outbreak News; Influenza A(H1N1) variant virus — Spain. Available at: http://www.who.int/ emergencies/disease-outbreak-news-/item/2024-DON503.
- Government of Canada. Human emerging respiratory pathogens bulletin: Issue 73, January 2023. https://www.canada.ca/en/ public-health/services/surveillance/human-emerging-resp.
- WHO (7 February 2024). Disease Outbreak News; Influenza A(H1N1) variant virus — Brazil. Available at: https://www.who.int/ emergencies/disease-outbreak-news/item/2024-DON502.
- Kokori E., Olatunji G., Mokuolu A. et al. Influenza A(H1N2)v: global impact, emerging threats and preventive measures. Ann Med Surg (Lond). 2024 Mar 12;86(5):2388–2390. DOI: https://doi.org/10.1097%2 FMS9.0000000000001948
- WHO (11 August 2023). Disease Outbreak News; Influenza A(H1N2) in the United States of America. Available at: https://www.who.int/ emergencies/disease-outbreak-news/item/2023-DON482.
- WHO (1 December 2023). Disease Outbreak News; Influenza A(H1N2) variant virus infection — United Kingdom of Great Britain and Northern Ireland. Available at: https://www.who.int/emergencies/ disease-outbreak-news/item/2023-DON496.
- Cogdale J., Kele B., Myers R. et al. Influenza A(H1N2)v Incident Management Team. A case of swine influenza A(H1N2)v in England, November 2023. Euro Surveill. 2024 Jan;29(3):2400002. DOI: 10.2807/1560-7917.ES.2024.29.3.2400002.
- CDC. CDC Confirms Two New Human Infections with Flu Virus from Pigs During 2022. AUGUST 12, 2022. https://www.cdc.gov/ swine-flu/comm-resources/human-infections-swineflu.html?CDC_ AAref_Val=https://www.cdc.gov/flu/swineflu/spotlights/human-infections-swineflu.htm.
- López-Valiñas Á., Baioni L., Córdoba L. et al. Evolution of Swine Influenza Virus H3N2 in Vaccinated and Nonvaccinated Pigs after Previous Natural H1N1 Infection. Viruses. 2022; 14(9):2008. https://doi. org/10.3390/v14092008.
- Loubet P., Enouf V. & Launay O. The risk of a swine influenza pandemic: still a concern?, Expert Review of Respiratory Medicine. 2019;13(9): 803–5, DOI: 10.1080/17476348.2019.1645011.
- WHO. Zoonotic influenza: candidate vaccine viruses and potency testing reagents. — https:// www.who.int/teams/global-influenza-programme/vaccines/who-recommendations/zoonotic-influenza-viruses-and-candidate-vaccine-viruses.
Відомості про авторів:
Задорожна В. І. — д. мед. н., проф., член-кореспондент НАМН України, директор ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ.
e-mail: viz2010@ukr.net
ORCID: 0000-0002-0917-2007
Шагінян В. Р. — д. мед. н., старший науковий співробітник, завідувач відділу діагностики інфекційних та паразитарних хвороб ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ.
ORCID: 0000-0002-2746-3414
Винник Н. П. — к. мед. н., старший науковий співробітник відділу епідеміологічного аналізу та імунопрофілактики ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ.
e-mail: vnp2006@ukr.net ORCID: 0000-0002-5608-005X
Information about the authors:
Zadorozhna V. I. — Doctor of Medicine, Professor, Сorresponding member of National Academy of Medical Sciences of Ukraine, director of the SI «The L. V. Hromashevskyi Institute of Epidemiology and Infectious Diseases of National Academy of Medical Sciences of Ukraine», Kyiv.
e-mail: viz2010@ukr.net
ORCID: 0000-0002-0917-2007
Shahinian V. R. — Doctor of Medicine, Senior Researcher, Head of the Department of Diagnostics of Infectious and Parasitic Diseases of the SI «The L. V. Hromashevskyi Institute of Epidemiology and Infectious Diseases of National Academy of Medical Sciences of Ukraine», Kyiv. . ORCID: 0000-0002-2746-3414
Vynnyk N. P. — PhD (Medicine), Senior Researcher of t h e Department of Epidemiological Analysis and Immunoprophylaxis of the State Institution “L. V. Hromashevskyi Epidemiology and Infectious Diseases Institute of National Academy of Medical Sciences of Ukraine”;
e-mail: vnp2006@ukr.net ORCID: 0000-0002-5608-005X
