Вірусні гепатити: статистичний аналіз клінічних досліджень ефективності використання лікарського засобу ПРОТЕФЛАЗІД®
УДК: 519.2:615.015:616.36
DOI: https://doi.org/10.61948/prevmed-2024-3-36
В. І. Матяш1, О. Й Гриневич2, Л. О. Ященко3
ВІРУСНІ ГЕПАТИТИ: СТАТИСТИЧНИЙ АНАЛІЗ КЛІНІЧНИХ ДОСЛІДЖЕНЬ ЕФЕКТИВНОСТІ ВИКОРИСТАННЯ ЛІКАРСЬКОГО ЗАСОБУ ПРОТЕФЛАЗІД®
1. ДУ «Інститут епідеміології та інфекційних хвороб імені Л. В. Громашевського НАМН України», Київ, Україна
2. ТОВ «НВК «Екофарм», Київ, Україна
3. Інститут продовольчих ресурсів НААН, Київ, Україна
Анотація. Пошук інформації про клінічні дослідження, присвячені вивченню ефективності та безпеки застосування лікарського засобу ПРОТЕФЛАЗІД® (краплі) при лікуванні вірусних гепатитів (В, С), здійснювали в мережі Інтернет за допомогою інформаційно-пошукових систем. За результатами пошуку отри мано 8 наукових публікацій результатів клінічних досліджень щодо ефективності застосування препарату ПРОТЕФЛАЗІД® у лікуванні вірусних гепатитів В і С серед дорослої категорії пацієнтів (наукові праці, опубліковані в період 2000–2004 роки). Проведений статистичний аналіз результатів клінічних досліджень показує: під впливом лікування гепатиту препаратом ПРОТЕФЛАЗІД® спостерігається регрес цитолітичного та холестатичного синдромів, відновлення білковосинтетичної та гемостатичної функцій печінки, зменшення гепатота спленомегалії, відзначається відновлення структури печінки, зниження кількості антигенів та інтенсивності розмноження вірусу в крові. Необхідно зазначити, що печінка після 3 місяців лікування лікарським засобом ПРОТЕФЛАЗІД® (краплі) значно зменшується у розмірах. Показник «білірубін загальний» після 2 місяців лікування знаходиться в межах норми, водночас спостерігається зменшення середнього значення білірубіну загального, яке є статистично значущим вже після 1 місяця лікування. Подібні позитивні зміни спостерігаються і серед інших важливих показників функції печінки. На фоні терапії лікарським засобом ПРОТЕФЛАЗІД® (краплі) прослідковується така ймовірність частоти виявлення випадків:
- підвищеної ехогенності печінки (за даними УЗД) через 3 місяці після лікування у 14,3 раза нижче, ніж до лікування, відповідно через 6 місяців — у 33,3 раза нижче, ніж до лікування;
- дрібнозернистості структури печінки (за даними УЗД) через 3 місяці після лікування у 3,2 раза нижче, ніж до лікування;
- наявності маркерів НВV (Аg НВе) на тлі лікування протягом 1 місяця в 3,8 раза нижче, ніж до лікування;
- наявності маркерів НВV (IgM НВс) на фоні лікування протягом 3 місяців у 4,8 раза нижче, ніж до лікування, відповідно протягом 6 місяців — у 8,3 раза нижче, ніж до лікування;
- наявності в крові ДНК НВV методом ПЛР на фоні лікування протягом 3 місяців у 14,3 раза нижче, ніж до лікування, відповідно протягом 6 місяців в 25 разів нижче, ніж до лікування.
Враховуючи добру переносимість, високий профіль безпеки, комплексну дію на різні етапи розвитку вірусних гепатитів, лікарський засіб ПРОТЕФЛАЗІД® (краплі) можна рекомендувати як ефективний і безпечний противірусний засіб для лікування вірусних гепатитів (В та С).
Ключові слова: ПРОТЕФЛАЗІД® (краплі), гепатит В, гепатит С, дорослі пацієнти, лікування, метааналіз, t-критерій.
I. Matyash1, O. Y. Hrynevуch2, L. О. Yashchenko3
VIRAL HEPATITIS:STATISTICAL ANALYSIS OF CLINICAL RESEARCH ON THE EFFECTIVENESS OF USING THE DRUG PROTEFLAZID®
1. SІ “L. V. Hromashevskyi Institute of Epidemiology and Infectious Diseases of the NAMS of Ukraine”, Kyiv, Ukraine
2. LLS “NVK “Ekofarm”, Kyiv, Ukraine
3. Institute of Food Resources NAAS, Kyiv, Ukraine
Abstract. The search for information on clinical trials devoted to the study of the efficacy and safety of the drug PROTEFLAZID® (drops) in the treatment of viral hepatitis (B, C) was carried out on the Internet using information retrieval systems. According to the results of the search, 8 scientific publications of the results of clinical trials on
the effectiveness of the use of PROTEFLAZID® in the treatment of viral hepatitis B and C in the adult category of patients were obtained (scientific papers, published between 2000 and 2004). The statistical analysis of the results of clinical trials shows that under the influence of hepatitis treatment with PROTEFLAZID®, there is a regression of cytolytic and cholestatic syndromes, restoration of protein-synthetic and hemostatic functions of the liver, a decrease in hepatoand splenomegaly, a decrease in the structure of the liver, a decrease in the number of antigens and the intensity of virus reproduction in the blood. It should be noted that the liver, after 3 months of treatment with PROTEFLAZID® (drops), significantly decreases in size. The indicator “total bilirubin” after 2 months of treatment is within the normal range, while there is a decrease in the average value of total bilirubin, which is statistically significant after 1 month of treatment. Similar positive changes are observed among other important indicators of liver function. Against the background of therapy with PROTEFLAZID® (drops), the probability of detecting cases of: – increased echogenicity of the liver (according to ultrasound) 3 months after treatment is 14.3 times lower than before treatment; respectively after 6 months — 33.3 times lower than before treatment; -fine-grained liver structure (according to ultrasound) 3 months after treatment is 3.2 times lower than before treatment; -the presence of HBV markers (AgHBe) during treatment for 1 month in 3.8 — the presence of HBV markers (IgM HBc) during treatment for 3 months is 4.8 times lower than before treatment, respectively, for 6 months — 8.3 times lower than before treatment; -the presence of DNA-HBV in the blood by PCR during treatment for 3 months is 14.3 times lower than before treatment, respectively, for 6 months it is 25 times lower, than before treatment. Taking into account its good tolerability, high safety profile, complex effect on different stages of development of viral hepatitis, PROTEFLAZID® (drops) can be recommended as an effective and safe antiviral agent for the treatment of viral hepatitis (B and C).
Key words: PROTEFLAZID® (drops), hepatitis B, hepatitis C, adult patients, treatment, meta-analysis, t-criteria.
Вірусні гепатити (В, С) за своєю соціально-економічною та медичною значимістю займають одне з основних місць у патології людини, адже характеризуються глобальним поширенням, неухильною тенденцією до зростання захворюваності, переважно хронічними формами і високим рівнем смертності у світі. Вірусні гепатити, крім гострих респіраторних захворювань, ВІЛ-інфекції та у деяких регіонах туберкульозу, становлять групу кризових інфекцій сьогодення [1, 2]. Безжовтяничні, субклінічні форми гострого та хронічного ВГВ (ХГВ), також цироз та рак печінки, позапечінкові прояви, зумовлені вірусом гепатиту В (HВV), переважно залишаються нерозпізнаними та не реєструються як інфекційні хвороби. За результатами проведених в Україні сероепідеміологічних досліджень встановлено, що сумарна частота виявлення HBsAg та анти-НBс серед пацієнтів лікувальних закладів різного профілю переважно становить 28,6%, серед донорів крові — 15,3%, а серед медпрацівників — 32,2% [1, 2].
Всього у світі вірусом гепатиту С (HCV) інфіковано від 500 до 700 млн людей, що становить приблизно 10% населення земної кулі. На хронічний гепатит С (ХГС) хворіє близько 200 млн людей. Проведені епідеміологічні дослідження свідчать про те, що Україна належить до регіонів з високим розповсюдженням HCV-інфекції. Наразі HCV інфіковано до 3% населення України [2]. Прогноз перебігу вірусних гепатитів, диференціальна діагностика, діагностика гострих та хронічних вірусних гепатитів, цирозу печінки, як і адекватна терапія, й зараз залишаються недостатньо вивченими.
Терапія хронічних гепатитів доволі проблемна. За фактичними даними, в основі розвитку вірусних гепатитів є пролонгована персистенція вірусних агентів, що виникає в результаті функціональних дефектів факторів клітинного та гуморального імунітету, блокади специфічних ефекторних реакцій та системи інтерфероногенезу [1, 2].
У зв’язку з цим, досить актуальною є розробка нових лікарських засобів для профілактики та лікування вірусних гепатитів.
Більшість лікарських засобів, що застосовуються при вірусних інфекціях, являють собою синтетичні та напівсинтетичні пурин-піримідинові антиметаболіти, зокрема, діоксинуклеозидні аналоги, мішенню для яких є вірусні ферменти — транскриптаза та протеаза. У літературі зустрічаються лише поодинокі згадки про застосування вірусних інгібіторів іншої структури. Актуальною проблемою став пошук нових хімічних сполук комбінованої дії, що мали б інгібіторні властивості щодо вірусів і не мали б імуносупресивної дії. Найбільш перспективними у цій галузі є речовини рослинного походження, які у своєму складі мають просторово розташовані феноли з групою флавоноїдів та флавоноїдноподібних речовин, більшість з яких у рослинах представлена як глікозиди. ПРОТЕФЛАЗІД® є противірусним лікарським засобом, який у своєму складі містить суму флавоноїдних глікозидів, виділених з диких злаків: Herba Deschampsia caespitosa L. та Herba Calamagrostis epigeios L.
Флавоноїди, що входять до складу препарату, мають поліфармакологічну дію:
- а) пряму противірусну дію: пригнічують реплікацію ДНК та РНК вірусів. Механізм противірусної дії полягає в інгібуванні вірусоспецифічних ферментів: полімераз та тимідинкінази;
- б) імунотропну дію: є індуктором синтезу ендогенних альфата гама-інтерферонів, що сприяє підвищенню неспецифічної резистентності організму до вірусної та бактеріальної інфекцій;
- в) антиоксидантну дію: інгібують перебіг вільнорадикальних процесів, цим перешкоджають накопиченню продуктів перекисного окислення ліпідів, посилюють антиоксидантний статус клітин, що зменшує інтоксикацію;
- г) апоптозмодулюючу дію: посилюючи дію апоптозіндукуючих речовин та активуючи каспазу 9, сприяють елімінації уражених вірусом клітин та первинній профілактиці виникнення хронічних захворювань на тлі латентних вірусних інфекцій.
Препарат ПРОТЕФЛАЗІД® призначений для місцевого та загального застосування. Препарат попереджає рецидиви захворювання та пролонгує період ремісії.
Мета роботи.
Провести аналіз результатів клінічних досліджень за допомогою метааналізу та з використанням t-критерію з метою оцінки ефективності та безпеки застосування препарату ПРОТЕФЛАЗІД® у терапії пацієнтів із вірусними гепатитами В та С.
Матеріали та методи.
Метааналіз — статистичний аналіз, що узагальнює дані кількох схожих досліджень в єдиний результат і дозволяє оцінити ефективність лікування або діагностики на значно більшій вибірці, ніж в окремому дослідженні. У метааналізі можуть бути математично об’єд-нані два і більше досліджень, метою яких була перевірка тієї самої гіпотези [1, 3].
Для визначення статистичної значущості об’єднаного відношення шансів використовували Z-критерій Фішера. У метааналізі звичайний спосіб оцінки однорідності набору даних окремого дослідження проводили за допомогою тесту на гетерогенність. Критерій χ-квадрат використовували для оцінки неоднорідності між дослідженнями. Р<0,05 вказувала на статистично значущу гетерогенність. Також оцінювали кількісно ефекти неоднорідності за допомогою I2-тесту, який представляє собою співвідношення варіабельності досліджень. Якщо у χ-квадрат критерію P<0,05 або результату I2-тесту більше ніж 50%, то це вказує на існування неоднорідності серед досліджень, і у такому разі для метааналізу обирається модель випадкових ефектів (метод DerSimonian-Laird). В іншому випадку використовується модель фіксованих ефектів (метод Mantel-Haenszel).
Аналіз результатів здійснювали за допомогою графіка Forest рlot. Заголовок діаграми інформує про те, яке саме порівняння (Comparison) відображається на діаграмі, а також який саме тип результату (Outcome) оцінюється в кожному із досліджень. Вертикальна лінія посередині (OR=1) відповідає ситуації, коли лікування не відрізняється від контролю. Відмітка кожного конкретного дослідження (Blob) має більший розмір, ніж більше статистична вага (Weight %) цього дослідження у загальному пулі. Горизонтальні лінії («вуса») біля позначки кожного дослідження відображають довірчий інтервал (95% CI) дослідження. Позначка ромбика (Diamond shape) — це об’єднаний результат, причому довжина ромбика відображає об’єднану оцінку 95% CI. Нижня горизонтальна шкала оцінює ефект лікування порівняно з контролем. Область зліва від вертикалі «1» відповідає зниженню відношення шансів при лікуванні порівняно з контролем. Область праворуч від вертикалі «1» відповідає підвищенню відношення шансів під час лікування порівняно з контролем.
Також доцільно проводити аналіз чутливості для того, щоб оцінити якість та послідовність результатів шляхом пропуску кожного дослідження під час анал зу. Funnel plot («графік-воронка», обсяг вибірки) використовується з метою оцінки необ’єктивності публікацій. Чим вужчим є довірчий інтервал для конкретного дослідження, тим точніше його оцінка ефекту лікування — тим вище розташовується на діаграмі позначення цього дослідження. Відхилення від лійкоподібного розподілу вказує на наявність систематичної помилки у вибірці досліджень.
Якщо кількість пацієнтів зазначена у відсотках, то використовувався t-критерій. Значення критерію вище ніж 0,05 свідчить про те, що середні не відрізняються один від одного. Значення критерію нижче ніж 0,05 свідчить про те, що середні істотно відрізняються один від одного.
Для здійснення метааналізу використовували програмне забезпечення RevMan та для реалізації t-критерію — програмне забезпечення IBM SPSS.
Джерела даних — дослідження виконано на основі пошуку інформації про клінічні дослідження, присвячені вивченню ефективності та безпеки застосування препарату ПРОТЕФЛАЗІД® при лікуванні вірусних гепатитів (В та С) в Інтернеті за допомогою інформаційно-пошукових систем, а також за звітами та науковими публікаціями.
Внаслідок пошуку було відібрано 8 публікацій клінічних результатів досліджень ефективності застосування препарату ПРОТЕФЛАЗІД® при лікуванні вірусних гепатитів В та С у дорослої категорії пацієнтів.
Усі наукові праці, що відображають ефективність застосування препарату ПРОТЕФЛАЗІД® при лікуванні вірусних гепатитів В та С, були опубліковані в період з 2000 по 2004 рік.
Перелік відібраних для статистичного аналізу публікацій, що відображають ефективність застосування препарату ПРОТЕФЛАЗІД® при лікуванні вірусних гепатитів В та С у пацієнтів, представлено у табл.1.
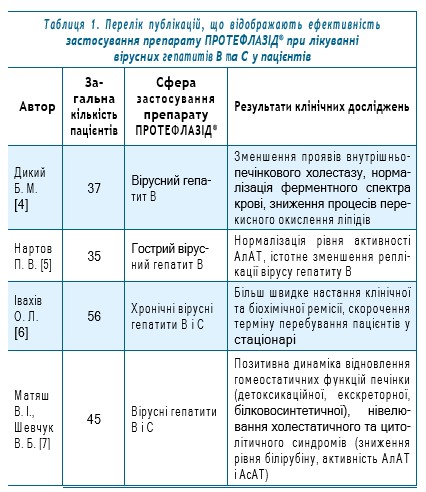
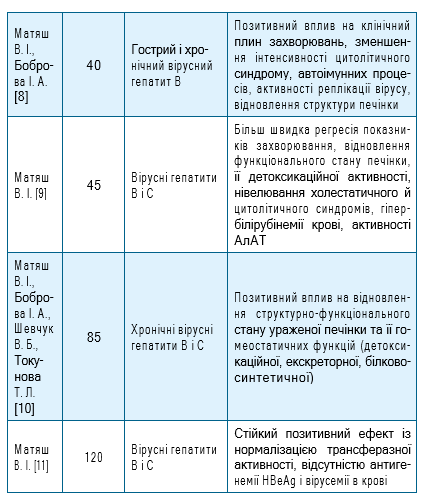
Відібрано 8 публікацій результатів клінічних досліджень ефективності застосування лікарського засобу ПРОТЕФЛАЗІД® при лікуванні 463 пацієнтів з вірусними гепатитами В та С.
Пацієнтам до початку лікування та після закінчення терапії було проведено ретельне обстеження, що включає загальноприйняті клінічні та лаборатор-
Як основні методи діагностики були використані: метод полімеразної ланцюгової реакції (ПЛР) та імуноферментний аналіз (ІФА).
Результати дослідження.
Статистичний аналіз клінічних досліджень, що відображають результати ефективності та безпеки застосування препарату ПРОТЕФЛАЗІД® у хворих при лікуванні вірусних гепатитів В та С проводили за такими статистично значущими показниками:
І. Динаміка рівня біохімічних показників крові у пацієнтів з гострим та хронічним вірусним гепатитом В та гострим і хронічним гепатитом С на тлі застосування препарату ПРОТЕФЛАЗІД®: 1. Білірубін загальний, мкмоль/л. 2. Активність АлАТ у цілісній та розведеній крові, ммоль/л год. 3. Активність АсАТ у цілісній та розведеній крові, ммоль/л год. 4. Білок загальний, 5. г/л. α1-глобуліни, %; 6. α2-глобуліни, %. 7. γ-глобуліни %. 8. Циркулюючі імунні комплекси, 9. од. Протромбіновий індекс, %.
ІІ. Динаміка ехографічних ознак ушкодження печінки у пацієнтів з гострим та хронічним вірусними гепатитами В та гострим та хронічним гепатитом С на фоні застосування препарату ПРОТЕФЛАЗІД®: 1. Збільшення розмірів печінки, см. 2. Збільшення розмірів селезінки, см. 3. Частота випадків підвищеної ехогенності печінки на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 6 місяців. 4. Частота випадків підвищеної ехогенності печінки через 3 місяці після лікування препаратом ПРОТЕФЛАЗІД®. 5. Частота випадків дрібнозернистої структури печінки через 3 місяці після лікування препаратом ПРОТЕФЛАЗІД®.
ІІІ. Частота виявлення маркерів вірусного гепатиту В: 1. Частота виявлення НВеАg на фоні лікуванно-інструментальні методи, зокрема ультразвукове дослідження печінки та селезінки, дослідження показників клітинного та гуморального імунітетів, доплерографія. ня препаратом ПРОТЕФЛАЗІД® протягом 1 місяця. 2. Частота виявлення ІgM НВс на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 3 місяців. 3. Частота виявлення ІgM НВс на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 6 місяців. 4. Частота виявлення в крові ДНК НВV методом ПЛР на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 3 місяців. 5. Частота виявлення в крові ДНК НВV методом ПЛР на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 6 місяців.
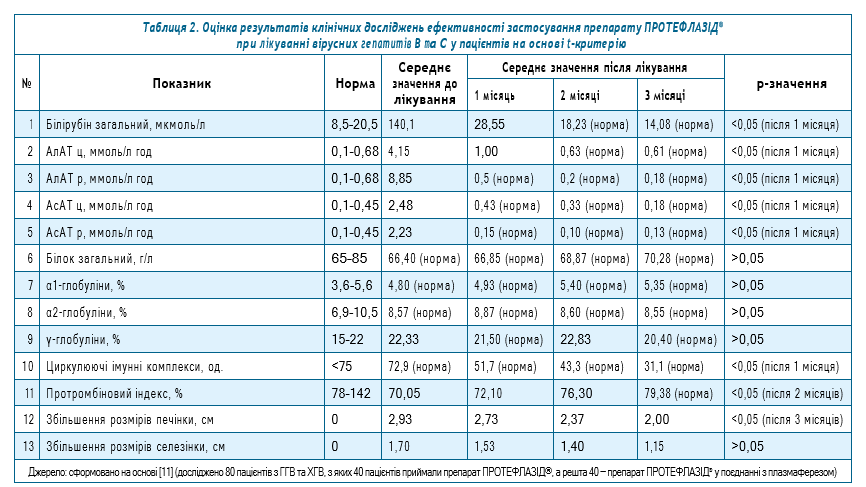
Аналіз клінічних досліджень на основі t-критерію представлено у табл. 2.
Білірубін загальний після 2 місяців лікування препаратом ПРОТЕФЛАЗІД® знаходиться в межах норми. Водночас спостерігається зменшення середнього значення білірубіну загального. Значимість t-критерію (менше ніж 0,05) свідчить про те, що середнє значення білірубіну загального у дорослих пацієнтів, які приймали ПРОТЕФЛАЗІД®, значно відрізняється від середнього значення білірубіну загального у дорослих пацієнтів до лікування вже з першого місяця лікування. АлАТ у цільній крові після 2 місяців лікування препаратом ПРОТЕФЛАЗІД® знаходиться в межах норми. Відбувається зменшення середнього значення АлАТ. Значимість t-критерію (менше ніж 0,05) свідчить про те, що середнє значення АлАТ у цільній крові у пацієнтів, які приймали ПРОТЕФЛАЗІД®, значно відрізняється від середнього значення у пацієнтів до лікування вже з першого місяця лікування.
АлАТ у розведеній крові після 1 місяця лікування препаратом ПРОТЕФЛАЗІД® перебуває у межах норми. Спостерігається зменшення середнього значення АлАТ у розведеній крові. Значимість t-критерію (більше ніж 0,05) свідчить про те, що середнє значення АлАТ у пацієнтів, які приймали ПРОТЕФЛАЗІД®, значно відрізняється від середнього значення АлАТ у пацієнтів до лікування вже з першого місяця лікування.
АсАТ в цільній крові після 1 місяця лікування препаратом ПРОТЕФЛАЗІД® знаходиться в межах норми. Відбувається зменшення середнього значення АсАТ в цільній крові. Значимість t-критерію (менше ніж 0,05) свідчить про те, що середнє значення АсАТ в цільній крові у пацієнтів, які приймали ПРОТЕФЛАЗІД®, значно відрізняється від середнього значення АсАТ у пацієнтів до лікування вже з першого місяця лікування.
АсАТ р після 1 місяця лікування препаратом ПРОТЕФЛАЗІД® знаходиться в межах норми. Спостерігається зменшення середнього значення АсАТ р. Значимість t-критерію (менше ніж 0,05) свідчить про те, що середнє значення АсАТ у пацієнтів, які приймали ПРОТЕФЛАЗІД®, суттєво відрізняється від середнього значення АсАТ у пацієнтів до лікування вже з першого місяця лікування.
Рівень загального білка, концентрація α1-глобулінів, концентрація α2-глобулінів до та після лікування препаратом ПРОТЕФЛАЗІД® знаходяться в межах норми. Значимість t-критерію (більше ніж 0,05) свідчить про те, що середнє значення зазначених показників у пацієнтів, які приймали ПРОТЕФЛАЗІД® 3 місяці, суттєво не відрізняється від середнього значення загального білка у пацієнтів до лікування.
Концентрація γ-глобулінів після трьох місяців лікування препаратом ПРОТЕФЛАЗІД® знаходиться у межах норми. Водночас значимість t-критерію (більше ніж 0,05) свідчить про те, що середнє значення γ-глобулінів у пацієнтів, які приймали ПРОТЕФЛАЗІД® 3 місяці, суттєво не відрізняється від середнього значення γ-глобулінів у пацієнтів до лікування.
Рівень циркулюючих імунних комплексів до та після 3 місяців лікування препаратом ПРОТЕФЛАЗІД® знаходиться в межах норми. При цьому спостерігається зменшення середнього значення рівня циркулюючих імунних комплексів. Значимість t-критерію (менше ніж 0,05) свідчить про те, що середнє значення циркулюючих імунних комплексів у пацієнтів, які приймали ПРОТЕФЛАЗІД®, значно відрізняється від середнього значення циркулюючих імунних комплексів у пацієнтів до лікування вже з першого місяця лікування.
Протромбіновий індекс після 3 місяців лікування препаратом ПРОТЕФЛАЗІД® перебуває у межах норми. Спостерігається підвищення середнього значення протромбінового індексу. Значимість t-критерію (менше ніж 0,05) свідчить про те, що середнє значення протромбінового індексу у пацієнтів, які приймали ПРОТЕФЛАЗІД®, значно відрізняється від середнього значення протромбінового індексу у пацієнтів до лікування після другого місяця лікування.
Розміри печінки після 3 місяців лікування препаратом ПРОТЕФЛАЗІД® значно зменшилися, про що свідчить значимість t-критерію (менше ніж 0,05).
Розміри селезінки після 3 місяців лікування препаратом ПРОТЕФЛАЗІД® суттєво не зменшилися, про що свідчить значимість t-критерію (більше ніж 0,05). Водночас спостерігається динаміка щодо зменшення розмірів селезінки протягом лікування.
Метааналіз клінічних досліджень.
Пацієнти у метааналізі розділені на 4 групи:
Група 1 — пацієнти з гострим гепатитом В (ГГВ), для лікування яких використовували ПРОТЕФЛАЗІД® (основна група) та застосовували тільки базову терапію (контрольна група);
Група 2 — пацієнти з ХГВ, для лікування яких використовували ПРОТЕФЛАЗІД® (основна група) та застосовували тільки базову терапію (контрольна група);
Група 3 — пацієнти з ГГВ, для лікування яких використовували ПРОТЕФЛАЗІД® і плазмаферез (основна група) та застосовували тільки базову терапію (контрольна група);
Група 4 — пацієнти з ХГВ, для лікування яких використовували ПРОТЕФЛАЗІД® і плазмаферез (основна група) та застосовували тільки базову терапію (контрольна група).
Ехографічні ознаки пошкодження печінки.
На рис. 1 зображено Forest plot результатів метааналізу на основі визначення відношення шансів частоти виявлення випадків підвищеної ехогенності печінки на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 6 місяців.
Значення χ-квадрат критерію (Р=0,64) та I2-тесту (I2=0%) свідчать про однорідність даних досліджень, тому обрана модель з фіксованим ефектом. Р-значення критерію Фішера (Р=0,001) демонструє значимість обраного ефекту.
Значення відношення шансів (OR=0,03) свідчить про те, що ймовірність частоти виявлення випадків підвищеної ехогенності печінки на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 6 місяців у 33,3 раза нижча, ніж до лікування.
Найбільшу вагу має дослідження Матяша В. І. (2003), в якому вказується, що у пацієнтів Групи 2 (ХГВ — не приймали препарат ПРОТЕФЛАЗІД®) порівняно з групами пацієнтів, які приймали препарат ПРОТЕФЛАЗІД® ознаки пошкодження печінки спостерігалися частіше [11].
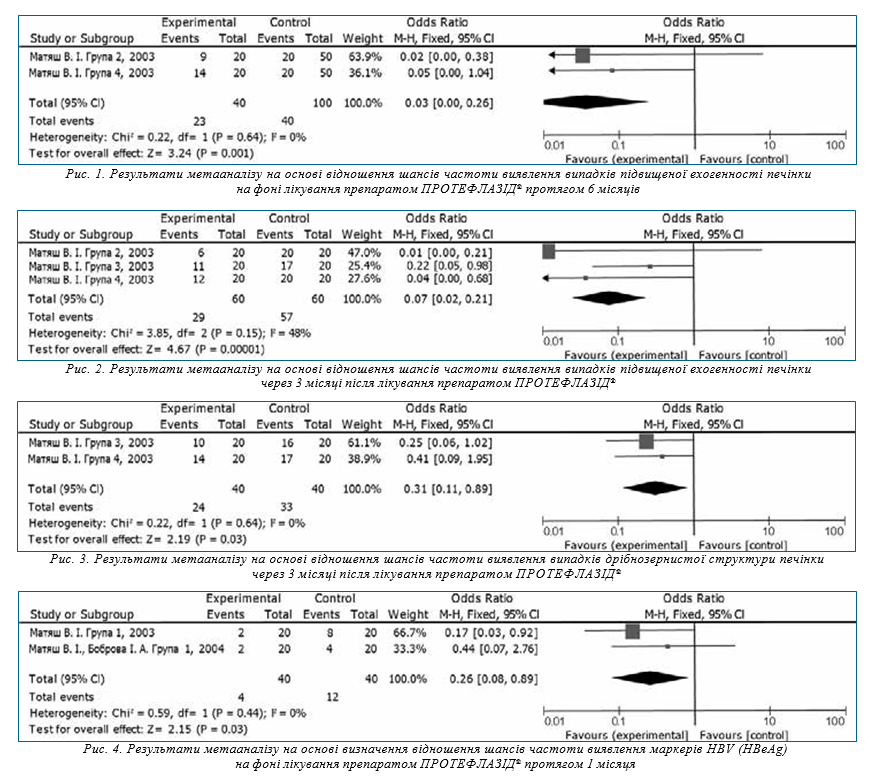
На рис. 2 зображено Forest plot результатів метааналізу на основі визначення відношення шансів частоти виявлення випадків підвищеної ехогенності печінки через 3 місяці після лікування препаратом ПРОТЕФЛАЗІД®.
Значення χ-квадрат критерію (Р=0,15) та I2-тесту (I2=48%) свідчать про однорідність даних досліджень, тому обрана модель з фіксованим ефектом. Значення критерію Фішера (Р=0,00001) демонструє значимість обраного ефекту.
Значення відношення шансів (OR=0,07) свідчить про те, що ймовірність частоти виявлення випадків підвищеної ехогенності печінки через 3 місяці після лікування препаратом ПРОТЕФЛАЗІД® у 14,3 раза нижча, ніж до лікування.
На рис. 3 зображено Forest plot результатів метааналізу на основі визначення відношення шансів частоти виявлення випадків дрібнозернистої структури печінки після 3 місяців лікування препаратом ПРОТЕФЛАЗІД®.
Значення χ-квадрат критерію (Р=0,64) та I2-тесту (I2=0%) свідчать про однорідність даних досліджень, тому обрана модель з фіксованим ефектом. Значення критерію Фішера (Р=0,03) демонструє значимість обраного ефекту.
Значення відношення шансів (OR=0,31) свідчить про те, що ймовірність частоти виявлення випадків дрібнозернистої структури печінки через 3 місяці після лікування препаратом ПРОТЕФЛАЗІД® у 3,2 раза нижча, ніж до лікування.
Найбільше значення має дослідження Матяша В. І. (2003), який вказує, що в групі 3 (20 пацієнтів з ГГВ — приймали препарат ПРОТЕФЛАЗІД® у поєднанні з плазмаферезом) після 3 місяців лікування спостерігалася нормалізація показників активності трансфераз, відсутність холестатичного синдрому, відновлення структури печінки, зменшення її зернистості [11].
Серологічні маркери вірусного гепатиту В.
На рис. 4 зображено Forest plot результатів метааналізу на основі визначення відношення шансів частоти виявлення випадків наявності маркерів НВV (НВеАg) на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 1 місяця.
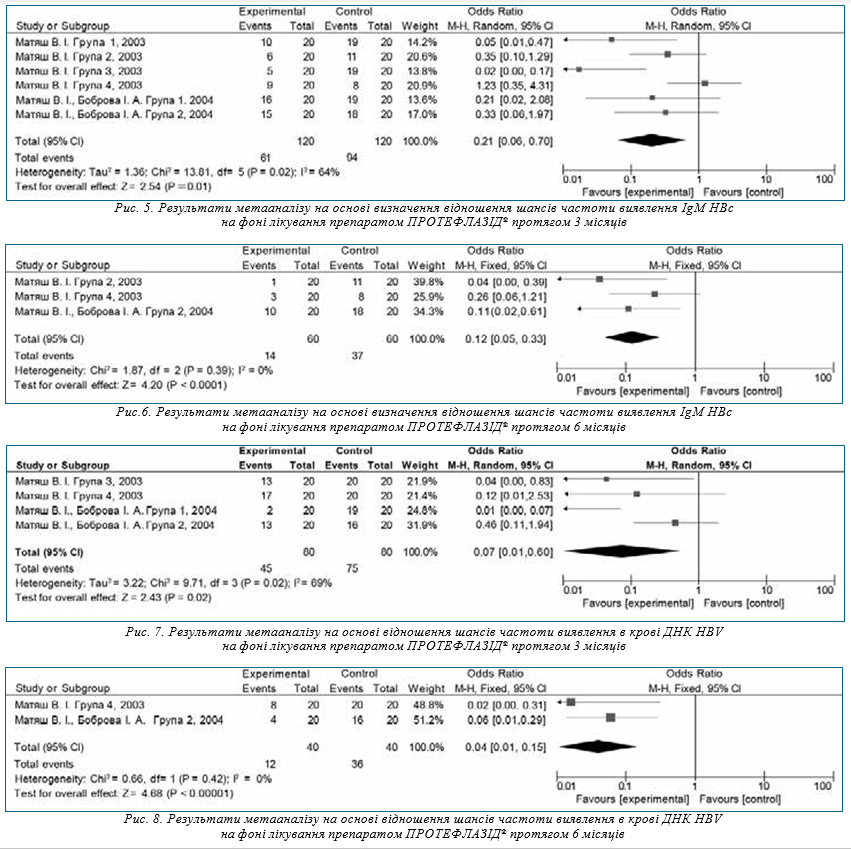
Значення χ-квадрат критерію (Р=0,44) та I2-тесту (I2=0%) свідчать про однорідність даних досліджень, тому обрана модель з фіксованим ефектом. Значення критерію Фішера (Р=0,03) демонструє значимість обраного ефекту.
Значення відношення шансів (OR=0,26) свідчить про те, що ймовірність виявлення маркерів НВV (НВеАg) на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 1 місяця в 3,8 раза нижча, ніж до лікування.
У дослідженні Матяша В. І. (2003) зазначається, що при застосуванні пацієнтами з ГГВ препарату ПРОТЕФЛАЗІД® протягом 1 місяця спостерігався позитивний терапевтичний ефект у 75% хворих, зокрема — зменшення холестатичного та цитолітичного синдромів, зменшення гепатота спленомегалії [11].
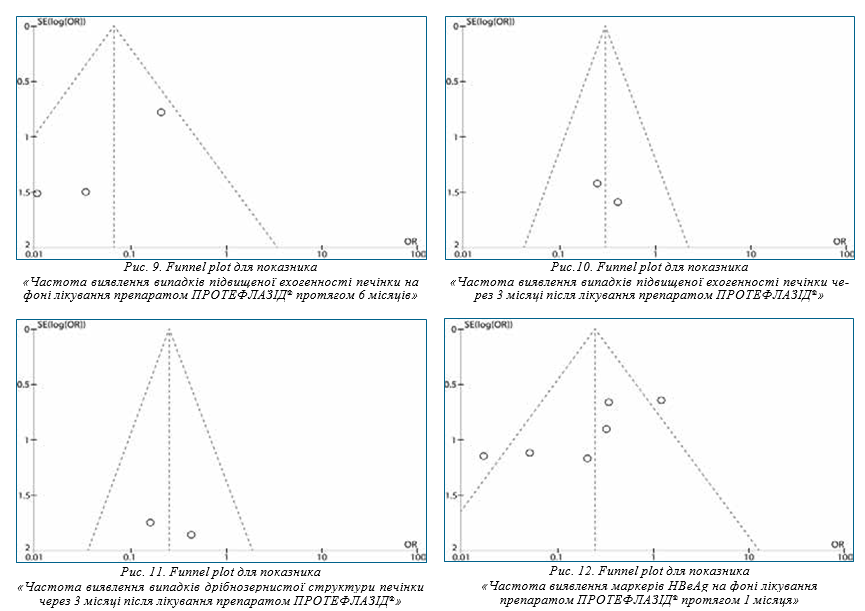
На рис. 5 зображено Forest plot результатів метааналізу на основі визначення відношення шансів частоти виявлення маркеру НВV-інфекції — IgM НВс на тлі лікування препаратом ПРОТЕФЛАЗІД® протягом 3 місяців.
Значення χ-квадрат критерію (Р=0,02) та I2-тесту (I2=64%) свідчать про однорідність даних досліджень, тому обрана модель з випадковим ефектом. Значення критерію Фішера (Р=0,01) демонструє значимість обраного ефекту.
Значення відношення шансів (OR=0,21) свідчить про те, що ймовірність виявлення IgM НВс на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 3 місяців у 4,8 раза нижча, ніж до лікування.
Після 3 місяців лікування препаратом ПРОТЕФЛАЗІД® кількість хворих з маркерами НВV-інфекції зменшилася на 25% [11].
На рис. 6 зображено Forest plot результатів метааналізу на основі визначення відношення шансів час-
тоти виявлення IgM НВс на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 6 місяців.
Значення χ-квадрат критерію (Р=0,39) та I2-тесту (I2=0%) свідчать про однорідність даних досліджень тому обрана модель з фіксованим ефектом. Значення критерію Фішера (Р=0,0001) демонструє значимість обраного ефекту.
Значення відношення шансів (OR=0,12) свідчить про те, що ймовірність частоти виявлення IgM НВс на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 6 місяців у 8,3 раза нижча, ніж до лікування.
Також у цьому дослідженні вказується, що застосування препарату ПРОТЕФЛАЗІД® протягом 6 місяців зумовлює регрес патологічного процесу в 90% випадків, відсутність антигенемії та вірусемії в крові 95% випадків [11].
На рис. 7 зображено Forest plot результатів метааналізу на основі відношення шансів частоти виявлення в крові ДНК НВV методом ПЛР на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 3 місяців.
Значення χ-квадрат критерію (Р=0,02) та I2-тесту (I2=69%) свідчать про однорідність даних досліджень, тому обрана модель з випадковим ефектом. Значення критерію Фішера (Р=0,02) демонструє значимість обраного ефекту.
Значення відношення шансів (OR=0,07) свідчить про те, що ймовірність частоти виявлення в крові ДНК НВV методом ПЛР на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 3 місяців у 14,3 раза нижча, ніж до лікування.
За даними дослідження Матяша В. І. та співав. (2004) [8], застосування препарату ПРОТЕФЛАЗІД® дозволило зменшити кількість хворих з маркерами НВV-інфекції на 25%.
На рис. 8 зображено Forest plot результатів метааналізу на основі відношення шансів частоти виявлення в крові ДНК НВV методом ПЛР на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 6 місяців.
Значення χ-квадрат критерію (Р=0,42) та I2-тесту (I2=0%) свідчать про однорідність даних досліджень, тому обрана модель з фіксованим ефектом. Значення критерію Фішера (Р=0,00001) демонструє значимість обраного ефекту.
Значення відношення шансів (OR=0,04) свідчить про те, що ймовірність частоти виявлення випадків наявності в крові ДНК НВV методом ПЛР на фоні лікування препаратом ПРОТЕФЛАЗІД® протягом 3 місяців у 25 разів нижча, ніж до лікування.
Дослідження Матяша В. І. та співав. (2004) вказують, що після 6-місячного курсу лікування препаратом ПРОТЕФЛАЗІД® спостерігався стійкий позитивний клінічний ефект з нормалізацією трансфераз у крові, зменшенням вірусемії у 85% хворих [8].
Аналіз чутливості було проведено таким способом, щоб оцінити вплив кожного окремого дослідження на об’єднані дані. Результати аналізу чутливості показали, що жодне окреме дослідження значно не вплинуло на об’єднані дані, що вказує на статистично надійні результати.
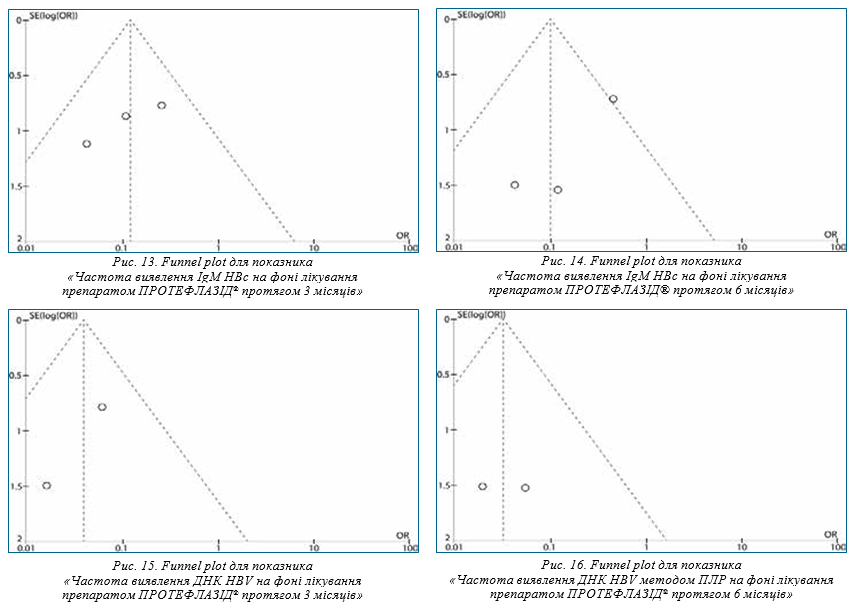
Funnel plot був використаний для оцінки необ’єктивності публікацій включених до дослідження (рис. 9–16). Майже всі значення ES на рис. 9–16 знаходяться у межах воронки, що свідчить про відсутність систематичної помилки.
Висновки
Статистичний аналіз дозволив збільшити доказову базу ефективності та безпеки застосування лікарського засобу ПРОТЕФЛАЗІД® при лікуванні вірусних гепатитів у дорослих пацієнтів.
При аналізі результатів 8 клінічних досліджень типу
«випадок-контроль», в яких прийняли участь 463 дорослих пацієнти (в період з 2000 по 2004 рік), встановлено, що завдяки терапії лікарським засобом ПРОТЕФЛАЗІД® у пацієнтів відзначається регрес цитолітичного та холестатичного синдромів, відновлення білковосинтетичної та гемостатичної функцій печінки, зменшення гепатота спленомегалії, відновлення структури печінки, зниження інтенсивності вірусної реплікації в крові.
Враховуючи хорошу переносимість, високий профіль безпеки, комплексну дію на багато ланок розвитку вірусних гепатитів, лікарський засіб ПРОТЕФЛАЗІД® (краплі) можна рекомендувати як ефективний та безпечний противірусний засіб для лікування вірусних гепатитів (В та С) у дорослих, оскільки доведено, що:
- білірубін загальний після 2 місяців лікування знаходиться в межах норми. Водночас спостерігається зменшення середнього значення білірубіну загального, яке є статистично значущим вже після 1 місяця лікування.
- АлАТ ц після 2 місяців лікування знаходиться в межах норми. Водночас спостерігається зменшення середнього значення АлАТ ц, яке є статистично значущим після 1 місяця лікування.
- АлАТ р після 1 місяця лікування знаходиться в межах норми. Відбувається зменшення середнього значення АлАТ р, яке є статистично значущим після 1 місяця лікування.
- АсАТ ц після 1 місяця лікування знаходиться в межах норми. Водночас спостерігається зменшення середнього значення АсАТ ц, яке є статистично значущим після 1 місяця лікування.
- АсАТ р після 1 місяця лікування знаходиться в межах норми. Водночас відбувається зменшення середнього значення АсАТ р, яке є статистично значущим після 1 місяця лікування.
- Білок загальний до та після 3 місяців лікування знаходиться в межах норми. Середнє значення цього показника у дорослих пацієнтів, які приймали ПРОТЕФЛАЗІД® 3 місяці, суттєво не відрізняється від середнього значення загального білка у дорослих пацієнтів до лікування.
- α1-глобуліни до та після 3 місяців лікування знахо-дяться в межах норми. Середнє значення цього показника у дорослих пацієнтів, які приймали ПРОТЕФЛАЗІД® 3 місяці, суттєво не відрізняється від середнього значення загального білка у дорослих пацієнтів до лікування.
- α2-глобуліни до та після 3 місяців лікування знаходяться в межах норми. Середнє значення цього показника у дорослих пацієнтів, які приймали ПРОТЕФЛАЗІД® 3 місяці, суттєво не відрізняється від середнього значення загального білка у дорослих пацієнтів до лікування.
- γ-глобуліни після 3 місяців лікування знаходяться в межах норми. Середнє значення цього показника у дорослих пацієнтів, які приймали ПРОТЕФЛАЗІД® 3 мі-
- сяці, суттєво не відрізняється від середнього значення загального білка у дорослих пацієнтів до лікування.
- Циркулюючі імунні комплекси до та після 3 місяців лікування перебувають у межах норми. Водночас спостерігається зменшення середнього значення рівня циркулюючих імунних комплексів, що є статистично значущим після 1 місяця лікування.
- Протромбіновий індекс після 3 місяців лікування перебуває у межах норми. Відбувається збільшення середнього значення протромбінового індексу, яке є статистично значущим після 2 місяців лікування.
- Розміри печінки після 3 місяців лікування значно зменшуються у розмірах.
- Розміри селезінки після 3 місяців лікування суттєво не зменшуються. Водночас спостерігається динаміка щодо зменшення розмірів селезінки.
- Ймовірність частоти виявлення випадків підвищеної ехогенності печінки (за даним УЗД) на фоні лікування протягом 6 місяців у 33,3 раза нижча, ніж до лікування.
- Ймовірність частоти виявлення випадків підвищеної ехогенності печінки (за даними УЗД) через 3 місяці після лікування у 14,3 раза нижча, ніж до лікування.
- Ймовірність частоти виявлення випадків дрібнозернистої структури печінки (за даними УЗД) через 3 місяці після лікування у 3,2 раза нижча, ніж до лікування.
- Ймовірність частоти виявлення випадків наявності маркерів НВV (НВеАg) на тлі лікування протягом 1 місяця в 3,8 раза нижча, ніж до лікування.
- Ймовірність частоти виявлення випадків наявності маркерів НВV (IgM НВс) на фоні лікування протягом 3 місяців у 4,8 раза нижча, ніж до лікування.
- Ймовірність частоти виявлення випадків наявності маркерів НВV (IgM НВс) на фоні лікування протягом 6 місяців у 8,3 раза нижча, ніж до лікування.
- Ймовірність частоти виявлення випадків наявності в крові ДНК НВV методом ПЛР на фоні лікування протягом 3 місяців у 14,3 раза нижча, ніж до лікування.
- Ймовірність частоти виявлення випадків наявності в крові ДНК НВV методом ПЛР на фоні лікування протягом 6 місяців в 25 разів нижча, ніж до лікування.
Література
- Михайлов В. С., Леснікова М. В., Ященко Л. А. Звіт про науково-дослідну роботу «Метааналіз результатів клінічних досліджень ефективності і безпеки застосування лікарського препарату ПРОТЕФЛАЗІД® при лікуванні вірусних гепатитів». ДС статистики України, ДП «НДІ статистичних досліджень», Київ, Україна. 2015. 104 с.
- Крючко Т. А., Несіна І. М.. Терапевтична ефективність противірусного препарату «ФЛАВОЗІД» у лікуванні хронічних гепатитів вірусної етіології у дітей. Сучасна педіатрія [Російська]. 2007; № 1 (14): 62–65. Режим доступу: https://ecopharm.ua/wp-content/uploads/2016/10/26-terapevticheskaya-effektivnost-protivovirusnogo-preparata-flavozid.pdf
- Крючко Т. А., Несіна І. М. Ефективність застосування Протефлазіду у комплексній терапії дітей з хронічним гепатитом В. Імунологія та алергологія. 2002; 4: 38–40. Режим доступу: https://ecopharm. ua/wp-content/uploads/2016/10/2-effektivnost-primeneniya-proteflazida-v-kompleksnoy-terapii-detey-s-hronicheskim-gepatitom-v.pdf
- Дикий Б. М., Пюрік В. Ф., Остяк Р. С., Копчак О. В., Будеркевич Л. І.. Застосування Протефлазіду у комплексному лікуванні хворих на гепатит В. Матеріали науково-практичної конференції та пленуму Асоціації інфекціоністів України «Керовані інфекції», 6–7 травня 2003 р. Івано-Франківськ. Режим доступу: http://aiddu.org.ua/ materiali-plenumiv-ta-konferentsiy/
- Нартов П. В., Волобуєва О. В.. ПРОТЕФЛАЗІД® у комплексному лікуванні хворих на гострий вірусний гепатит В. Збірник матеріалів НВК «Вірусні гепатити на практиці терапевта, сімейного лікаря та інфекціоніста. Сучасні методи діагностики та терапії». 11–12 березня 2003 р. Харків.
- Івахів О. Л., Андрійчин М. О., Вишневська Н. Ю., Борак В. П., Китай Г. П., Надав Л. С. Клінічна ефективність «Протефлазіду» та «Циклоферону» при хронічних гепатитах В та С. Матеріали науково-практичної конференції та пленуму Асоціації інфекціоністів України. — 5–6 травня 2004 року. Тернопіль. Режим доступу: https://ecopharm.ua/wp-content/uploads/2016/10/8-klinichna-efektivnist-proteflazidu-i-tsikloferonu.pdf
- Матяш В. І., Шевчук В. Б., Токунова Т. Л., Атаманюк В. П. Терапе-втична ефективність Протефлазіду при вірусних (С та В) гепатитах. Вісник Вінницького державного університету . 2002; 6 (2): 313–314.
- Матяш В. І., Боброва І. А., Шевчук В. Б., Власик Т. Л. Оцінка терапевтичної ефективності Протефлазіду при гострому та хронічному вірусному гепатиті В. Нова медицина. 2004; 6 (17): 1–6.
- Відкрите дослідження з вивчення ефективності та переносимості препарату Протефлазід виробництва ТОВ «НВК «Екофарм» у хворих на вірусні гепатити В та С (ІІ фаза) (Звіт з клінічного дослідження). Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського. К., 24 с.
- Матяш В. І., Боброва І. А., Шевчук В. Б., Токунова Т. Л., Рибалко С. Л., Атаманюк В. П. Фармакотерапевтичні механізми Протефлазіду при вірусних гепатитах. Проблеми епідеміології, діагностики, клініки, лікування та профілактика інфекційних хвороб. К. с. 381–384.
- Розробка нових методів етіопатогенетичної терапії вірусного гепатиту В та С, В та D (Звіт). Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського. К., 31 с.
Відомості про автора:
Матяш В. І. — д. мед. н., професор, Заслужений лікар України, ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України».
E-mail: vim10@ukr.net
Гриневич О. Й. — д. мед. н., Заслужений діяч науки і техніки України, Лауреат премії КМ України, заступник генерального директора ТОВ «НВК «Екофарм».
E-mail: grynevych@ecopharm.ua ORCID: 0000-0001-6542-8102
Ященко Л. О. — к. е. н., Старший науковий співробітник відділу економічних досліджень, Інститут продовольчих ресурсів НААН.
Е-mail: lud_ya@ukr.net
ORCID: 0000-0002-4893-8191
Information about the author:
Matyash V.I. — DSc (Medicine), Professor, Honored Doctor of Ukraine, SI “Institute of Epidemiology and Infectious Diseases named after L. V. Hromashevskyi NAMS of Ukraine”.
E-mail: vim10@ukr.net
Hrynevych O. Y. — DSc (Medicine), Honored Worker of Science and Technology of Ukraine, Laureate of the Prize of the CM of Ukraine, Deputy General Director of LLC “NVK “Ekofarm”.
E-mail: grynevych@ecopharm.ua ORCID: 0000-0001-6542-8102
Yashchenko L. O. — Doctor of Economics, Bachelor of Science Senior researcher of the Department of Economic Research Institute of Food Resources of the NAAS.
Е-mail: lud_ya@ukr.net
ORCID: 0000-0002-4893-8191
