Поширеність антитіл до Sars-Cov-2 у доепідемічний період Covid-19 серед уразливих груп населення в Україні

УДК:578.834:616-031.8+616-097(477)
DOI : https://doi.org/10.61948/prevmed-2024-2-14
О. В. Максименок, О. М. Кислих, Т. А. Сергеєва
ДУ «Інститут епідеміології та інфекційних хворобі ім. Л. В. Громашевського НАМН України», м. Київ
E-mail: maksimenok@gmail.com
Cерологічні дослідження, спрямовані на визначення антитіл до SARS-CoV-2 (АТ-SARS-CoV-2), на перших етапах пандемії стали дієвим інструментом оцінки інтенсивності епідемічного процесу COVID-19. Діагностикуми насамперед мали використовуватися в дослідженнях (переважно сероепідеміологічних) на популяційному рівні, а не для індивідуальної діагностики випадків COVID-19. Однак, для коректної оцінки поширеності АТ-SARS-CoV-2 в період епідемії доцільно оперувати вихідними даними щодо виявлення зазначених маркерів у доепідемічний період.
Тривалий час обговорювалось — чи є SARS-CoV-2 дійсно новим вірусом, чи він ще до пандемії циркулював у людській популяції. Зокрема, на думку деяких авторів, одним із питань, що потребує вирішення, є визначення того, коли SARS-CoV-2 почав поширюватися серед людей, оскільки зростаюча кількість різноманітних досліджень надає докази того, що вірус міг поширюватися по всьому світу тижнями або навіть місяцями до цього часу. На противагу, інші дослідники вважають, що позитивні результати виявлення АТ-SARS-CoV-2 до початку епідемії скоріше пов’язані з хибнопозитивними результатами тестів. Відтак, потрібно дослідити, чи містять зразки сироваток крові, зібрані до початку епідемії COVID-19, серологічні маркери SARS-CoV-2, що могло б свідчити, з одного боку, про приховану циркуляцію збудника інфекції задовго до початку епідемії, а з іншого, що видається більш ймовірним — про перехресну реактивність антитіл до різних коронавірусів, що частіше спостерігаються в осіб за різних патологічних станів, котрі супроводжуються компрометацією імунної системи.
Мета дослідження. Оцінити поширеність АТ-SARS-CoV-2 серед окремих груп населення України із скомпрометованою імунною відповіддю до початку епідемії COVID-19 та після її офіційного завершення.
Матеріали і методи.
Серологічну поширеність SARS-CoV-2 у ретроспективі досліджували у зразках 837 сироваток крові, у тому числі: 465 зразків, отриманих протягом 2010 р. від людей, які вживають ін’єкційні наркотики (ЛВІН), під час проведення дозорних досліджень методом незв’язаного анонімного тестування; 372 — анонімні зразки, отримані у 2009 р. від пацієнтів на системному гемодіалізі. Окрему панель сироваток склали 93 анонімні зразки від ВІЛ-позитивних осіб, отримані протягом 2024 року. Матеріали зберігалися у морозильній камері при температурі -20 °С і були розморожені безпосередньо перед проведенням тестування.
Визначення серологічних маркерів COVID-19 здійснювали методом ІФА із застосуванням тест-систем для виявлення антитіл класу IgG до нуклеокапсидного білка SARS-CoV-2 «DIA®-SARS-CoV-2-NP-IgG» (ПрАТ «НВК «ДІАПРОФ-МЕД», Україна).
Результати. У нашому дослідженні використовували зразки сироваток крові 465 ЛВІН, зібраних протягом 2010 року. Серед матеріалів, що досліджувались, 350 (75,3±2,0)% зразків отримано від чоловіків, 115 (24,7±2,0)% — від жінок. Середній вік обстежених складав (30,4±2,1) роки, найбільше представників ЛВІН входило до вікових груп 20–24 та 25–34 роки. При проведенні досліджень методом ІФА на наявність антитіл класу IgG до нуклеокапсидного протеїну SARS-CoV-2 було виявлено 17 (3,7±0,9%, 95% ДІ: 5,4–2,0) позитивних знахідок, серед них 13 (3,7%, 95% ДІ: 3,5–3,9) зразків було отримано від чоловіків, 4 (3,5%, 95% ДІ: 3,2–3,8) — від жінок. Достовірної різниці у частоті виявлення АТ-SARS-CoV-2 в осіб чоловічої та жіночої біологічної статі не було (t=0,09, p=0,93).
При обстеженні зразків сироваток крові 372 пацієнтів на гемодіалізі у 18 (4,8±1,1%, ДІ: 2,6–6,9) було виявлено АТ до нуклеокапсидного антигену SARS-CoV-2, при цьому достовірних розбіжностей між зафіксованим відсотком позитивних результатів та відсотком позитивних результатів у групі ЛВІН не зареєстровано (t=0,77, р=0,43). Серед зазначених 18 зразків сироваток крові, позитивних щодо АТ-SARS-CoV-2, 8 (44,4±11,7%) містили антитіла до HCV та corе-антигену (НВс) вірусу гепатиту В (HBV), два зразки — (11,1±7,4%) — HBsAg HBV. Серед 354 зразків, негативних щодо АТ-SARS-CoV-2, вказані маркери визначалися в меншій пропорції: антитіла до HCV зафіксовано у 100 зразках (28,2±2,4%), антитіла до HBc, HBsAg HBV — у 150 (42,4±2,6%) та 19 (5,4±1,2%) зразках відповідно, проте різниця між частотою виявлення маркерів в обох групах не була достовірною. Відносно невеликий відсоток позитивних результатів виявлення АТ-SARS-CoV-2 у ЛВІН та пацієнтів на гемодіалізі, на нашу думку, скоріше свідчить про перехресну реактивність з іншими коронавірусами, що також можна розцінювати як проксі-індикатор поширення коронавірусів у популяції.
Поширеність АТ-SARS-CoV-2 у ВІЛ-позитивних осіб очікувано виявилася значною — з-поміж 93 досліджених зразків 56 (60,2±5,1%) були позитивними, однак, порівняно з даними дослідження 2023 р., цей показник виявився достовірно нижчим (t=4,8, р<0,001). Можливо, отримана різниця у показниках виявлення АТ-SARS-CoV-2 пов’язана з відмінностями у період епідемії, а саме зі зниженням інтенсивності епідемічного процесу COVID-19 та не виключено елімінацію антитіл, які утворилися внаслідок проведеної раніше вакцинації.
Висновки. При обстеженні на наявність антитіл до SARS–CoV–2 зразків сироваток крові осіб зі скомпрометованою імунною системою, депонованих у 2009–2010 рр., кількість позитивних результатів становила 3,7% у людей, які вживають ін’єкційні наркотики, та 4,8% у пацієнтів, які отримували гемодіаліз. Такі пропорції частоти виявлення антитіл відповідають серопревалентності COVID-19 на початковому етапі епідемії. Не встановлено різниці у частоті виявлення антитіл до SARS-CoV-2 при дослідженні зразків сироваток крові пацієнтів на гемодіалізі залежно від HBV-/HCV-інфекції як можливих чинників хибнопозитивних результатів виявлення АТ-SARS-CoV-2. Серед ВІЛ-позитивних осіб, обстежених у 2024 р., серопревалентність COVID-19 становила 60,2%, що достовірно менше, ніж при обстеженні осіб з цієї уразливої групи у 2023 р. (85,9%). Визначений рівень серопревалентності АТ-SARS-CоV-2 у зразках сироваток людей, які вживають ін’єкційні наркотики та пацієнтів на гемодіалізі може розцінюватися як фоновий показник поширеності коронавірусів серед представників уразливих груп населення.
Ключові слова: серопревалентність, антитіла до SARS-CоV-2, уразливі групи населення.
V. Maksymenok, O. M. Kyslykh, T. A. Serheieva
PREVALENCE OF SARS-COV-2 ANTIBODIES BEFORE COVID-19 PANDEMIC AMONG VULNERABLE POPULATION GROUPS IN UKRAIN
Serological studies aimed at determining antibodies to SARS-CoV-2 (AВ-SARS-CoV-2) in the first stages of the pandemic became an effective tool for assessing the intensity of the epidemic process of COVID-19. Diagnostic kits were primarily intended to be used in studies (mainly sero-epidemiological) at the population level, and not for individual diagnosis of COVID-19 cases. However, for a correct assessment of the prevalence of AВ-SARS-CoV-2 during the epidemic period, it is advisable to operate with the initial data regarding the detection of the specified markers in the pre-epidemic period.
For a long time, it was discussed whether SARS-CoV-2 is really a new virus, or whether it was circulating in the human population even before the pandemic. Thus, according to some authors, one of the questions that needs to be solved is the determination of when SARS-CoV-2 began to spread among humans, since a growing number of different studies provide evidence that the virus could spread around the world for weeks or even months until now. In contrast, other researchers believe that the positive results of detection of AT-SARS- CoV-2 before the beginning of the epidemic are more likely to be related to false positive test results. Therefore, it was of interest to investigate whether blood serum samples collected before the beginning of the COVID-19 epidemic contain serological markers of SARS-CoV-2, which could indicate, on the one hand, the hidden circulation of the infectious agent long before the beginning of the epidemic, and on the other , which seems more likely about the cross-reactivity of antibodies to different coronaviruses, which are more often observed in people with various pathological conditions, accompanied by a compromise of the immune system.
The purpose of the study. To estimate the prevalence of AB-SARS-CoV-2 among certain population groups of Ukraine with a compromised immune response before the start of the COVID-19 epidemic and after its official end.
Materials and methods. The seroprevalence of SARS-CoV-2 was retrospectively studied in 837 blood serum samples, including: 465 samples obtained during 2010 from people who use injection drugs (IDUs) during sentinel studies by the unlinked method anonymous testing; 372 — anonymous samples obtained in 2009 from patients on systemic hemodialysis. A separate panel of sera consisted of 93 anonymous samples from HIV-positive individuals obtained during 2024. The materials were stored in a freezer at a temperature of -20 °C and were thawed immediately before testing.
Determination of serological markers of COVID-19 was carried out by the ELISA method using test systems for the detection of antibodies of the IgG class to the SARS-CoV-2 nucleocapsid protein «DIA®-SARS-CoV-2-NP-IgG» («DIAPROF-MED», Ukraine).
Results. In our study, we used blood serum samples of 465 IDUs collected during 2010. Among the materials studied, 350 (75.3±2.0)% of the samples were obtained from men, 115 (24.7±2.0)% from women The average age of the examinees was (30.4±2.1) years, the largest number of representatives of IDUs belonged to the age groups of 20–24 and 25–34 years. When carrying out studies using the ELISA method for the presence of IgG class antibodies to the nucleocapsid protein of SARS-CoV-2, 17 (3.7±0.9%, 95% CI: 5.4–2.0) positive findings were found, among them 13 ( 3.7%, 95% CI: 3.5–3.9) samples were obtained from men, 4 (3.5%, 95% CI: 3.2–3.8) — from women. There was no significant difference in the detection frequency of AT-SARS-CoV-2 in men and women (t=0.09, p=0.93).
During the examination of blood serum samples of 372 patients on hemodialysis, 18 (4.8±1.1%, CI: 2.6–6.9) were found to have antibodies to the SARS-CoV-2 nucleocapsid antigen, with significant differences between the recorded percentages positive results and the percentage of positive results in the IDUs group were not registered (t=0.77, p=0.43). Among the specified 18 blood serum samples positive for AB-SARS-CoV-2, 8 (44.4±11.7%) contained antibodies to HCV and the core antigen (HBc) of the hepatitis B virus (HBV), two samples — (11.1±7.4%) — HBV HBsAg. Among 354 samples negative for AB-SARS-CoV-2, the specified markers were determined in a smaller proportion: antibodies to HCV were recorded in 100 samples (28.2±2.4%), antibodies to HBc, HBsAg HBV — in 150 (42.4±2.6%) and 19 (5.4±1.2%) samples, respectively, but the difference between the frequency of detection of markers in both groups was not reliable. In our opinion, the relatively small percentage of positive results of detection of AB-SARS-CoV-2 in IDUs and patients on hemodialysis rather indicates cross-reactivity with other coronaviruses, which, in turn, can be considered as a proxy indicator of the spread of coronaviruses in the population.
The prevalence of AB-SARS-CoV-2 in HIV-positive persons was expected to be significant — out of 93 tested samples, 56 (60.2±5.1%) were positive, however, compared to the data of the 2023 study, this indicator turned out to be significantly lower (t=4.8, p<0.001). It is possible that the obtained difference in the detection rates of AB-SARS-CoV-2 is associated with differences in the period of the epidemic, namely with a decrease in the intensity of the epidemic process of COVID-19, and the elimination of antibodies that were formed as a result of earlier vaccination is not excluded.
Conclusions. When serum samples of people with a compromised immune system, deposited in 2009–2010, were tested for the presence of antibodies to SARS-CoV-2, the number of positive results was 3.7% in people who use injection drugs, and 4.8% in patients receiving hemodialysis. Such proportions of the antibodies frequency detection correspond to the seroprevalence of COVID-19 at the initial stage of the epidemic. No difference was found in the frequency of detection of antibodies to SARS-CoV-2 in the study of blood serum samples of patients on hemodialysis, depending on HBV-/HCV-infection as possible factors of false-positive results of detection of AB-SARS-CoV-2. Among HIV-positive persons examined in 2024, the seroprevalence of COVID-19 was 60.2%, which is significantly lower than when examining persons from this vulnerable group in 2023 (85.9%). The determined level of seroprevalence of AB-SARS-CoV-2 in serum samples of people who use injection drugs and patients on hemodialysis can be considered as a background indicator of the prevalence of coronaviruses among representatives of vulnerable population groups.
Key words: seroprevalence, antibodies to SARS-CoV-2, vulnerable population groups.
Cерологічні дослідження є важливим інструментом моніторингу епідемічного та інфекційного процесу, виявлення груп ризику та прогнозу-вання нових загроз, надають інформацію щодо поширеності специфічних маркерів інфікування як імунного профілю населення [1]. Такі дослідження, спрямовані на визначення антитіл до SARS-CoV-2 (АТ-SARS-CoV-2), на перших етапах пандемії стали дієвим інструментом оцінки інтенсивності епідемічного процесу COVID-19. Відповідно до основних положень документу Європейського центру з контролю і профілактики захворюваності із зауваженнями щодо використання тестів на АТ-SARS-CoV-2, діагностикуми насамперед мали використовуватися в дослідженнях (переважно сероепідеміологічних) на популяційному рівні, а не для індивідуальної діагностики випадків COVID-19 [2]. Однак, для коректної оцінки поширеності АТ-SARS-CoV-2 у період епідемії доцільно оперувати вихідними даними щодо виявлення зазначених маркерів у доепідемічний період.
Тривалий час обговорювалось — чи є SARS-CoV-2 дійсно новим вірусом, чи він ще до пандемії циркулював у людській популяції. Зокрема, на думку деяких авторів, одним із питань, що потребує вирішення, є визначення того, коли SARS-CoV-2 почав поширюватися серед людей. Хоча поточна, канонічно прийнята хронологічна гіпотеза, передбачає появу вірусу в м. Ухані (Китай) у листопаді або грудні 2019 р., зростаюча кількість різноманітних досліджень надає докази того, що вірус міг поширюватися по всьому світу за багато тижнів або навіть місяців до цього часу. Однак гіпотезу про ранню циркуляцію SARS-CoV-2 часто відкидають із упередженим скептицизмом, а експериментальні дослідження, які вказують на раннє походження збудника, приписують хибнопозитивним результатам тестів [3]. Частково гіпотезу щодо можливого раннього поширення вірусу підтверджують результати мета-аналізу щодо виявлення серологічних маркерів іншого коронавірусу — SARS-CoV — у безсимптомних осіб або груп населення із субклінічним перебігом гострих респіраторних вірусних інфекцій до епідемії 2003 року [4]. Хоча результати цього метааналізу свідчать про те, що SARS-CoV був новим вірусом у людей, котрий не мав ані близького попередника, ані антигенно спорідненого вірусу, і який викликав би принаймні невеликий ступінь перехресної реактивності у серологічних дослідженнях, розробки Zheng та колег [5] із сироватками 938 здорових дорослих мешканців Гонконгу, депонованими у 2001 р., виявили позитивну відповідь на наявність антитіл проти вірусу SARS-CoV людини або схожого на SARS-CoV вірусу тварин у 1,81% (у межах 95% довірчого інтервалу (95% ДІ): 1,06–2,89) зразків за результатами імуноферментного аналізу (ІФА), підтверджених тестами нейтралізації. Дослідники припустили, що вірус, який вразив «здорових» серопозитивних осіб, був антигенно ближчим до ізольованого тваринного SARS-CoV-подібного вірусу [6], ніж SARS-CoV людини, і що це може пояснювати безсимптомний перебіг хвороби в інфікованих осіб, у яких відбулася сероконверсія.
Інші дослідники вивчали поширеність АТ-SARS-CoV-2 до початку епідемії COVID-19 в Камеруні [7]. Методом ІФА для визначення імуноглобулінів G (IgG) та М (IgM) SARS-CoV-2 було обстежено 288 збережених зразків плазми (від 163 ВІЛ-позитивних та 125 ВІЛ-негативних осіб), зібраних у 2017–2018 роках. Загальна серопозитивність АТ-SARS-CoV-2 становила 13,5% (39/288), з яких 7,3% (21) були класу IgG, 7,3% (21) — IgM і 1,0% (3) IgG/IgM. Серопозитивність щодо SARS-CoV-2 становила 11,0% (18/163) серед ВІЛ-позитивних осіб проти 16,8% (21/125) серед ВІЛ-негативних відповідно (р=0,21). На думку авторів, перехресно реактивні антитіла до SARS-CoV-2 реєструвалися у мешканців Камеруну ще до початку епідемії COVID-19, що, в подальшому, могло сприяти послабленню тяжкості захворювання в тропічному кліматі країни. Частота виявлення АТ-SARS-CoV-2 була меншою в осіб з ВІЛ-інфекцією, зокрема з реплікацією ВІЛ та низьким рівнем CD4-клітин, а останній зі свого боку сприяв зменшенню кількості перехресно реактивних антитіл (незалежно від рівня вірусного навантаження ВІЛ).
Відтак, варто було дослідити, чи містять зразки сироваток крові, зібрані до початку епідемії COVID-19, серологічні маркери SARS-CoV-2, що могло б свідчити, з одного боку, про приховану циркуляцію збудника інфекції задовго до початку епідемії, а з іншого, що видається більш ймовірним — про перехресну реактивність антитіл до різних коронавірусів [8, 9], що частіше спостерігаються в осіб за різних патологічних станів, котрі супроводжуються компрометацією імунної системи [10]. Мета дослідження. Оцінити поширеність АТ-SARS-CoV-2 серед окремих груп населення України із скомпрометованою імунною відповіддю до початку епідемії COVID-19 та після її офіційного завершення.
Матеріали і методи.
Серологічну поширеність SARS-CoV-2 у ретроспективі досліджували у зразках 837 сироваток крові, у тому числі: 465 зразків, отриманих протягом 2010 р. від людей, які вживають ін’єкційні наркотики (ЛВІН), під час проведення дозорних досліджень методом незв’язаного анонімного тестування; 372 — анонімні зразки, отримані у 2009 р. від пацієнтів на системному гемодіалізі. Окрему панель сироваток склали 93 анонімні зразки від ВІЛ-позитивних осіб, отримані протягом 2024 р. Матеріали зберігалися у морозильній камері при температурі -20 °С і були розморожені безпосередньо перед проведенням тестування.
Визначення серологічних маркерів COVID-19 здійснювали методом ІФА із застосуванням тест-систем для виявлення антитіл класу IgG до нуклеокапсидного білку SARS-CoV-2 «DIA®-SARS-CoV-2-NP-IgG» (ПрАТ«НВК «ДІАПРОФ-МЕД», Україна).
Результати досліджень та їх обговорення.
Для дослідження обрали зразки сироваток крові осіб, імунна система яких була скомпрометована з тих або інших причин, відтак вони більш ймовірно, ніж здорові індивідууми, могли наражатися на ризик зараження збудниками інфекційних хвороб: ЛВІН, пацієнти на гемодіалізі та ВІЛ-позитивні особи.
Вибір ЛВІН як групи ризику зумовлений тим, що ця група осіб зазвичай найбільш уразлива до низки інфекцій із потенційно небезпечними для життя ускладненнями, такими як ВІЛ-інфекція, парентеральні вірусні гепатити, інфекції шкіри та м’яких тканин, легеневі інфекції, інфекційний ендокардит тощо [11], а, як відомо, легені та серцево-судинна система є основними мішенями для SARS-CoV-2. При введенні наркотиків ін’єкційним шляхом, організми з мікробіома шкіри можуть потрапляти в кровообіг, що зі свого боку може призвести до бактеріальних і грибкових інфекцій, таких як інфекційний ендокардит, епідуральний абсцес, інфекції шкіри та м’яких тканин, остеомієліт, бактеріємія та фунгемія, а також септичний артрит. Зокрема, за даними [12, 13], з 70 ЛВІН, у яких було виявлено принаймні один ідентифікований патоген, 13 (19%) мали полімікробну інфекцію. Найпоширенішими бактеріальними та грибковими збудниками були S. aureus (56; 80%); стрептококи (11; 16%); Candida spp. (4; 6%). Найпоширенішим патогеном, що передається через кров, виявився вірус гепатиту С (HCV) — 41 (37%) пацієнт мав поточну або попередню інфекцію, викликану зазначеним збудником; семеро (6%) мали ВІЛ-інфекцію в анамнезі, а четверо (4%) — вірусний гепатит В.
Що стосується пацієнтів на гемодіалізі, то інфекційні збудники є основною причиною захворюваності та другою за поширеністю причиною смерті осіб з цієї уразливої групи, і, за даними літератури, ризик смерті від інфекцій порівняно із загальною популяцією в них у 82 рази більший [14]. Вищий ризик інфікування різними збудниками пацієнтів, які отримують лікування гемодіалізом, пояснюють зокрема підвищеною чутливістю, оскільки уремія сприяє розвитку дефектів клітинного імунітету, функції нейтрофілів, активації комплементу тощо, а також наявністю супутніх хронічних хвороб. Крім того, пацієнти, які перебувають на гемодіалізі, потребують частої госпіталізації (кількість госпіталізованих хворих на гемодіалізі на 102% вища, ніж серед населення загалом) та хірургічного втручання, що збільшує ризик розвитку інфекцій, пов’язаних із наданням медичної допомоги [15]. З-поміж інфекційних ускладнень передусім розглядають інфекції кровотоку, і пацієнти на гемодіалізі мають вищі показники захворюваності та смертності від цих інфекцій порівняно із загальною популяцією, а щорічна смертність від сепсису, важкого ускладнення інфекцій кровотоку, в 50–100 разів вища, ніж у загальній популяції [16, 17]. На даний момент S. аureus зазвичай із стійкістю до метициліну, коагулазонегативні стафілококи та інші грампозитивні патогени вважаються найпоширенішими збудниками інфекцій кровотоку у таких пацієнтів [18], і зараженню сприяють пригнічений імунітет, потреба в судинному доступі для терапії гемодіалізом з подальшим порушенням шкірних бар’єрів і колонізацією шкіри зовнішніми мікроорганізмами [19]. З-поміж вірусних інфекцій, актуальних для пацієнтів на гемодіалізі, передусім розглядають гепатити В і С, а також, хоча і набагато рідше, ВІЛ-інфекцію [15]. У контексті COVID-19 та інших респіраторних інфекцій слід зазначити, що у пацієнтів, які перебувають на гемодіалізі, доволі часто діагностують пневмонію, яка має поганий прогноз і асоціюється зі смертністю від серцево-судинних захворювань [15].
У нашому дослідженні використовували зразки сироваток крові 465 ЛВІН, зібраних протягом 2010 року. Серед матеріалів, що досліджувались, 350 (75,3±2,0)% зразків отримано від чоловіків, 115 (24,7±2,0)% — від жінок. Середній вік обстежених складав (30,4±2,1) року (табл. 1), найбільше представників ЛВІН входило до вікових груп 20–24 та 25–34 роки.
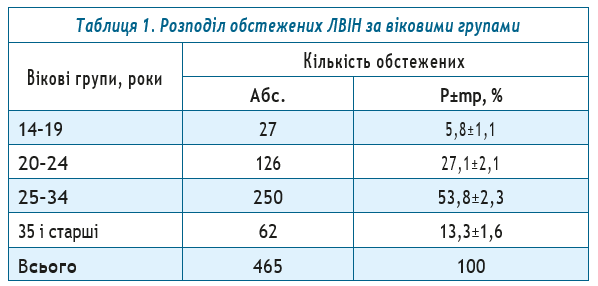
При проведенні досліджень методом ІФА на наявність антитіл класу IgG до нуклеокапсидного протеїну SARS-CoV-2 було виявлено 17 (3,7±0,9%, 95% ДІ: 5,4–2,0) позитивних знахідок, серед них 13 (3,7%, 95% ДІ: 3,5–3,9) зразків було отримано від чоловіків, 4 (3,5%, 95% ДІ: 3,2–3,8) — від жінок (рис. 1). Достовірної різниці у частоті виявлення АТ-SARS-CoV-2 в осіб чоловічої та жіночої біологічної статі не було (t=0,09, p=0,93).
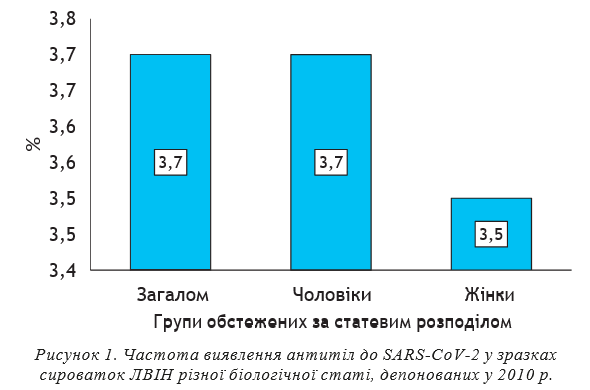
При обстеженні зразків сироваток крові 372 пацієнтів на гемодіалізі у 18 (4,8±1,1%, ДІ: 2,6–6,9) було виявлено АТ до нуклеокапсидного антигену SARS-CoV-2, при цьому достовірних розбіжностей між зафіксованим відсотком позитивних результатів та відсотком позитивних результатів у групі ЛВІН не зареєстровано (t=0,77, р=0,43).
Потрібно було дослідити, чи можуть позитивні знахідки щодо виявлення АТ-SARS-CoV-2 бути пов’язаними з наявністю серологічних маркерів збудників інших вірусних інфекцій, зазвичай притаманних хворим на гемодіалізі, насамперед гепатитів В і С. Серед 18 зразків сироваток крові, позитивних щодо АТ-SARS-CoV-2, 8 (44,4±11,7%) містили антитіла до HCV та corе-антигену (НВс) вірусу гепатиту В (HBV), два зразки — (11,1±7,4%) — HBsAg HBV (рис. 2).
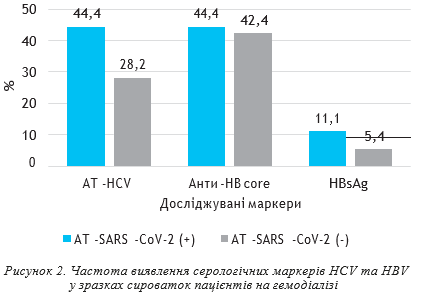
Натомість, серед 354 зразків, негативних щодо АТ-SARS-CoV-2, вказані маркери визначалися в меншій пропорції: антитіла до HCV зафіксовані у 100 зразках (28,2±2,4%), антитіла до HBc, HBsAg HBV — у 150 (42,4±2,6%) та 19 (5,4±1,2%) зразках відповідно, проте різниця між частотою виявлення маркерів в обох групах не була достовірною. Відтак, з певною обережністю можна стверджувати, що наявність серологічних маркерів інфікування HBV HCV у зразках сироваток крові пацієнтів на гемодіалізі не призводить до отримання хибнопозитивних результатів тестування при виявленні АТ-SARS-CoV-2.
Відносно невеликий відсоток позитивних результатів виявлення АТ-SARS-CoV-2 у ЛВІН та пацієнтів на гемодіалізі, на нашу думку, скоріше свідчить про перехресну реактивність з іншими коронавірусами, що можна розцінювати як проксі-індикатор поширення коронавірусів у популяції. Відмітимо, що наші дані кореспондуються з результатами досліджень щодо виявлення специфічних антитіл до SARS-CoV-2, проведених на початку епідемії навесні 2020 р. в Іспанії та Україні. Зокрема, за даними іспанських дослідників [20], у популяційному перехресному дослідженні, проведеному в Кантабрії з квітня по травень 2020 р., взяли участь 1 022 особи. Поширеність АТ-SARS-CoV-2 класу IgG у суб’єктів із дійсним результатом експрес-тесту становила 3,1% (95% ДІ: 2,2–4,4), подібно до результату щодо серопозитивності, отриманого за допомогою ІФА. За даними іншого дослідження, проведеного в Україні [21], було здійснено стратифіковане за віком крос-секційне вивчення серопревалентності COVID-19 серед умовно здорових осіб — мешканців Київської області за допомогою ІФА із зразками сироваток, зібраних протягом 10 червня — 2 липня 2020 р. З 732 учасників у 28 (11 чоловіків та 17 жінок віком від 19 до 77 років) були виявлені АТ-SARS-CoV-2 класу IgG, отже сукупна серопревалентність COVID-19 серед цієї групи склала 3,8% (95% ДІ: 3,78–3,88). У роботі міжнародної групи авторів [22], мета якої полягала в оцінці частоти хибнопозитивних результатів експрес-тестів для визначення антитіл класу IgG та IgM проти SARS-CoV-2, також були отримані близькі до наших результати при дослідженні двох сироваткових панелей від пацієнтів, госпіталізованих у Парижі (Франція) та Бангі (Центральноафриканська Республіка), депонованих до спалаху COVID-19 у 2019 році. Зокрема, виявлену реактивність IgG або IgM можна було спостерігати в 3,43% зразків усіх доепідемічних сироваток, і частота реактивності IgG/IgM була подібною як для європейської (3,20%), так і африканської (3,55%) панелей. У цій роботі, на відміну від «фонового рівня» або «перехресної реактивності», наголошується на ризику хибнопозитивної відповіді щодо антитіл IgG/IgM проти SARS-CoV-2, навіть при використанні тестів, які мають маркування CE.
Поширеність АТ-SARS-CoV-2 у ВІЛ-позитивних осіб очікувано виявилася значною — з-поміж 93 досліджених зразків 56 (60,2±5,1%) були позитивними, однак, порівняно з даними дослідження, проведеного нами раніше [23], цей показник виявився достовірно нижчим (t=4,8, р<0,001). У цитованому дослідженні наведені дані обстеження 481 особи протягом січня–березня 2023 р., при цьому виявлено 413 позитивних результатів (85,9±1,6%). Можливо, різниця у показниках виявлення АТ-SARS-CoV-2 у 2023 та 2024 рр. пов’язана відмінностями у періоді епідемії, а саме зі зниженням інтенсивності епідемічного процесу COVID-19 та не виключено елімінацію антитіл, які утворилися внаслідок проведеної раніше вакцинації.
Загалом дуже важко порівнювати наведені дані щодо серопревалентності COVID-19 серед ВІЛ-позитивних людей в Україні та в інших країнах, оскільки вони варіюють в дуже широких межах, залежать від стадії епідемії, вибірки (враховуючи ступінь імунної супресії, реконституції та вірусного контролю), застосовуваних діагностикумів тощо. Але у більшості публікацій наголошується на відсутності зв’язку між ВІЛ-статусом і сприйнятливістю до інфекції SARS-CoV-2, особливо в осіб з контрольованою ВІЛ-інфекцією [24].
Варто підкреслити, що, як за нашими попередніми даними [25], так і за результатами національного дослідження поширеності АТ-SARS-COV-2, яке здійснювалось силами ДУ «Центр Громадського здоров’я МОЗ України» (ЦГЗ) [https://www.phc.org.ua/news/ schonaymenshe-40-ukrainciv-mayut-antitila-do-sars-cov-2-pershi-rezultati-vseukrainskogo], серопревалентність COVID-19 достовірно збільшувалась з весни 2020 р. до літа 2021 р. і, за даними ЦГЗ, у цей період у 40,5% учасників дослідження вже було визначено антитіла класу IgG до одного з білків SARS-CoV-2 (RBD-домена S1-протеїну). Відтак, виявлений нами невисокий рівень антитіл АТ-SARS-COV-2 у зразках сироваток ЛВІН та пацієнтів на гемодіалізі, зібраних за 10 років та більше до початку епідемії COVID-19, на нашу думку, може розцінюватися як фоновий показник поширеності коронавірусів серед представників уразливих груп населення, зважаючи як на ймовірну перехресну реактивність антитіл до збудників цього сімейства вірусів, що активно обговорювалось у науковій літературі з початком епідемії [26], так і на можливість існування перехресно реагуючих епітопів Т-клітин (особливо CD4+) між SARS-CoV-2 та іншими «застудними» ко-
ронавірусами (common cold coronavirus: OC43, 229E, NL63, HKU1), ймовірно від попередніх сезонних інфекцій [27, 28]. Але не слід забувати і про можливість хибнопозитивної реактивності щодо АТ-SARS-COV-2, особливо при використанні експрес-тестів для серологічного скринінгу.
Висновки.
- При обстеженні на наявність антитіл до SARS-CoV-2 зразків сироваток крові осіб зі скомпрометованою імунною системою, депонованих у 2009–2010 рр., кількість позитивних результатів становила 3,7% у людей, які вживають ін’єкційні наркотики, та 4,8% у пацієнтів, які отримували гемодіаліз. Такі пропорції частоти виявлення антитіл відповідають серопревалентності COVID-19 на початковому етапі епідемії.
- Не встановлено різниці у частоті виявлення антитіл до SARS-CoV-2 при дослідженні зразків сироваток крові пацієнтів на гемодіалізі залежно від HBV-/ HCV-інфекції як можливих чинників хибнопозитивних результатів виявлення АТ-SARS-CoV-2.
- Серед ВІЛ-позитивних осіб, обстежених у 2024 р., серопревалентність COVID-19 становила 60,2%, що достовірно менше, ніж при обстеженні осіб з цієї уразливої групи у 2023 р. (85,9%).
- Визначений рівень серопревалентності АТ-SARS-COV-2 у зразках сироваток людей, які вживають ін’єкційні наркотики та пацієнтів на гемодіалізі може розцінюватися як фоновий показник поширеності коронавірусів серед представників уразливих груп населення.
Література
- Wilson E., Deeks S. L., Hatchette T. F., Crowcroft N. S. The role of seroepidemiology in the comprehensive surveillance of vaccine-preventable diseases. CMAJ. 2012 Jan 10;184(1):E70–6. doi: 10.1503/ cmaj.110506.
- European Centre for Diseasе Prevention and Control. Considerations for the use of antibody tests for SARSCoV-2 — first [Internet]. 10 Feb 2022. Stockholm: ECDC; 2021 [cited 2023, Oct 25]. Available from: https://www.ecdc.europa.eu/sites/default/files/documents/ Considerations-for-the-use-of-antibody-tests-for-SARS-CoV2-first-update.pdf
- Canuti , Bianchi S., Kolbl O. et al. Waiting for the truth: is reluctance in accepting an early origin hypothesis for SARS-CoV-2 delaying our understanding of viral emergence? BMJ Glob Health. 2022 Mar;7(3):e008386 [cited 2023 Oct 27]. Available from: https://gh.bmj. com/content/7/3/e008386.long. doi: 10.1136/bmjgh-2021-008386.
- Leung G. M., Donnelly C. A., Lim W. W. et al. Seroprevalence of IgG antibodies to SARS-coronavirus in asymptomatic or subclinical population groups. Epidemiol. Infect. 2006; 134:211–221. doi:10.1017/
- Zheng B. J., Wong K. H., Zhou J. et al. SARS-related virus predating SARS outbreak, Hong Emerg Infect Dis. 2004; 10: 176–178. doi: 10.3201/eid1002.030533.
- Guan Y., Zheng B. J., He Y. Q. et al. Isolation and characterization of viruses related to the SARS coronavirus from animals in southern Science. 2003; 302: 276–278. doi: 10.1126/science.1087139.
- Aissatou , Fokam J., Semengue E. N. J. et al. Pre-existing immunity to SARS-CoV-2 before the COVID-19 pandemic era in Cameroon: A comparative analysis according to HIV-status. Front Immunol. 2023; Mar 8;14:1155855. doi: 10.3389/fimmu.2023.1155855.
- Lv H., Wu N. C., Tsang O. T., Yuan M., Perera R. A. P. M., Leung W. S., So R. T. Y et al. Cross-reactive Antibody Response between SARS-CoV-2 and SARS-CoV Infections. Cell Rep. 2020 Jun 2;31(9):107725. doi: 1016/j.celrep.2020.107725.
- Kharlamova , Dunn N., Bedri S. K., Jerling S., Almgren M., Faustini F., Gunnarsson I. et al. False Positive Results in SARS-CoV-2 Serological Tests for Samples From Patients With Chronic Inflammatory Diseases. Front Immunol. 2021 May 3;12:666114. doi: 10.3389/fimmu.2021.666114.
- Liu W., Long X., Wan K., Yin M., Yin Y., Zhang B., Li L., Song Y. The endogenous factors affecting the detection of serum SARS-CoV-2 IgG/IgM antibodies by J Med Virol. 2022 May;94(5):1976–1982. doi: 10.1002/jmv.27557.
- Lavender W., McCarron B. Acute infections in intravenous drug users. Clin. Med. (Lond). 2013; 13(5):511–513. doi: 10.7861/ clinmedicine.13–5–511
- Levitt A., Mermin J., Jones C. M. et al. Infectious Diseases and Injection Drug Use: Public Health Burden and Response. J. Infect. 2020; 222 (Suppl. 5):S213–S217. doi: 10.1093/infdis/jiaa432.
- Hartnett K. P., Jackson K. A., Felsen C. et al. Bacterial and Fungal Infections in Persons Who Inject Drugs – Western New York, 2017. MMWR July 5, 2019; 68(26): 583–586. Available from: https:// www.cdc.gov/mmwr/volumes/68/wr/mm6826a2.htm.
- Vogelzang L., van Stralen K. J., Noordzij M., Diez J. A., Carrero J. J., Couchoud C., Dekker F. W. et al. Mortality from infections and malignancies in patients treated with renal replacement therapy: data from the ERA-EDTA registry. Nephrol Dial Transplant. 2015 Jun;30(6):1028-37. doi: 10.1093/ndt/gfv007. Epub 2015 Jan 29. PMID: 25637641.
- Nguyen D. B., Arduino M. J., Patel P. R. Hemodialysis-Associated Chronic Kidney Disease, Dialysis, and Transplantation. 2019:389–410.e8. doi: 10.1016/B978-0-323-52978-5.00025-2.
- Locham S., Naazie I., Canner J., Siracuse J., Al-Nouri O., Malas M. Incidence and risk factors of sepsis in hemodialysis patients in the United J Vasc Surg. 2021 Mar;73(3):1016–1021.e3. doi: 10.1016/j. jvs.2020.06.126,
- Shima , Okamoto T., Tashiro M., Inoue T., Masaki C., Tanaka Y., Tada H et al. Clinical Characteristics and Risk Factors for Mortality due to Bloodstream Infection of Unknown Origin in Hemodialysis Patients: A Single-Center, Retrospective Study. Blood Purif. 2021;50(2):238–245. doi: 10.1159/000510291.
- AbuTaha A., Al-Kharraz T., Belkebir S., Abu Taha A., Zyoud S. Patterns of microbial resistance in bloodstream infections of hemodialysis patients: a cross-sectional study from Palestine. Sci Rep. 2022 Oct 26;12(1):18003. doi: 10.1038/s41598-022-21979-7.
- Rteil , Kazma J. M., El Sawda J., Gharamti A., Koubar S. H., Kanafani A. Clinical characteristics, risk factors and microbiology of infections in patients receiving chronic hemodialysis. J Infect Public Health. 2020 Aug;13(8):1166–1171. doi: 10.1016/j.jiph.2020.01.314.
- Iruzubieta P., Fernández-Lanas T., Rasines L. Feasibility of large-scale population testing for SARS-CoV-2 detection by self-testing at Sci.Rep. 2021; 11:9819. doi: 10.1038/s41598-021-89236-x.
- Задорожна В. І., Сергеєва Т. А., Максименок О. В. та ін. Поширеність маркерів інфікування SARS-CoV-2 серед мешканців Київської області на початку епідемії COVID-19 в Україні — результати першого сероепідеміологічного дослідження. Журнал Національної академії медичних наук України. 2021;27(2):118–132. https:/ org/10.37621/JNAMSU-2021-2-6.
- Mboumba Bouassa R. S., Péré H., Tonen-Wolyec S., Longo J. D., Moussa , Mbopi-Keou F. X., Mossoro-Kpinde C. D. et al. Unexpected high frequency of unspecific reactivities by testing pre-epidemic blood specimens from Europe and Africa with SARS-CoV-2 IgG-IgM antibody rapid tests points to IgM as the Achilles heel. J Med Virol. 2021 Apr;93(4):2196–2203. doi: 10.1002/jmv.26628
- Шагінян В. Р., Фільчаков І. В., Сергеєва Т. А., Кислих О. М., Максименок О. В., Антоняк С. М., Мурашко О. В. COVID-19 і ВІЛ-інфекція. Імунологічна відповідь на вакцину та ефективність вакцинації. Превентивна медицина. Теорія і практика. 2023;3:6-11. Режим доступу: https://duieih.kiev.ua/documents/journal/03_2023.pdf.
- Höft M. A., Burgers W. A., Riou C. The immune response to SARS-CoV-2 in people with Cell Mol Immunol. 2024 Feb;21(2):184–196. doi: 10.1038/s41423-023-01087-w.
- Максименок О. В., Кислих О. М., Ватаманюк М. Ю. Серопревалентність COVID-19 за результатами скринінгового обстеження співробітників медичних установ НАМН УКРАЇНИ та м. Kиєва. Topical Issues of Modern Science, Society and Education Proceedings of VIII International Scientific and Practical Conference Kharkiv, Ukraine 26–28 February 2022:174–179.
- Chan J. F., Lau S. K., To K. K., Cheng V. C., Woo P. C., Yuen K. Y. Middle East respiratory syndrome coronavirus: another zoonotic betacoronavirus causing SARS-like disease. Clin Microbiol Rev. 2015; Apr;28(2):465–522. doi: 1128/CMR.00102-14.
- Mateus , Grifoni A., Tarke A., Sidney J., Ramirez S. I. et al. Selective and cross-reactive SARS-CoV-2 T cell epitopes in unexposed humans. Science. 2020; Oct 2;370(6512):89–94. doi: 10.1126/science.abd3871.
- Grifoni A., Weiskopf D., Ramirez S. I., Mateus J., Dan J. M. et al. Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Individuals. Cell. 2020 Jun 25;181(7):1489-1501.e15. doi: 1016/j.cell.2020.05.015.
Відомості про авторів:
Максименок О. В. — к. б. н., старший науковий співробітник лабораторії епідеміології інфекційних хвороб ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Грома- шевського НАМН України».
ORCID: 0009-0004-3566-2124
Кислих О. М. — науковий співробітник лабораторії епідеміології інфекційних хвороб ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН Укра- їни».
ORCID: 0009-0003-7387-2109
Сергеєва Т. А. — д. м. н., старший науковий співробітник, завідувач лабораторії епідеміології інфекційних хвороб ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України».
ORCID: 0000-0001-6488-4042
Information about the authors:
Maksymenok O. V. — Сandidate of Biological Sciences, senior researcher at the laboratory of epidemiology of infectious diseases, SI «The L. V. Hromashevskyi Institute of epidemiolo- gy and infectious diseases of NAMS of Ukraine».
ORCID: 0009-0004-3566-2124
Kyslykh O. M. — researcher at the laboratory of epidemiol- ogy of infectious diseases, SI «The L. V. Hromashevskyi In- stitute of epidemiology and infectious diseases of NAMS of Ukraine».
ORCID: 0009-0003-7387-2109
Serheieva T. A. — Doctor of Medicine, senior researcher, head of the laboratory of epidemiology of infectious diseases, SI «The L. V. Hromashevskyi Institute of epidemiology and in- fectious diseases of NAMS of Ukraine».
ORCID: 0000-0001-6488-4042
