Матеріали науково–практичної конференції «АКТУАЛЬНІ ІНФЕКЦІЙНІ ЗАХВОРЮВАННЯ. СУЧАСНІ АСПЕКТИ КЛІНІКИ, ДІАГНОСТИКИ, ЛІКУВАННЯ ТА ПРОФІЛАКТИКИ» 29–30 листопада 2023 року
DOI : https://doi.org/10.61948/prevmed-2024-1-44
VII ПАНДЕМІЙ,СПРИЧИНЕНИХ VIBRIO CHOLERAЕ
Буковинський державний медичний університет, м. Чернівці, Україна
Е-mail: margaritaassistent@gmail.com
М. О. Андрущак
Актуальність холери в Україні на сьогодні пов’язана з тим, що внаслідок війни в багатьох районах країни складаються умови, які сприяють виникненню спалаху хвороби. Сюди відносять руйнування системи водопостачання і каналізації, голод, неналежні гігієнічні умови в тимчасових поселеннях для внутрішньо переміщених осіб, антисанітарія в окопах військовослужбовців, особливо внаслідок безперервних бойових дій на окремих ділянках фронту, можливий колапс системи охорони здоров’я через значні руйнування цивільної інфраструктури, ймовірність використання холерного вібріона як біологічної зброї для здійснення диверсії. В 2021 році кількість нових випадків істотно зменшилася. Усього лише офіційно перехворіло 2,5 млн осіб, 4 000 — померло.
Мета. Провести та проаналізувати огляд літератури про пандемії, спричинені холерним вібріоном.
Матеріали та методи. Ретроспективний та проспективний огляд літератури відносно пандемій спричинених холерним вібріоном.
Результати та обговорення. Пандемія — 1817–1824 pp. Холера вперше вийшла за межі свого історичного осередку, поширилася на Непал, Південно-Східну Азію, у 1821–1822 Китай, Японію. Сумарні дані про кількість загиблих в цю пандемію невідомі. Дані про біовар збудника відсутні. II пандемія — 1826–1851 рр. Холера поширилася на схід від Індії — у Китай, Індокитай. У 1831 році досягла країн Центральної та Західної Європи [1]. У 1832 році французькі війська занесли її до Африки, а емігранти — до Південної Америки та Австралії. Незважаючи на прийняту американським урядом заборону кораблям з підозрою на холеру наближатися до США, холера проникла і сюди. В часи другої пандемії холера вперше потрапила до України. III пандемія — 1852–1860 рр. З мусульманськими паломниками з Індії потрапила в Персію, звідти на Близький Схід, чиї священні міста стали справжнім розсадником холери, а звідти холера уже розповсюдилась по всьому світу, включаючи обидві Америки. Збудник нарешті був вперше виявлений. IV пандемія — 1863–1875 рр. Завдяки будівництву Суецького каналу, холера проникла з Індії в Європу не за 2-3 роки, а за 2-3 тижні. На цей раз холера потрапила зі Стамбулу спершу в Одесу, а в 1866 р. вона вже реєструвалася по всій Україні [1, 3]. V пандемія — 1881–1896 рр. Холера стартувала з Каїру, Єгипет, і уже звідти поширилася по всьому світу, включаючи Індію, де в 1883 р. Роберт Кох виділив чисту культуру холери із трупа померлого і докладно описав збудника. Під час цієї пандемії наприкінці 1885 року холера досягла Галичини, центральних і східних земель України; відомо, що в Галичині та на Буковині від холери померло упродовж 1892–1894 рр. 2 300 осіб [2]. Тоді в Україні летальність від холери коливалася у межах 36,8–44,9% від всіх захворювань. У цей час видатні науковці, які мали українське походження, вивчали холеру. Загалом за XIX століття від холери, за різними оцінками, загинуло понад 10 млн жителів Землі, що становило приблизно 7% населення планети. VI пандемія 1899–1923 рр. Знову почалася з Індії, тривала довше інших і охопила всі континенти та країни, крім Антарктиди.
У 1905 році німецький бактеріолог Фелікс Готшліх на карантинній станції Ель–Тор Синайського півострова з кишечника прочан, що поверталися з Мекки і померли від діареї, виділив ще один вібріон, який і дістав свою назву від самої станції. Надалі, завдяки прийняттю міжнародних карантинних законів і заходів, холера вже набула характеру окремих заносів з Індії, які не отримали значного поширення в світі.
VII пандемія — 1961 р. і до нині. Спричинена біоваром Ель-Тор. Починаючи з кінця 1992 року повідомлялося про епідемію холери в Мадрасі та інших місцях Індії, Бангладеш. З цих місць мікроорганізм згодом поширився всією Індією, а спалахи або випадки захворювання були зареєстровані в Пакистані, Непалі, Китаї, Таїланді та Малайзії [1–3]. Завезені випадки були зареєстровані в США і Великій Британії. Якщо спалахи холери, викликані цією новою серогрупою, продовжуватимуть виникати в нових уражених країнах, це може означати сьому пандемію.
Висновок. ВООЗ вважає, що завдяки впровадженню програми з пропаганди, введенню неспецифічної профілактики та роботі санітарно-епідеміологічних служб країн світу вдасться зменшити захворюваність на холеру на 90% до 2030 року.
Література
- Oprea , Njamkepo E., Cristea D., Zhukova A., Clark C. G., Kravetz N. & Weill F. X. (2020). The seventh pandemic of cholera in Europe revisited by microbial genomics. Nature communications, 11(1), 5347.
- Balasubramanian , Murcia S., Ogbunugafor C. B., Gavilan R. & Almagro-Moreno S. (2021). Cholera dynamics: lessons from an epidemic. Journal of medical microbiology, 70(2), 001298.
- Kaur H., Garg S., Joshi H., Ayaz S., Sharma S. & Bhandari M. (2020). A review: Epidemics and pandemics in human history. International Journal of Pharma Research and Health Sciences, 8(2), 3139–3142.
ІНГАЛЯЦІЙНА ТА ШКІРНА ФОРМИ СИБІРКИ ЯК РЕЗУЛЬТАТ ЗАСТОСУВАННЯ БІОЛОГІЧНОЇ ЗБРОЇ
Буковинський державний медичний університет м. Чернівці, Україна
Е-mail: margaritaassistent@gmail.com
М. О. Андрущак
Актуальність проблеми. Жодна раціональна людина не може заперечувати руйнівний потенціал ядерної бомби як зброї масового ураження (ЗМУ). Однак сприйняття сибірської виразки як зброї масового знищення ще не сформувалося в нашому суспільстві та його інститутах.
Мета. Провести огляд та аналіз літератури, переглянути дані щодо біологічної зброї, а особливо звернути увагу на сибірку.
Матеріал та методи досліджень. Для дослідження теми було обрано сучасні публікації закордонних спеціалістів, у яких досліджувалася подібна проблематика.
Результати. Сибірка — це захворювання, яке викликається бактерією Bacillus anthracis. Ця бактерія існує в природі в двох формах: як активна зростаюча клітина, тобто вегетативна форма, або як спляча спора. Спори є дуже витривалими і стійкими до екстремальних температур, вологості та ультрафіолету. Вони можуть виживати тривалий час (навіть десятиліттями) у середовищі без поживних речовин або води [1].
Ризик біологічного та хімічного тероризму зростає відповідно до наявності сучасних біотехнологій та фінансових ресурсів. Найпотужнішою біологічною зброєю, згаданою в останнє десятиліття, є сибірка.
Спори Bacillus anthracis мають високу стійкість до тепла, тиску, ультрафіолетового та іонізуючого випромінювання, хімічних речовин і дезінфікуючих засобів. З цих причин спори B. anthracis є привабливим вибором як біологічні агенти для використання біологічної зброї та/або біотероризму.
Інгаляційна сибірка має інкубаційний період приблизно від 1 до 6 днів після контакту. Він проявляється неспецифічною продромальною фазою, включаючи лихоманку, нездужання, нудоту, блювання, біль у грудях і кашель. Другий етап розмноження бактерій слідує за цим у лімфатичних вузлах середостіння, що викликає геморагічний лімфаденіт і медіастиніт з подальшим прогресуванням до бактеріємії [2].
Шлунково-кишковий тракт може включати ротоглотку та/або кишечник. При орофарингеальній сибірці можуть розвинутися виразки на задній частині ротоглотки, що може спричинити дисфагію та регіонарну лімфаденопатію. При кишковій сибірській виразці у пацієнтів може підвищуватися температура, нудота, блювота та діарея.
Шкірна сибірка, яку також називають хворобою Хіде–Портера, може проявлятися від одного до 10 днів після контакту зі сверблячими та папульозними ураженнями, які протягом кількох днів можуть прогресувати до безболісної виразки [4]. Безболісність ураження вважається характерною для шкірної сибірки. Струп може висохнути та відшаровуватися приблизно через 1-2 тижні, але рівень смертності може досягати майже 20% без лікування [5].
В наш час інгаляційна сибірська виразка викликає занепокоєння, оскільки спори B. anthracis можуть використовуватися і дійсно використовувалися як біологічна зброя. Інгаляційна сибірська виразка може мати двофазний прояв, який починається як легка «вірусоподібна» хвороба з лихоманкою, кашлем і втомою, після чого через 2–3 дні раптово виникає важкий респіраторний дистрес, задишка та гіпоксія.
Ін’єкційна сибірська виразка є відносно новою формою, яка зустрічається виключно у споживачів наркотиків, які вживають ін’єкційний героїн, заражений спорами B. anthracis; на сьогоднішній день випадки виявлені лише в Європі [3]. Симптоми ін’єкційної сибірської виразки подібні до симптомів шкірної сибірської виразки, але зазвичай пов’язані з глибшою інфекцією тканин, що призводить до системного захворювання. Рівень смертності від ін’єкційної сибірської виразки становить близько 25%. Менінгіт може проявлятися або як первинна форма захворювання, або як вторинне ускладнення в 14–37% випадків, залежно від шляху передачі. Смертність перевищує 90%.
Біологічні агенти вважаються привабливою зброєю для біотероризму, оскільки їх легко отримати, вони порівняно недорогі у виробництві та демонструють більший страх і паніку, ніж фактичний потенціал фізичної шкоди [3].
Висновок. Незважаючи на поліпшення лікування, сибірка все ще залишається смертельною інфекцією. Первинна профілактика базується на попередженні наслідків та відкидає розробку такої зброї. Вторинна профілактика полягає в ранньому виявленні та своєчасному лікуванні захворювання. На жаль, засоби первинної та вторинної профілактики недосконалі.
Література
- Міхєєв А. О. & Вархомій П. Т. (2021). Біологічна зброя в сучасному світі: бактеріологічний аспект (огляд літератури). Editorial board,
- Бендас В. В., Стефак Я. П. & Мойсюк В. Д. (2018). Біологічна зброя третього покоління. Медико-біологічні аспекти застосування молекулярних патогенів. Клінічна та експериментальна патологія, (17,№ 2), 135–140.
- Гриневич О. Й., Маркович І. Г. & Маркович І. Ф. (2012). Роль моніторингу за інфекціями, спільними для людей і тварин, у забезпеченні біобезпеки населення України. Український медичний часопис, (5), 111–114.
- Bower A., Hendricks K. A., Vieira A. R., Traxler R. M., Weiner Z., Lynfield R. & Hoffmaster A. (2022). What is anthrax?. Pathogens, 11(6), 690.
- Kovalchuk V., Balaniuk I. V., Moskaliuk V. D. & Svekla A. I. (2023). Features of anthrax and plague as biological weapons. Colloquium-journal (No. 5 (164), pp. 18–20).
О. О. Білоконь, К. Ю. Литвин
ПЛЕЙОТРОПНІСТЬ ІНТЕРЛЕЙКІНУ-10 ПРИ КОРОНАВІРУСНІЙ ХВОРОБІ 2019
Дніпровський державний медичний університет, м. Дніпро, Україна
Е-mail: belokonalex1988@gmail.com
Вступ. Особливістю цитокінового шторму при коронавірусній хворобі 2019 (COVID-19) є підвищення рівня інтерлейкіну-10 (IЛ-10), який вже давно традиційно належить до протизапальних цитокінів. ІЛ-10 підвищується раніше, ніж IЛ-6 у пацієнтів з COVID-19 (Y. Zhao et al. 2020). ІЛ-10 є центральним негативним регулятором запалення, який контролює та пригнічує експресію прозапальних цитокінів на стадії реконвалесценції інфекцій, тим самим зменшуючи пошкодження, спричинене запальними цитокінами. Провідним моментом ІЛ-10 є його роль у контролі за формуванням противірусного імунітету, що особливо важливо для досліджень та розуміння всіх ланок патогенезу COVID-19.
Плейотропний ІЛ-10, який часто позначають як імуносупресивний, або протизапальний цитокін, може бути також імуноактивуючим і прозапальним інтерлейкіном при деяких аутоімунних захворюваннях і онкологічній патології (F. N. Lauw et al. 2000). Клінічне значення високої кількості IЛ-10 у сироватці крові пацієнтів з COVID-19 зазвичай розглядається як протизапальний, або імунний інгібіторний механізм, що стимулюється швидким накопиченням прозапальних цитокінів як ланка негативного зворотного зв’язку. Проте декілька ліній клінічних доказів, отриманих у дослідженнях на людях, свідчать про те, що раннє та різке підвищення рівня IЛ-10 при зараженні SARS-CoV-2 може натомість зіграти негативну патологічну роль у тяжкості перебігу COVID-19.
Мета роботи. Визначити у госпіталізованих пацієнтів з COVID-19 рівень інтерлейкіну-10 (ІЛ-10) та його зв‘язок з клініко-лабораторними показниками в гостру фазу хвороби.
Матеріали і методи. Досліджено 77 пацієнтів з коронавірусною хворобою віком від 29 до 87 років (середній вік — 59,3±12,4 року), серед яких було чоловіків — 43 (55,8%), жінок — 34 (44,2%). Обстеження проводилось на наступний день після госпіталізації. В середньому термін від початку захворювання складав 9,2±3,5 доби. Також було досліджено 17 відносно здорових донорів віком від 24 до 78 років (середній вік — 55,9±17,3 року), з них 8 (47,1%) чоловіків та 9 (52,9%) жінок. Обидві групи були статистично зіставними за віко-статевими характеристиками досліджених (р>0,05).
Діагноз COVID-19 верифікували методом ПЛР за виявленням РНК SARS-CoV-2 у назота орофарингеальному слизі. Визначення рівня інтерлейкіну-10 проводилось у сертифікованій лабораторії «Лікувально-діагностичний центр медичної академії» (м. Дніпро, Україна) за допомогою методу ІФА. Статистичну обробку результатів дослідження проводили з використанням пакету прикладних програм STATISTICA v.6.1 (StatSoft, США).
Результати. Встановлено, що стать та вік госпіталізованих пацієнтів з COVID-19 не вплинули на рівень ІЛ-10. Значне підвищення вмісту означеного цитокіну у пацієнтів було пов’язане з тяжкістю перебігу (rs=0,242, p=0,035) та летальним наслідком хвороби (rs=0,270, p=0,018), що свідчить про прозапальну активність означеного інтерлейкіну. Показник ІЛ-10 зростає при наявності супутніх захворювань в анамнезі (rs=0,271, p=0,018), серед яких найбільш вагомими є кардити (rs=0,226, p=0,049). Також, вміст інтерлейкіну-10 підвищується при коагулопатії (rs=0,249, p=0,030 та має чітку тенденцію до зростання при цукровому діабеті (rs=0,154, p=0,183) і підвищенні рівня в сироватці крові аланінамінотрансферази (rs=0,193, p=0,094).
Серед клінічних характеристик спостерігається тенденція до підвищення рівня ІЛ-10 у пацієнтів з наявністю таких респіраторних ознак, як кашель (rs=0,169, p=0,145), задишка (rs=0,195, p=0,091), збільшення частоти дихальних рухів (rs=0,189, p=0,102), а також при зниженні сатурації (rs=-0,268, р=0,019), тобто ознак, які свідчать про розвиток респіраторної недостатності та відображають тяжкість хвороби. Визначено прямий кореляційний зв’язок з кількісним показником артеріального тиску (rs=0,245, p=0,033), причому переважно в осіб, які не мали гіпертонічної хвороби в анамнезі. Виявлено прямий зв’язок між рівнями ІЛ-10 та фібриногену (rs=0,268, p=0,019), що на нашу думку, може мати маркерну цінність для раннього визначення ризику виникнення тромботичних ускладнень. Зворотний зв’язок виявлено з показниками рівня сатурації крові (rs=-0,268, p=0,019).
Висновок. Збільшення рівня сироваткового інтерлейкіну-10, яке спостерігається у пацієнтів з коронавірусною хворобою 2019 в гостру фазу захворювання на кшталт прозапальних цитокінів, відповідає тяжкості хвороби, підвищенню ризику летального наслідку, і таким способом свідчить про плейотропність означеного маркера.
Література
- Xu , Shi L., Wang Y., Zhang J., Huang L., Zhang C., Liu S., Zhao P., Liu H., Zhu L., Tai Y., Bai C., Gao T., Song J., Xia P., Dong J., Zhao J. & Wang
- S. (2020). Pathological findings of COVID-19 associated with acute respiratory distress syndrome. The Lancet. Respiratory medicine, 8(4), 420–422. https://doi.org/10.1016/S2213-2600(20)30076-X
- Ragab , Salah Eldin H., Taeimah M., Khattab R. & Salem R. (2020). The COVID-19 Cytokine Storm; What We Know So Far. Frontiers in immunology, 11, 1446. https://doi.org/10.3389/fimmu.2020.01446
- Cush S., Reynoso G. V., Kamenyeva O., Bennink J. R., Yewdell J.
- & Hickman H. D. (2016). Locally Produced IL-10 Limits Cutaneous Vaccinia Virus Spread. PLoS pathogens, 12(3), e1005493. https://doi. org/10.1371/journal.ppat.1005493
- Jiang L., Yao S., Huang S., Wright J., Braciale T. J. & Sun J. (2016). Type I IFN signaling facilitates the development of IL-10-producing effector CD8+ T cells during murine influenza virus European journal of immunology, 46(12), 2778–2788. https://doi. org/10.1002/eji.201646548
- Couper K. N., Blount D. G. & Riley E. M. (2008). IL-10: the master regulator of immunity to Journal of immunology (Baltimore, Md.: 1950), 180(9), 5771–5777. https://doi.org/10.4049/ jimmunol.180.9.5771
І. В. Будаєва1, О. Ю. Ляхова2, К. І. Гук2, С. Ю. Калашнікова3
ГОСТРА КИШКОВА ІНФЕКЦІЯ У ПІДЛІТКА, СПРИЧИНЕНА САЛЬМОНЕЛОЮ (S. ENTERITIDIS, СЕРОГРУПА D), В КОМБІНАЦІЇ З ІНФЕСТАЦІЄЮ ЛИЧИНКАМИ КОМАРІВ
1. Дніпровський державний медичний університет. м. Дніпро, Україна
2. КНП «МКЛ № 4 філія «Інфекційні хвороби» ДМР, м. Дніпро, Україна
3. КНП «Дніпровський центр первинної медико-санітарної допомоги №5»ДМР, м. Дніпро, Україна
Е-mail: irina.repushka@gmail.com
Вступ. Інфестація (від лат. infestare — нападати) — зараження людини або тварини паразитами (комахами, кліщами та іншими членистоногими). Інфестації входять до складу інвазивних паразитарних хвороб. Випадкове вживання в їжу живих личинок або яєць комах може спричинювати появу гострих гастритів та ентероколітів. Клінічні форми хвороби можуть бути безсимптомними або маніфестними з абдомінальним болем, нудотою, блюванням, діареєю, анальним свербежем або ректальною кровотечею. Симптоми хвороби зникають після повного звільнення організму від личинок [1]. Підтвердженням діагнозу є виявлення численних личинок в одному або декількох зразках фекалій або блювотних мас [2]. Частіше при кишкових інфестаціях проводиться консервативне лікування, вкрай рідко потрібна хірургічна допомога, наприклад, при приєднанні гострого апендициту або кишкової непрохідності.
Презентація випадку. Дитина В., 9 років (історія хвороби № 1957 від 08.05.22) поступила у 1-й день хвороби в середньотяжкому стані зі скаргами на слабкість, анорексію, задишку, сухий кашель, наявність набряків на обличчі, уртикарну екзантему на обличчі, тулубі, кінцівках, обструкцію носового дихання внаслідок набряку слизової оболонки, серозне виділення з носа.
Епідеміологічний анамнез: зі слів матері, в сім’ї вживають воду з глечика без кришки. Заміна води проводиться у міру її використання, але щодоби. Сім’я мешкає у 5-типоверховому будинку. В підвалі будинку влітку живуть виводки комарів.
Анамнез хвороби: дитина захворіла гостро, коли з’явилися представлені скарги. На 2-у добу підвищилася температура тіла до 38,7 °С, спостерігалися нудота, багаторазове блювання (до 10 разів на добу), анорексія, переймоподібний біль в животі, на 3-ю добу хвороби з’явилася водяниста діарея до 12 разів на добу, спостерігалася спрага, сухість шкіри, зниження діурезу.
Об’єктивний статус. Стан дитини — середньотяжкий. Свідомість ясна. Шкіра бліда, суха, тургор знижений. На обличчі, тулубі та кінцівках розташована свербляча уртикарна висипка від 1,5 до 5 см в діаметрі. Лімфовузли не збільшені. Обструкція носового дихання через набряк слизової оболонки. Дихання везикулярне, хрипів немає. ЧД — 28–30/хв. Тони серця ритмічні, приглушені. Живіт м’який, помірно здутий, болісний в епігастрії та мезогастрії. Симптомів подразнення черевини немає. Печінка та селезінка не збільшені. Зниження діурезу. Випорожнення водянисті, без патологічних домішок, із запахом ацетону. Блювання з домішками жовчі. В гемограмі: гемоглобін — 121 Г/л, еритроцити — 4,39 Т/л, лейкоцити — 27,5 Г/л, палочкоядерні нейтрофіли — 2%, сегментоядерні нейтрофіли — 44%, еозинофіли — 4%, лімфоцити — 40%, моноцити — 10%, ШОЕ-3 мм/год. Аналіз сечі: питома вага — 1030, білок — 0,33 г/л, лейкоцити — поодинокі, еритроцити — відсутні, кетонові тіла ++++. Копроцитограма: слиз відсутній, лейкоцити 10–30 у п/з, еритроцити відсутні. Бактеріологічне дослідження калу: культура S. enteritidis, сер. гр. D. В кожній порції блювотних мас виявлялися численні (до 10–15 в полі зору) мобільні личинки комарів чорного та чорно-червоного кольору — лялечки. Ідентифікація личинок комах у випорожненнях та блювотних масах проводилася за допомогою світлової мікроскопії після промивання та фіксації в 10% буферному розчині формаліну. Згідно з морфологічною номенклатурою, личинки комах були ідентифіковані: рід Culex третьої та четвертої линьки.
Остаточний клінічний діагноз: сальмонельоз (S. enteritidis D), гастроінтестинальна форма середньої тяжкості, ексикоз 1-2 ступеня, метаболічний кетоацидоз. Супутній діагноз: шлунково-кишкова інфестація личинками комара роду Culex. Набряк Квінке на обличчі. Гостра кропив’янка. Алергічний риніт.
Терапія: цефтриаксон, супрастин, цетиризин, альбендазол, лакто.
Тривале знаходження личинок комара у шлунково-кишковому тракті у дитини зумовило виражений ендогенний токсикоз, який тривав 7 діб та супроводжувався анорексією, інтенсивним абдомінальним болем. На 7-у добу хвороби після 3-денного закрепу здійснилося звільнення кишечника дитини від личинок комарів, дитина самостійно випорожнилася оформленим стулом, в якому виявлялися численні чорні, не живі личинки комарів. З цього дня з’явився апетит, зникли болі в животі, почалося одужання.
Особливості представленого випадку. 1. Комарина інфестація — рідкісна патологія серед людей, яка може спостерігатися у пацієнтів субурбанізованих та урбанізованих регіонів. 2. Інфестація личинками комара у дитини супроводжувалася такими алергічними проявами, як кропив’янка, алергічний риніт та набряк Квінке. 3. Шлунково-кишкова інвазія личинками комара виявилася симптомами гастроентериту з характерною клінічною картиною: нудота, блювання, абдомінальний біль, водяниста діарея, лихоманка. 4. Тривале знаходження личинок комара у шлунково-кишковому тракті у дитини зумовило виражений ендогенний токсикоз, який тривав 7 діб та супроводжувався анорексією, інтенсивним абдомінальним болем.
Література
- Francesconi F. and Lupi O. Myiasis. Clinical Microbiology Reviews, 2012: 25; 79–105.
- Vinogradova E. B. 2 // Culex pipiens pipiens mosquitoes: taxonomy, distribution, ecology, physiology, genetics, applied importance and control / Golovatch S. I.. — Bulgaria: «Pensoft», 2000: Т. II.; 239 с. — ISBN 954-642-103-0. (англ.)
С. В. Гозак1, О. Т. Єлізарова1, Т. В. Станкевич1, А. М. Парац1, Н. М. Дюба2
COVID-19 ЯК ФАКТОР ПОРУШЕННЯ АДАПТАЦІЇ ДІТЕЙ ПІД ЧАС КРИЗОВИХ ПОДІЙ
1. ДУ «Інститут громадського здоров’я ім. О. М. Марзєєва НАМН України», м. Київ, Україна
2. Броварський ліцей №9, м. Бровари, Україна
Е-mail: oelizarova1806@gmail.com
Вступ. Адаптивні процеси відбуваються протягом усього періоду онтогенезу і задовільна адаптація є необхідною передумовою росту та розвитку дитини [1]. Порушення адаптації призводить до ініціації негативних змін як ментального, так і фізичного здоров’я [2]. Пандемія COVID-19 стала чинником, що значуще вплинув на перебіг адаптаційних процесів внаслідок різкої зміни умов життєдіяльності, психологічного стресу, економічної кризи та впливу самого захворювання [3]. На цьому тлі початок повномасштабного воєнного вторгнення з його наслідками у вигляді бойових дій, ракетних обстрілів та вимушеної міграції поглибив вплив негативних факторів пандемії на усі верстви населення та особливо дітей і підлітків, які знаходяться у сенситивному до впливу зовнішніх чинників віці. Однак, сьогодні проведено недостатньо популяційних досліджень, які б вивчали вплив захворювання COVID-19 на адаптаційні можливості дітей та підлітків у постковідному періоді як під час пандемії, так і під час війни [4, 5]. Тому метою дослідження було оцінити віддалені наслідки перенесеної нової коронавірусної інфекції на адаптацію школярів під час кризових подій.
Матеріали та методи. Було проведено онлайн-анкетування батьків дітей 7–18 років у січні та квітні– травні 2021 та квітні–травні 2022 рр. (n=1 829; 51% хлопці) в усіх регіонах України. Вибірка формувалась за допомогою методу «снігової кулі». Інформована згода від батьків отримана. Середній вік респондентів становив 11,1±0,1 року. Застосовані опитувальники QRAPH, RCADS-P-25. Як маркери адаптації були вивчені особливості показників тривоги і депресії під час впровадження локдаунів та після початку повномасштабних бойових дій. Побудована регресійна модель з урахуванням типу кризової події (локдаун, війна), віку, статі, індексу маси тіла (ІМТ), наявності хронічних захворювань та COVID-19 в анамнезі (амбулаторне лікування). За допомогою стандартизованого β–коефіцієнту регресивної моделі визначено відношення шансів (OR) впливу COVID-19 на тривожні та депресивні прояви школярів.
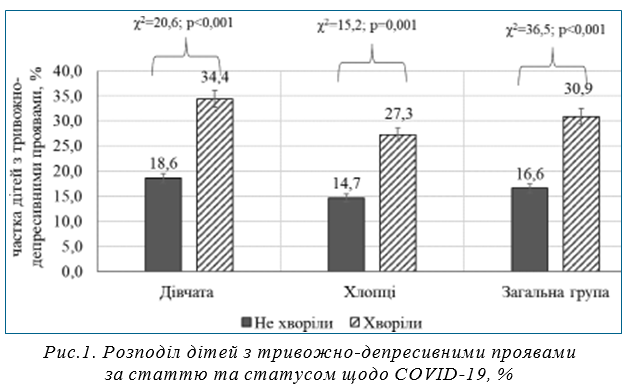
Результати. Частка дітей з межовими та клінічними тривожно-депресивними проявами становила 12,1±1,5% у 2021 р. і 23,1±1,3% у 2022 р. (p<0,001). Під час дослідження 2021 р. встановлено, що 15,9±1,6% дітей даної вибірки хворіли на COVID-19, а у 2022 році — 25,2±1,2% відповідно (p<0,001). У 2021 році серед респондентів з COVID-19 в анамнезі частка дітей з тривожно-депресивними проявами становила 19,2±4,6%, а серед дітей, що не хворіли — 10,8±1,5% (p<0,05), у 2022 р. відповідно 33,8±2,8% та 19,4±1,4% (p<0,001). На рис.1. представлено розподіл осіб з тривожно-депресивними ознаками за статтю та захворюваністю для всієї вибірки.

Встановлено, що найвищий рівень тривожно–депресивних проявів був визначений у тих дітей, які хворіли у період 6 місяців до анкетування. Зокрема, у школярів, які не хворіли на коронавірусне захворювання середній рівень показника становив 53,7±0,4 бала, у тих дітей, які хворіли у період 6 місяців до анкетування — 58,5±0,8 бала, а ті діти, що хворіли більше 6 місяців назад мали середній показник 49,2±2,5 бала (F=16,8; p<0,001). Проте ці результати потребують більш деталізованих подальших досліджень з урахуванням впливу різних ендота екзогенних факторів, що впливають на ментальне здоров’я, а також вивчення особливості пролонгованих наслідків COVID-19 після важких випадків, які потребували стаціонарного лікування.
Загалом у дітей, які перенесли COVID-19, шанси на розвиток тривожно-депресивних проявів під час кризових подій були вдвічі (OR=2,25; CI 1,72–2,95) вищими, ніж у дітей, які не хворіли, що свідчить про адаптивні порушення після перенесеної коронавірусної інфекції протягом тривалого часу після хвороби. Скориговані на вік, стать, ІМТ та наявність хронічних захворювань шанси розвитку ознак ментальних порушень все ще були значущими (OR=1,15; CI 1,09–1,20).
Висновки. Після перенесеного COVID-19 у дітей шкільного віку протягом 6 місяців спостерігається порушення адаптивних процесів з підвищенням шансів розвитку тривожно-депресивних проявів під впливом стресових чинників. Враховуючи схожість симптомів COVID-19 та інших ГРВІ, а також наслідки тривалого збереження тривожно-депресивних симптомів після COVID-19, необхідно проводити диференційну діагностику цих захворювань і спостерігати за пацієнтом після одужання тривалий період. Також нагальним є проведення моніторингу психічного стану дітей та підлітків та факторів, що потенційно можуть на нього впливати під час війни з урахуванням отриманих результатів.
Література
- Crespi B. The evolutionary biology of child health. Proceedings. Biological sciences. 2021. Vol. 278(1711). P.1441–1449. https://doi. org/10.1098/rspb.2010.2627
- Пророк Н., Царенко Л., Бойко С. Адаптація, дезадаптація, розлади адаптації: питання термінології. Грааль науки. Вип. 9. 2021. С.373–81, doi:10.36074/grail-of-science.22.10.2066.
- Samji , Wu J., Ladak A. еt al. Review: Mental health impacts of the COVID-19 pandemic on children and youth — a systematic review. Child and adolescent mental health. 2021. Vol. 27(2). P. 173–189. https://doi.org/10.1111/camh.12501
- Irani S., Chang C., Morrison L., Waselewski M., Chang, T. Youth experiences with and perspectives on long BMC public health. 2023. Vol. 23(1). P.2059. https://doi.org/10.1186/s12889-023-16899-8
- Gupta , Gupta N., Esang, M. Long COVID in Children and Adolescents. The primary care companion for CNS disorders. Vol. 24(2). 21r03218. https://doi.org/10.4088/PCC.21r03218
ВИКОРИСТАННЯ ОКРЕМИХ ПАРАКЛІНІЧНИХ ПОКАЗНИКІВ ДЛЯ РАННЬОЇ ДІАГНОСТИКИ ГОСТРИХ СТРЕПТОКОКОВИХ ТОНЗИЛОФАРИНГІТІВ У ДІТЕЙ
Буковинський державний медичний університет, м. Чернівці, Україна
Е-mail: horbatiuk.inna@bsmu.edu.ua
І. Б. Горбатюк
Неадекватна терапія гострих тонзилофарингітів (ГТФ) призводить до розвитку загрозливих для життя станів та хронізації процесу. Відомо, що розвитку ускладнень ГТФ сприяє невчасне або недоцільне призначення стартової етіотропної терапії [1-2]. Невідповідність антибіотикотерапії ГТФ збуднику, що його викликав, зумовлена труднощами, які виникають у клініцистів при ранньому виявленні етіологічного фактора захворювання [3-4].
Метою даного дослідження було вивчити діагностичне значення показників загального аналізу крові у верифікації гострих стрептококових тонзилофарингітів у дітей.
Матеріали та методи. Першу (I, основну) групу склали 10 дітей з діагнозом «стрептококовий гострий тонзилофарингіт». До другої (II) клінічної групи увійшло 16 пацієнтів з гострим тонзилофарингітом нестрептококової етіології. Стрептококова етіологія захворювання була підтверджена культуральним дослідженням мазка із зіва.
Результати дослідження. При оцінці результатів загального аналізу крові у хворих основної групи середній вміст сегментоядерних нейтрофілів був достовірно вищим у порівнянні з хворими групи контролю і склав 54,4±4,2% та 44,3±2,6% (р<0,05) відповідно. Водночас частка дітей І групи, у яких спостерігалося підвищення вмісту сегментоядерних лейкоцитів у крові понад 50,0%, становила 77,7±3,6%, а серед представників групи порівняння — 28,0±2,8% (р<0,05). При застосуванні визначення вмісту сегментоядерних нейтрофілів у периферичній крові дітей як тесту дозволяє верифікувати стрептококову природу ГТФ, його чутливість становила 77,7%, специфічність — 72%, передбачувана позитивна цінність — 73,5%, передбачувана негативна цінність — 76,4%, відносний ризик — 3,1 (95% ДІ 2,2–4,3), атрибутивний ризик — 0,49. При реєстрації цього показника у дітей із запальними явищами у ротоглотці ризик наявності стрептококового ГТФ збільшується майже в 9 разів (співвідношення шансів — 8, 9; 95% довірчий інтервал 4,7–17,0).
Висновки. Рівень сегментоядерних лейкоцитів крові понад 50,0% у хворого на гострий тонзилофарингіт є одним із ранніх діагностичних критеріїв стрептококової етіології захворювання.
Література
- American Academy of Pediatrics. Group A streptococcal infections. In: Red Book: 2021–2024 Report of the Committee on Infectious Diseases, 32nd ed, Kimberlin DW, Barnett ED, Lynfield R, Sawyer MH (Eds), American Academy of Pediatrics, Itasca, IL p. 694.
- Sauve , Forrester A. M., Top K. A. Group A. streptococcal pharyngitis: A practical guide to diagnosis and treatment. Paediatr Child Health 2021; 26:319.
- Shapiro J., Barak-Corren Y., Neuman M. I. et al. Identifying Patients at Lowest Risk for Streptococcal Pharyngitis: A National Validation Study. J Pediatr 2020; 220:132.
- Cohen J. F., Pauchard J. Y., Hjelm N. et al. Efficacy and safety of rapid tests to guide antibiotic prescriptions for sore Cochrane Database Syst Rev 2020; 6:CD012431.
І. Б. Горбатюк
ОСОБЛИВОСТІ ПЕРЕБІГУ COVID-19 У ПІДЛІТКІВ ЧЕРНІВЕЦЬКОЇ ОБЛАСТІ ВПРОДОВЖ 2020–2021 рр
Буковинський державний медичний університет, м. Чернівці, Україна
Е-mail: horbatiuk.inna@bsmu.edu.ua
Згідно з даними офіційної статистики, за весь період пандемії в Україні на COVID-19 захворіло 237 830 дітей. Найбільше підтверджених випадків захворювання серед дітей виявлено у віковій групі 10–14 років — понад 40%, іще 26% припадають на категорію 15–17 років [1-2]. Водночас слід відмітити, що сучасний перебіг захворювання у дітей змінився, а останні спостереження засвідчують розвиток критичних, загрозливих для життя станів у дитячому віці в межах 6–10% дітей, причому тяжкий перебіг захворювання частіше спостерігається у немовлят та дітей із наявною супутньою хронічною патологією [3–5]. Поряд із цим, досить обмеженими виявилися дані щодо особливостей перебігу інфекції COVID-19 у підлітковому віці.
Мета. Вивчити епідеміологічні та клінічні особливості коронавірусної хвороби COVID-19 у підлітків порівняно з молодшою віковою групою.
Матеріали і методи. Проведено одноцентрове ретроспективне відкрите когортне дослідження 188 пацієнтів віком до 18 років, госпіталізованих в інфекційні відділення Чернівецької обласної дитячої клінічної лікарні з підтвердженою респіраторною інфекцією, зумовленою SARS-CоV-2. Дану когорту пацієнтів розподілено на 2 клінічні групи. Першу групу (І) склали діти у віці від 12 до 18 років (43 дитини), до другої групи (ІІ) увійшли діти віком від 0 до 11 років (145 пацієнтів).
Результати. Частка підлітків серед госпіталізованих пацієнтів дитячої популяції складала 22,9%. При вивченні епідеміологічних особливостей коронавірусної інфекції у дітей Чернівецької області встановлено, що позитивний епідеміологічний контакт був у більш ніж половині випадків з превалюванням епідеміологічно значимих родинних контактів. Із збільшенням соціальної активності дітей у підлітків зменшується епідеміологічна роль родинних контактів та зростає значення невстановлених позародинних джерел інфекції (44,2%).
Для підлітків характерний більш виразний та тривалий інтоксикаційний синдром. Найбільша частка дітей з тяжким ступенем порушення загального стану внаслідок перебігу коронавірусної хвороби COVID-19 реєструвалась у групі підлітків, що може пояснюватись домінуванням у більшості хворих даної вікової групи ураження нижніх дихальних шляхів та розвитком пневмонії у 58,2% випадків у порівнянні з хворими ІІ групи, де частота пневмонії не перевищувала 23,9%, а частка пацієнтів з тяжким порушенням стану склала 16,4% у пацієнтів І групи та 6,9% у ІІ клінічній групі спостереження.
Висновки. Серед госпіталізованих з СOVID-19 пацієнтів дитячого віку частка підлітків складала 22,9%. В підлітковому віці зростає значення невстановлених позародинних джерел інфекції (44,2%). Частка дітей з тяжким ступенем порушення загального стану серед підлітків склала 16,4%, що зумовлено ураженням нижніх дихальних шляхів з розвитком пневмонії у 58,2% випадків.
Література
- https://moz.gov.ua/article/news/jak-zahistiti-ditej-vid-covid-19-poradi-batkam
- Alsohime , Temsah M. H., Al-Nemri A. M., Somily A. M., AlSubaiea COVID-19 infection prevalence in pediatric population: Etiology, clinical presentation, and outcome. J Inf Public Health 2020; 13(12): 1791-1796
- Cai , Xu J., Lin D., Yang Z., Xu L., Qu Z., Zhang Y., Zhang H., Jia R., Liu P., Wang X., Ge Y., Xia A., Tian H., Chang H., Wang C., Li J., Wang J., Zeng A Case Series of children with 2019 novel coronavirus infection: clinical and epidemiological features. Clin Infect Dis 2020; 28: 28
- Chen , Zhou M., Dong X., Qu J., Gong F., Han Y., Qiu Y., Wang J., Liu Y., Wei Y., Xia J., Yu T., Zhang X., Zhan L. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet 2020; 395: 507–513
- Cui , Zhao Z., Zhang T., Guo W., Guo W., Zheng J., Zhang J., Dong C., Na R., Zheng L., Li W., Liu Z., Ma J., Wang J., He S., Xu Y., Si P., Shen Y., Cai C. A systematic review and metaanalysis of children with coronavirus disease 2019 (COVID19). J Med Virol 2021; 93(2): 1057–1069
Я. О. Мусіна1, В. І. Трихліб1, А. Б. Щур2
ДЕЯКІ ЛАБОРАТОРНІ ПОКАЗНИКИ У ПОРАНЕНИХ ВІЙСЬКОВОСЛУЖБОВЦІВ, У ЯКИХ ПЕРЕБІГ УСКЛАДНИВСЯ РАНОВОЮ ІНФЕКЦІЄЮ
1. Українська військово-медична академія, м. Київ, Україна
2. Військово-медичний клінічний центр Центрального регіону, м. Вінниця, Україна
Е-mail: v.tryhleb@gmail.com
Актуальність. Лікувально-евакуаційні заходи та їх ефективність є основним вирішальним моментом для життя пораненого. У цій парадигмі гостро постає питання профілактики та лікування гнійних ускладнень, адже поранення, отримані під час бойових дій, апріорі є інфікованими [1]. Однак сучасна бойова травма має специфічну властивість, з особливим перебігом ранового каналу, який часто унеможливлює одномоментне виконання повної хірургічної обробки ран та видалення нежиттєздатних та забруднених тканин, що призводить до вторинних гнійних ускладнень [2]. Бойові мінно-вибухові поранення відрізняються тяжкістю уражень, поєднаними і поліорганними ураженнями, інфекційними ускладненнями, з більшою часткою летальних кінцевих результатів лікування [3]. Велика кількість етапів евакуації призводить до розповсюдження збудників, притаманних для кожного етапу евакуації на наступні, та це зі свого боку — до подальшого розвитку резистентності збудників до антибіотикотерапії. Тобто сучасні бойові поранення контамінуються спорідненими клональними популяціями, які мають єдине джерело походження, найбільш імовірно госпітальне [4, 5]. Це призводить до розвитку інфекційних ускладнень у поранених, розвитку сепсису, смерті, а також і до інвалідизації [6].
Мета роботи полягає в аналізі змін лабораторних даних у військовослужбовців з рановою інфекцією.
Матеріали і методи. Для з’ясування клініко-лабораторних проявів було проаналізовано дані з медичних карт стаціонарних хворих з наявними інфекційними ускладненнями поранення за період з 01.03.2022 р. до 31.12.2022 р., які перебували на стаціонарному лікуванні у військово-медичному клінічному центрі центрального регіону.
Результати. Важкість перебігу захворювання пацієнтів з рановою інфекцією, за даними опрацьованих медичних карт, залежить від локалізації та тяжкості бойової травми, розвинутих ускладнень, наявних збудників та їх характеристики. Характеристика збудників залежить від багатьох факторів, а саме: від місця поранення, умов поранення, тривалості лікування, кількості етапів евакуації та інших факторів. А від різновидів збудників та їх характеристики залежить вибір антибактеріальної терапії та клініко-лабораторні прояви, їх динаміка.
Середній термін ліжко/дня був Ме=13 днів (Q25=6,5, Q75=28), min=1, max=57 днів. Поранених із проникаючими пораненнями було 48 (92,3%) осіб, із непроникаючими — 5 (9,6%) осіб. Поранених у в/кінцівки було 5 (9,6%), у н/кінцівки — 20 (38,5%), у живіт — 16 (30,8%), у поперекову ділянку — 5 (9,6%), у грудну клітку — 20 (38,5%). Середній термін госпіталізації до центру від моменту поранення був Ме=7 днів (Q25=4, Q75=29,58), min=1, max=210 днів.
Основними скаргами пацієнтів під час госпіталізації були: біль у ділянці поранення, загальна слабкість, підвищення температури тіла до субфебрильних і фебрильних показників. Дані скарги мали всі пацієнти незалежно від локалізації поранення. Згідно з даними медичної документації та зі слів поранених, у 32 (61,5%) осіб до госпіталізації температура тіла була в нормі, у 17 (32,7%) осіб — субфебрильна, у 3 (5,8%) осіб — фебрильна. Середня температура при госпіталізації була Ме=36,9 °С (Q25=36,7, Q75=37,2), min=36,2 °С, max=38,5 °С.
Серед ускладнень основними були гемопневмоторакс, посттравматична пневмонія, пельвіоперитоніт та множинноуламкові переломи кінцівок. Найбільша кількість ускладнень розвивається у поранених у грудну клітку. Окрім пневмоторакса та пневмоній, були діагностовані плеврити, емфіземи та емпієми легень, медіастиніт.
Середня кількість етапів евакуації становить 3, середнє число днів від моменту поранення, до моменту госпіталізації становить 24 дні, а від моменту підозри на наявність ускладнення та виділення мікробіологічного збудника в рані становить 3 дні.
Основними збудниками, які виділялись у поранених із інфекційними ускладненнями були Klebsiella та Enterobacteriaceae. Частіше ці збудники виділялись у пацієнтів з інфекційними ускладненнями при пораненні у грудну клітку, трохи менше — з інфекційними ускладненнями при пораненнях у м’які тканини нижніх кінцівок. Серед збудників, які виділяли, також були St. haemolyticus, S. aureus та E. coli. Варто зазначити, що всі збудники, мали чутливість до певних груп антибактеріальних препаратів. У ході роботи оцінювались показники загального аналізу крові під час усього періоду госпіталізації. На початку лікування, після госпіталізації, в загальному аналізі крові (№1): середнє значення лейкоцитів дорівнювало Ме=10,85×109/л (Q25=8,65, Q75=13,3), min=4,7×109/л, max=26,9×109/л; ШОЕ — Ме=41 мм/год (Q25=25, Q75=56), min=3 мм/ год, max=67 мм/год; гранулоцитів — Ме=72% (Q25=66, Q75=79,5), min=50%, max=88%; лімфоцитів — Ме=22% (Q25=15, Q75=27), min=8%, max=43%. В умовній середині періоду лікування, в загальному аналізі крові №2: середнє значення лейкоцитів дорівнювало Ме=11,1×109/л (Q25=9,2, Q75=13,8), min=5,1×109/л, max=31,6×109/л; ШОЕМе=55 мм/год (Q25=28, Q75=60), min=6 мм/год, max=71 мм/год; гранулоцитів — Ме=74,5% (Q25=66, Q75=79), min=51%, max=87%; лімфоцитів — Ме=17% (Q25=12, Q75=24), min=9%, max=39%. Перед випискою/переведенням в інший лікувальний заклад у загальному аналізі крові №3: середнє значення лейкоцитів дорівнювало Ме=8,1×109/л (Q25=6,5, Q75=12), min=3,2×109/л, max=18,4×109/л; ШОЕ — Ме=34 мм/год (Q25=18, Q75=48), min=5 мм/год, max=66 мм/год; гранулоцитів — Ме=65% (Q25=60, Q75=73), min=36%, max=84%; лімфоцитів — Ме=27% (Q25=20, Q75=34), min=10%, max=50%.
У поранених, у яких були виділені збудники Enterobacteriaceae, динаміка показників загального аналізу крові була така. Аналіз №1: середнє значення лейкоцитів дорівнювало Ме=11,05×109/л (Q25=9, Q75=14,3), min=8,2×109/л, max=15,3×109/л; ШОЕ — Ме=35 мм/год (Q25=24, Q75=51), min=9 мм/год, max=67 мм/год; гранулоцитів — Ме=74% (Q25=66, Q75=79), min=51%, max=83%; лімфоцитів — Ме=19% (Q25=13, Q75=27), min=11%, max=41%. Аналіз №2: середнє значення лейкоцитів дорівнювало Ме=11,4×109/л (Q25=9,2 Q75=11,7), min=7,9×109/л, max=13,1×109/л; ШОЕ — Ме=28 мм/год (Q25=15, Q75=60), min=12 мм/год, max=68 мм/год; гранулоцитів — Ме=74% (Q25=57, Q75=79), min=52%, max=83%; лімфоцитів — Ме=19% (Q25=17, Q75=21), min=13%, max=29%. Аналіз №3: середнє значення лейкоцитів дорівнювало Ме=8,05×109/л (Q25=6,25, Q75=12,75), min=3,2×109/л, max=13,1×109/л; ШОЕ — Ме=32 мм/год (Q25=15,5, Q75=53), min=6 мм/год, max=66 мм/год; гранулоцитів — Ме=69% (Q25=61,5, Q75=73,5), min=60%, max=77%; лімфоцитів — Ме=22,5% (Q25=19, Q75=30), min=10%, max=31%.
У поранених, у яких були виділені збудники Klebsiella, динаміка показників загального аналізу крові була така. Аналіз №1: середнє значення лейкоцитів дорівнювало Ме=8,8×109/л (Q25=7, Q75=10,9), min=4,7×109/л, max=21,7×109/л; ШОЕ — Ме=33 мм/год (Q25=13, Q75=59), min=4 мм/год, max=65 мм/год; гранулоцитів — Ме=70% (Q25=64, Q75=74), min=50%, max=81%; лімфоцитів — Ме=23% (Q25=15, Q75=29), min=9%, max=43%. Аналіз №2: середнє значення лейкоцитів дорівнювало Ме=9,9×109/л (Q25=8,5 Q75=10,8), min=5,1×109/л, max=31,6×109/л; ШОЕ — Ме=53 мм/год (Q25=34, Q75=64), min=6 мм/год, max=71 мм/ год; гранулоцитів — Ме=73% (Q25=68, Q75=76), min=60%, max=82%; лімфоцитів — Ме=17% (Q25=15, Q75=24), min=9%, max=35%. Аналіз №3: середнє значення лейкоцитів дорівнювало Ме=6,7×109/л (Q25=6,3, Q75=9,2), min=3,7×109/л, max=15,3×109/л; ШОЕ — Ме=36 мм/год (Q25=25, Q75=55), min=5 мм/год, max=63 мм/год; гранулоцитів — Ме=65% (Q25=51, Q75=73), min=44%, max=79%; лімфоцитів — Ме=27% (Q25=23, Q75=41), min=12%, max=47%.
Середній вік поранених був Ме=36 років (Q25=26,5, Q75=45,5), min=21 рік, max=57 років. У поранених, у яких були виділені збудники Enterobacteriaceae, середній вік був Ме=30 років (Q25=28, Q75=41), min=21 рік, max=42 роки; ліжко/день склав — Ме=11,5 діб (Q25=6, Q75=24), min=1 доба, max=44 доби. У поранених, у яких були виділені збудники Klebsiella, середній вік був Ме=44 років (Q25=26, Q75=50), min=22 роки, max=57 років; ліжко/день склав — Ме=12 діб (Q25=5, Q75=27), min=3 доби, max=42 доби.
Висновок. Отримані дані лабораторних досліджень вказують на перевагу грам-негативної флори при розвитку інфекційних ускладнень бойової травми. В динаміці після госпіталізації в кінці тижня на початку другого тижня спостерігається збільшення рівня лейкоцитозу, гранулоцитозу, ШОЕ. Суттєвої різниці у динаміці показників загального аналізу крові у поранених, у яких виділяли Enterobacteriaceae, Klebsiella, не було. Середній вік поранених, у яких були виділені Enterobacteriaceae, був меншим порівняно із тими, у яких були виділені Klebsiella.
Література
- Фомін О. О., Фоміна Н. С., Ковальчук В. П., Асланян С. А. (2023). Мікрофлора сучасної бойової рани та її чутливість до антибіотиків. Частина І УКР. МЕД. ЧАСОПИС, 3 (155) — V/VI 2023. https://umj. ua/uk/publikatsia-244023-mikroflora-suchasnoyi-bojovoyi-rani-ta-yiyi-chutlivist-do-antibiotikiv-chastina-i
- Трутяк P., Філь А. Ю., Медзин В. І., Трутяк Р. І. Хірургічне лікування наслідків сучасної бойової травми. Травма. 2017. № 4. С. 58–62. doi: http://www.mif-ua.com/archive/article/45035
- Трихліб В. І., Дуда О. К, Майданюк В. П., Ткачук С. І., Завроцький О. І. Особливості вогнепальних і мінно-вибухових поранень (огляд літератури). Здоров’я суспільства. 2015. № 4(1–2). С. 48–58.
- Kondratiuk М. Assessment of resistance to antimicrobial agents of the strains Acinetobacter Baumanii and, Pseudomonas aeruginosa micronutrients and war wound limbs. Travma. 2017; 18 (1) :68–73.
- Kovalchuk P., Kondratiuk V. M. The dynamics of the microstructure of the icroflora of combat 55 ISSN 2072-9367. СУЧАСНI МЕДИЧНI ТЕХНОЛОГІЇ, № 3, 2019 (fire and mortar explosive) wounds of the limbs obtained during the antiterrorist operation in the East of Ukraine in 2014. Khirurgia Ukrainy. 2016; 2:13–18.
- Solovyov S. (2015). Генералізовані інфекційні ускладнення у постраждалих із політравмою. Шпитальна хірургія. Журнал імені Л. Я. Ковальчука, (4). https://doi.org/10.11603/1681-2778.2013.4.4470
Т. Є. Оніщенко, О. О. Фурик, Д. А. Задирака
КЛІНІКО-ЕПІДЕМІОЛОГІЧНА ХАРАКТЕРИСТИКА ЛЕПТОСПІРОЗУ В ЗАПОРІЗЬКІЙ ОБЛАСТІ
Запорізький державний медико-фармацевтичний університет, м. Запоріжжя, Україна
Е-mail: oneta_2017@ukr.net
Лептоспіроз як природно-осередкове захворювання продовжує залишатися актуальною епізоотологічною, епідеміологічною та екологічною проблемою, про що свідчить широке розповсюдження захворювання у світі та в Україні [1]. За оцінками експертів, щорічно у світі реєструється понад 1 млн хворих людей на лептоспіроз і майже 60 000 смертей [2, 3]. В Україні з початку 2023 року зареєстровано 141 випадок захворювань на лептоспіроз, натомість за аналогічний період 2022 року їх було лише 88 [4]. Вивчення цієї проблеми зумовлено високою захворюваністю на лептоспіроз, важким перебігом захворювання з розвитком тяжких ускладнень, а нерідко із летальними наслідками [5].
Мета дослідження — проаналізувати особливості перебігу лептоспірозу за матеріалами обласної клінічної інфекційної лікарні м. Запоріжжя.
Результати дослідження. Проаналізовано 125 історій хвороб хворих на лептоспіроз, віком від 18 до 65 років. Діагноз виставлявся на підставі даних епідеміологічного анамнезу, клінічних проявів захворювання та результатів серологічних досліджень (реакції мікроаглютинації). Серед хворих переважали чоловіки — 111 (88,8%) проти 14 (11,2%) жінок. Більшість хворих інфікувалося під час рибалки — 63 (50,4%), виконанні сільськогосподарських робіт — 21 (16,8%), купанні у водоймах — 19 (15,2%), у домашніх умовах при контакті з гризунами — 17 (13,6%), не встановлено місце інфікування у 5 (4%). Захворюваність на лептоспіроз реєструвалася переважно в літньоосінній період — 116 (92,8%) випадків, взимку реєструвалися спорадичні випадки — 9 (7,2%) при догляді за хворими собаками. У 105 (84%) хворих захворювання викликано L. icterohaemorragica, у 14 (11,2%) — L. сanicola. При аналізі тяжкості перебігу захворювання переважали тяжкі форми — 72 (57,6%), середньотяжкі відповідно становили 53 (42,4%). У хворих переважали жовтяничні форми лептоспірозу — 100 (80%), у більшості випадків з тяжким перебігом — 68 (68%). Летальність склала 9 (7,2%) хворих, серед яких чоловіків — 8 (89%), віком від 30 до 63 років.
Початок захворювання у всіх пацієнтів був гострим, з ознобом, підвищенням температури тіла до 39–40 °С, появою головного болю, слабкістю, болем в м’язах, у чверті хворих з ознаками herpes labialis. З 2-3 дня хвороби наростала слабкість, посилювалися міалгії, особливо у литкових м’язах. У третини хворих — на 5–7 день від початку захворювання розвинулися ознаки геморагічного синдрому: носові кровотечі та блювання «кавовою гущею» зі змінами в системі гемостазу. Поява жовтяниці відзначалася на 3–5 добу від початку захворювання, що супроводжувалося ознаками гепатоспленомегалії та лабораторно підтверджувалося гіпербілірубінемією у період розпалу всіх хворих на жовтяничні форми лептоспірозу.
Зміни у гемограмі характеризувалися нейтрофільним лейкоцитозом, зсувом лейкоцитарної формули вліво, анеозінофілією, лімфопенією, збільшенням ШОЕ до 50–60 мм/год. У всіх хворих у загальному аналізі сечі містилися лейкоцити, еритроцити, циліндри, а розвиток гострої ниркової недостатності супроводжувався підвищенням вмісту сечовини та креатиніну. У 10 (8%) хворих на лептоспіроз з 5–7 дня розвинувся менінгеальний синдром з посилення головного болю, появи блювоти, гіперестезій, позитивних менінгеальних знаків, змін у лікворограмі, при цьому нейтрофільний цитоз був у 5 (50%) хворих.
Щодо особливостей летальних випадків — всі пацієнти захворіли в літньо-осінній період, за 5–7 днів до захворювання мали прямий контакт з ендемічними на лептоспіроз водоймищами. Пацієнти прямували на госпіталізацію у день звернення по медичну допомогу (6-7 день захворювання), і лише один протягом 5 днів лікувався амбулаторно від гострого респіраторного захворювання. У всіх померлих хворих була виділена
Висновок. У Запорізькій області зберігається підвищений ризик інфікування на лептоспіроз; серед проаналізованих випадків переважали важкі жовтяничні форми захворювання, які найчастіше були викликані
Література
- Лептоспіроз: монографія / Васильєва Н. А., Андрейчин М. А. Тернопіль: ТДМУ, 276 с.
- Огороднійчук І. В. Епідеміологічні особливості лептоспірозу серед населення України та у військових колективах / Огороднійчук І. В., Сорока Н. М., Овчарук В. М. та ін. // Ukrainian journal of military medicine. — 2023. № 1 (v 4). С. 61–68.
- Haake A. Leptospirosis in human / Haake D. A., Levett P. N. // Curr. Top/Microbiol.Immunol. 2015. V.387. P. 65–97.
- Kravchuk A. Epizootolohoepidemiolohichni osoblyvosti leptospirozu v Ternopilskiy oblasti / Kravchuk Y. A., Vasylyeva N. A./ Annaly Mechnykovskoho instytutu. 2015. №2. S.165–171.
- Rajapakse S. Leptospirosis: clinical aspects / Clin Med (Lond). 2022. V. 1. Р. 14–17. doi: 10.7861/clinmed.2021-0784.PMID: 35078790
В. В. Печугіна, О. В. Усачова
ЗНАЧУЩІСТЬ РАННЬОГО НЕІНВАЗИВНОГО МАРКЕРУ ЗАПАЛЕННЯ КИШКІВНИКА ПРИ ІНФЕКЦІЙНИХ ДІАРЕЯХ У ДІТЕЙ
Запорізький державний медико-фармацевтичний університет, м. Запоріжжя, Україна
E-mail: kdibzsmu@gmail.com
Вступ. Інфекційні діарейні захворювання продовжують займати особливе місце у структурі захворюваності дітей як в Україні, так і в усьому світі, викликаючи тяжкий діарейний синдром. Багато робіт присвячено диференційній діагностиці секреторної та інвазивної діареї [3]. На сьогоднішній день актуальні дослідження, які показують, що дійсно є різниця між кількісним вмістом фекального кальпротектину та лактоферину у фекаліях дітей з кишковою інфекцією різної етіології. Літературні джерела вказують на те, що це можна використовувати як рутинний тест диференційної діагностики, а це перспективно для подальшого дослідження в клінічній практиці, особливо в педіатрії [1, 2]. Водночас таких робіт в Україні мало.
Тому метою роботи стало: дослідили значущість ранніх неінвазивних діагностичних біомаркерів кальпротектину та лактоферину калу якісним методом, для оцінки виразності запального процесу в кишківнику при інфекційних діареях різної етіології у дітей раннього віку.
Матеріали та методи. Нами було проведено обстеження 60 дітей віком від 0 до 3 років, з проявами інфекційної діареї, які перебували на стаціонарному лікуванні у Запорізькій обласній інфекційній клінічній лікарні. Діти були розподілені на дві групи: перша — 36 пацієнтів з вірусною діареєю, друга — 24 дитини з бактеріальною. Етіологічне розшифрування проведено на підставі даних анамнезу, скарг батьків, суб’єктивних та об’єктивних симптомів, результатів імунохроматографічного тесту CITO TEST ROTA, NORA, ASTRO. Бактеріальна етіологія була підтверджена бактеріологічним дослідженням випорожнень на кишкову патогенну групу та групу умовно-патогених мікроорганізмів (УПМ). Фекальний кальпротектин та лактоферин визначено імунохроматогрифічним експрес-тестом калу. Усі дослідження проводились з інформованої письмової згоди батьків дітей.
Результати. При обстежені дітей, хворих на гостру кишкову інфекцію було виявлено, що серед пацієнтів із вірусною діареєю (перша група) 19 (52%) мали ротавірусну етіологію захворювання, 10 (28%) пацієнтів — норавірусну, 5 (14%) — нора+ротавірусну, 2 (6%) — рота+астровірусну. Отже, у переважної більшості хворих першої групи (26 дітей — 72%) виділяли з калу ротавірус або як монопатоген, або у сполученні з іншими вірусами. В загальній же групі (60 хворих) ротавірус, як значимий етіологічний збудник, виявлено у 38,3% випадків, що відповідає багатьом сучасним дослідженням в різних країнах світу.
Серед пацієнтів із «вірусною діареєю» на початку хвороби 32 (89%) мали позитивний результат на фекальний кальпротектин, а лише 4 (11%) — негативний. У 15 (42%) пацієнтів цієї групи було виявлено наявність лактоферину у калі, а ось у 21 (58%) дитини результат був негативним.
У пацієнтів другої групи з проявами інвазивної діареї, за результатами бактеріологічного дослідження калу, у 4 (17%) діагностовано кампілобактеріоз, у 2 (8%) — сальмонельоз, у 3 (13%) — ешерихіоз та у 15 (62%) виділено бактерії родини умовно-патогенної флори в кількості понад 105 колонієутворюючих одиниць у грамі. В цій групі у 21 (87,5%) дитини було зафіксовано позитивний кальпротектин калу і тільки у 3 (12,5%) — негативний. Щодо фекального латоферину, то у кожного другого — 14 (58,3%) пацієнтів — він виявився позитивним, а у 10 (41,7%) — негативним.
Проведений статистичний аналіз достовірності різниці наявності позитивного результату виявлення кальпротектину та лактоферину в калі в групах порівняння показав, що якісна оцінка цього показнику як щодо кальпротектину (р=0,58), так і лактоферину (р=0,15) не має відмінностей залежно від етіологічного чинника — чи вірусного, чи бактеріального.
Висновки.
- Ротавіруси продовжують посідати перше місце серед збудників інфекційних діарей у дітей раннього віку, як в загальній групі, так і серед вірусних діарейних захворювань.
- Визначення фекального кальпротектину та лактоферину якісним методом не може бути рекомендованим для ранньої диференційної діагностики вірусних та бактеріальних діарей.
Література
- Chen C. C., Huang J. L., Chang C. J. & Kong M. S. (2012). Fecal calprotectin as a correlative marker in clinical severity of infectious diarrhea and usefulness in evaluating bacterial or viral pathogens in Journal of pediatric gastroenterology and nutrition, 55(5), 541–547. https://doi.org/10.1097/ MPG.0b013e318262a718
- Cisarо , Pizzol A., Rigazio C. & Calvo P. L. (2020). Fecal calprotectin in the pediatric population: a 2020 update. Minerva pediatrica, 72(6), 514–522. https://doi.org/10.23736/ S0026-4946.20.06002-8
- Hardis , Johansen S. B., Eriksen J., Damgaard K., Leutscher P.C. & Jepsen S. (2022). Fecal calprotectin as a biomarker of intestinal inflammation in ICU patients with diarrhea — testing the pipette method against the collection pin and weighing methods. Scandinavian journal of clinical and laboratory investigation, 82(6), 504–507. https://doi.org/10.1080/0036551 3.2022.2107567
М. В. Погуляй1, В. І. Трихліб1, А. Б. Щур2
НЕГОСПІТАЛЬНА ПНЕВМОНІЯ ТЯЖКОГО ТА СЕРЕДНЬОТЯЖКОГО ПЕРЕБІГУ У ВІЙСЬКОВОСЛУЖБОВЦІВ
1. Українська військово-медична академія, м. Київ, Україна
2. Військово-медичний клінічний центр Центрального регіону, м. Вінниця, Україна
Е-mail: v.tryhleb@gmail.com
Актуальність. Під час воєнних дій військовослужбовці наражаються на численні фактори ризику, що сприяють розвитку пневмонії. Екстремальні умови життя та бойові дії створюють ризики для поширення різних мікроорганізмів, зокрема, бактерій, вірусів та грибків. Стрес і втома, нестача сну, психологічна напруга внаслідок виконання своїх обов’язків може послаблювати їхню імунну систему та збільшити ризик захворювання на пневмонію [1].
Наявність вогнищ хронічної інфекції було діагностовано у 33,8% пацієнтів. Серед них переважала патологія верхніх дихальних шляхів (риносинусит, фронтит, хронічний тонзиліт). В анамнезі у 14,7% хворих були виявлені часті ГРВІ, причому у 6,8% пацієнтів респіраторні інфекції передували виникненню НП. У 63,2% пневмонія поєднувалась із загостренням хронічних захворювань, у тому числі з гіпертонічною хворобою, ішемічною хворобою серця, виразковою хворобою, хронічним холециститом, панкреатитом, хронічною хворобою нирок, гастроезофагеальною рефлюксною хворобою, бронхіальною астмою, бронхоектатичною хворобою, подагрою, хронічним простатитом [2].
Етіологія пневмоній у 30–50% хворих не встановлюється. Доведено, що найчастіше негоспітальну пневмонію спричинює Streptococcus pneumonia (20– 60%), гемофільна паличка — близько 10–19% випадків, мораксела — до 1–10%, хламідії та мікоплазма — приблизно до 25%, легіонела, віруси, стафілококи зрідка. Частота виявлення різних збудників тяжкої негоспітальної пневмонії може суттєво варіювати залежно від географічного розташування місцевості, сезону, категорії хворих [3].
При дослідженні мокротиння на мікрофлору у госпіталізованих пацієнтів, хворих з діагнозом негоспітальна пневмонія, у 60% пацієнтів збудник не виділявся, в інших 40% був присутній ріст Klebsiella, S. haemoliticus, S. epidermidis, Str. pyogenes, Гр-коки mites, C. albicans. Деякі мікроорганізми не спричинюють розвиток бронхолегеневих запалень. Їх виділення з мокротиння найімовірніше свідчить про контамінацію матеріалу флори верхніх дихальних шляхів, а не про етіологічну значущість мікроорганізмів. До цієї групи належать S. viridans; S. epidermidis та інші коагулазонегативні стафілококи; Enterococcus spp.; Neisseria spp. Мокротиння найбільш доступне для дослідження, однак за специфічністю результатів воно в більшості випадків поступається зразкам, що одержуються інвазивними методами [4].
Розуміння патогенезу та клінічних особливостей пневмонії є вирішальними для вдосконалення стратегій профілактики та лікування цього захворювання.
Мета роботи полягає в аналізі клініко-лабораторних особливостей негоспітальної пневмонії у військовослужбовців.
Матеріали і методи. Для вивчення клініко-лабораторних проявів пневмонії було проаналізовано 60 медичних карт стаціонарних хворих на негоспітальну пневмонію у військовослужбовців за період з 01.09.2022 р. по 01.11.2023 р., які перебували на стаціонарному лікуванні у військово-медичному клінічному центрі центрального регіону та Національному військово-медичному клінічному центрі «Головному військовому клінічному госпіталі».
Результати. На тяжкість перебігу негоспітальної пневмонії, розвиток ускладнень та підхід до діагностики і лікування, окрім інших факторів, великий вплив мають термін госпіталізації, вік хворого, супутні захворювання, збудник, його характеристики тощо.
Середній вік хворих із пневмонією був Ме=42 роки (Q25=34, Q75=51), min=22, max=70 днів. Хворих у віці від 21 до 30 років (1 група) було 8 осіб, у віці 31–40 років (2 група) — 21, у віці 41–50 років (3 група) — 16 осіб, у віці 51–60 років (4 група) — 12 осіб, у віці 61 і більше (5 група) — 4 хворих. Середній ліжко-день всіх хворих склав Ме=14 діб (Q25=11, Q75=17), min=1, max=42 доби.
У 41 хворого був середньотяжкий перебіг, у 19 – тяжкий. У госпіталізованих залежно від віку розподіл ступеня тяжкості був такий: у 1 групі — у 7 середньотяжкий, у 1 — тяжкий; в 2 групі — 16 та 5 відповідно, в 3 групі — 10 та 6 відповідно, в 4 групі 5 та 6 відповідно, в 5 групі — 3 та 1 відповідно.
Основні скарги пацієнтів при госпіталізації до ВМКЦ ЦР та НВМКЦ «ГВКГ» були: загальна слабкість, підвищення температури тіла до фебрильних показників, малопродуктивний кашель, задишка при фізичному навантаженні.
Середня температура при госпіталізації у всіх вікових груп була Ме=37,95°С (Q25=37,3, Q75=38,45), min=36,3°С, max=39,7°С. Середня температура при госпіталізації у 1 віковій групі була Ме=38,1°С (Q25=37,6, Q75=38,3), min=37,3°С, max=38,5°С. Середня температура при госпіталізації у 2 віковій групі була Ме=38,1°С (Q25=37,5, Q75=38,8), min=37°С, max=39,7°С. Середня температура при госпіталізації у 3 віковій групі була Ме=37,85°С (Q25=37,15, Q75=38,25), min=36,4°С, max=39,7°С.
Середня температура при госпіталізації у 4 віковій групі була Ме=37,7°С (Q25=37, Q75=38,7), min=36,3°С, max=39,3°С. Середня температура при госпіталізації у 5 віковій групі була Ме=37,95°С (Q25=37,45, Q75=38,15), min=37°С, max=38,3°С.
У 1 віковій групі субфебрильна температура при госпіталізації була у 3 (37,5%) хворих, фебрильна у 5 (62,5%) осіб; у 2 віковій групі субфебрильна температура реєструвалась у 10 (47,6%) осіб, фебрильна — у 7 осіб (33,3%), піретична — у 4 (19,04%) осіб; у 3 віковій групі нормальна температура була у 2 (12,5%) хворих, субфебрильна температура реєструвалась у 7 (43,75%) осіб, фебрильна — у 6 (37,5%) осіб, піретична — у 1 (6,25%) особи; у 4 віковій групі нормальна температура була — у 1 (8,3%) хворого, субфебрильна температура реєструвалась у 5 (41,7%) осіб, фебрильна — у 4 осіб (33,3%), піретична — у 1 (8,3%) особи; у 5 віковій групі субфебрильна температура реєструвалась у 2 (50%) осіб, фебрильна — у 2 (50%) осіб.
При середньотяжкій пневмонії під час госпіталізації розподіл температури був такий: субфебрильна температура у 18 (43,9%) осіб, фебрильна — у 19 (46,34%), піретична — у 4 (9,7%) осіб. При тяжкій формі розподіл температури був такий: нормальна температура — у 3 (у 15,7%) осіб, субфебрильна температура у 9 (47,36%) осіб, фебрильна — у 5 (26,3%), піретична — у 2 (10,5%) осіб.
Оцінка фізикальних методів дослідження: жорстке ослаблене дихання, наявність дрібнопухирцевих хрипів. Для підтвердження та уточнення місця локалізації інфільтративного процесу проводили рентгенологічне дослідження та спіральну комп’ютерну томографію. Метод комп’ютерної томографії є більш чутливим при встановленні діагнозу пневмонії, а рентгенографія органів грудної клітки має більшу перевагу при контролі змін в динаміці.
Зміни в загальному аналізі крові: лейкоцитоз, підвищення сегментоядерних та паличкоядерних нейтрофілів та підвищення ШОЕ. За даними біохімічного аналізу крові, більшість пацієнтів мали підвищення рівня трансаміназ, тому додатково виставлявся діагноз — неспецифічний реактивний гепатит.
Середнє значення лейкоцитів в перші 5 днів після госпіталізації у хворих із пневмонією дорівнювало Ме=10×109/л (Q25=7,5, Q75=13,35), min=2×109/л, max=24×109/л; сегментоядерних нейтрофілів Ме=61,5% (Q25=54, Q75=70), min=36%, max=99%; паличкоядерних нейтрофілів Ме=11,5% (Q25=7, Q75=17), min=2%, max=24%; ШОЕ — Ме=32 мм/год (Q25=20, Q75=47,5), min=2 мм/год, max=52 мм/год.
Середнє значення лейкоцитів в перші 5 днів після госпіталізації у хворих із пневмонією із середньотяжким перебігом дорівнювало Ме=10×109/л (Q =8,
Середнє значення лейкоцитів в перші 5 днів після госпіталізації у хворих із пневмонією із тяжким перебігом дорівнювало Ме=9×109/л (Q25=6,2, Q75=12,8), min=2×109/л, max=17×109/л; сегментоядерних нейтрофілів Ме=70% (Q25=61, Q75=77), min=40%, max=99%; паличкоядерних нейтрофілів Ме=13% (Q25=8, Q75=18), min=6%, max=24%; ШОЕ — Ме=48 мм/год (Q25=30, Q75=40), min=2 мм/год, max=52 мм/год.
Проведено аналіз найчастіших ускладнень негоспітальної пневмонії важкого та середньоважкого перебігу, до них відноситься: дихальна недостатність ІІ-ІІІ ст., ексудативний плеврит, перикардіальний випіт, токсична нефропатія, реактивний гепатит, астенічний синдром.
Під час лікування призначалось від двох до чотирьох антибактеріальних препаратів, перевага надавалась цефалоспоринам (цефтріаксон, цефепім), фторхінолонам (левофлоксацин, моксифлоксацин, лефлок), макролідам (кларітроміцин). Тривалість антибіотикотерапії залежала від діагнозу та динаміки лікування, зазвичай від 5 до 18 днів.
Висновок. Хворі більш молодого віку (1 група) частіше поступали із фебрильною температурою. Хворі із тяжкою пневмонію могли госпіталізуватись із нормальною або субфебрильною температурою тіла, нормальною кількістю лейкоцитів, у даної категорії були вищі показники ШОЕ порівняно з середньотяжкою формою. Своєчасне виявлення та лікування негоспітальної пневмонії є важливими для запобігання серйозних ускладнень та поліпшення прогнозів для пацієнтів. Профілактика хронічних захворювань може значно знизити ризик захворювання на пневмонію або полегшити її перебіг.
Література
- Respiratory Infections in the S. Military: Recent Experience and Control. Authors: Jose L. Sanchez, Michael J. Cooper, ChristopherMyers, James F. Cummings, Kelly G. Vest, Kevin L. Russell, JoyceSanchez, Michelle J. Hiser, Charlotte A. Gaydos. ASM Journals
- Федорова О. О., Валігура О. І., Салієв А. Ю., Клюшнікова С. В. Особливості клінічного перебігу негоспітальної пневмонії у військовослужбовців ЗСУ — АТО. Військова медицина України 2019: 1 (Том 19).
- Трихліб В. І., Дьяченко В. І., Ткачук С. І., Антоненко Л. П., Марущенко К. Ю., Майданюк В. П., Рихальська К. С. Особливості локалізації національному військово-медичному клінічному центрі «ГВКГ» 2016 р. https://file:///C:/Users/User/Downloads/admin,+12%20(3). pdf
- Рачина С. А., Іванчик Н. В., Козлов Р. С. Особливості мікробіологічної діагностики при позалікарняній пневмонії у дорослих. Практична пульмонологія. 2016: 4; 40-47.
Д. І. Разборський, В. І. Трихліб1, А. Б. Щур2
УРАЖЕННЯ ПЕЧІНКИ У ВІЙСЬКОВОСЛУЖБОВЦІВ
1. Українська військово-медична академія, м. Київ, Україна
2. Військово-медичний клінічний центр Центрального регіону, м. Вінниця, Україна
Е-mail: v.tryhleb@gmail.com
Актуальність. Печінка є одним з найважливіших органів в організмі людини, який виконує багато функцій, таких як метаболізм, регуляція гормонів, детоксикація тощо. Під час військової служби військовослужбовці постійно знаходяться під впливом багатьох фізичних та психологічних стресів, які можуть впливати на функцію печінки. Причини уражень печінки у військових можуть бути різноманітними, включаючи захворювання, фізичні травми, вплив небезпечних хімічних речовин, неправильне харчування та вживання алкоголю.
Поширеність хронічної патології печінки у військовослужбовців певних військових звань перебуває на різному рівні, зокрема, у призовників, військовослужбовців за контрактом — у 28% обстежених, у молодшого офіцерського складу — у 41,5% та старшого офіцерського складу — у 77,5% (p=0,012). При порівнянні захворюваності серед військових різних військових спеціальностей — найчастіше хронічні захворювання печінки спостерігались у водолазів (77,8%) та зв’язківців (78,8%), найменше — у льотчиків (61,3%) та військовослужбовців, які не піддаються впливу специфічних факторів військової праці (64,5%) (p>0,05) [1–4].
У військовослужбовців одне із поширених захворювань є негоспітальна пневмонія. Спостерігається сезонний характер захворюваності на пневмонію: частіше хворіють у холодну пору року. Переохолодження є провокуючим фактором. Епідемії гострих вірусних інфекцій сприяють зростанню кількості пневмоній [2]. Вважається, що віруси служать провідниками, які готують ґрунт для приєднання бактеріальної та мікоплазмової флори. Іншим важливим фактором для розвитку пневмонії є куріння (більше 15–18 сигарет на день), внаслідок чого порушується мукоциліарний кліренс, підвищується хемотаксис макрофагів та нейтрофілів, руйнується еластична тканина, знижується ефективність механічного захисту [3]. Встановлено, що річна динаміка захворюваності на пневмонії носить двохвильовий характер. Вивчення показників імунограми та цитокінового профілю у військовослужбовців з позалікарняною пневмонією може бути використано як додаткова характеристика тяжкості перебігу захворювання. Згідно з даними одного із досліджень, в усіх хворих спостерігалися: кашель; у загальному аналізі крові — зниження кількості лейкоцитів і еритроцитів; підвищена активність амінотрансфераз >1500 ОД/л та подовження ПЧ (на >4–6 с; МНВ >1,5); підвищення рівня аміаку 1 000 мкмоль/л; підвищення рівня лактатів. У 65,1% хворих із середньотяжким та 69,2% з тяжким перебігом захворювання були виділені асоціації грампозитивних та грамнегативних мікроорганізмів [4].
Мета роботи полягає в аналізі уражень печінки у військовослужбовців на тлі різноманітних захворювань.
Матеріали і методи. Для з’ясування клініко-лабораторних проявів ураження печінки у військовослужбовців при різноманітних захворюваннях було проаналізовано дані 60 медичних карт стаціонарних хворих, які були відібрані методом випадкової вибірки за період з 01.09.2022 р. до 01.11.2023 р., які перебували на стаціонарному лікуванні у військово-медичному клінічному центрі центрального регіону (ВМКЦ ЦР) та Національному військово-медичному клінічному центрі «Головного військового клінічного госпіталю».
Результати.
Середній вік хворих був Ме=40 років (Q25=35, Q75=47,5), min=35, max=59 років. Хворих у віці від 21 до 30 років (1 група) було 7 осіб, у віці 31–40 років (2 група) — 22, у віці 41–50 років (3 група) — 25 осіб, у віці 51–60 років (4 група) — 6 осіб. Середній ліжко-день всіх хворих склав Ме=12,5 доби (Q25=8, Q75=21), min=4, max=36 діб. Хворих із гострим вірусним гепатитом В було 9 осіб, хронічний калькульозний холецистит був встановлений у 2 хворих, цироз печінки — у 3, гострий гепатит С — у 2 хворих, портальна гіпертензія — у 2, реактивний гепатит — у 9, хронічний тромбоз ворітної вени — у 1, стеатогепатит — у 1, хронічний гепатит В — у 10 осіб, хронічний гепатит С — у 10, гепатит нез’ясованої етіології — у 3, хронічний криптогенний гепатит — у 1, фіброз печінки — у 3, неспецифічний гострий гепатит — у 1, негоспітальна пневмонія — у 3, гострий бронхіт — у 2, з гострим тонзилітом — у 1, ВІЛ/СНІДом — у 1, поранення — у 10 осіб.
В перші три дні після госпіталізації середній рівень АлАТ у всіх категорій був Ме=90,3 Од/л (Q25=54, Q75=181), min=24 Од/л, max=1 394 Од/л.
В перші три дні після госпіталізації середній рівень АлАТ у хворих із гострим вірусним гепатитом В був Ме=240 Од/л (Q25=96, Q75=367), min=26 Од/л, max=935 Од/л.
В перші три дні після госпіталізації середній рівень АлАТ у хворих із гострим вірусним гепатитом С був Ме=45,5 Од/л (Q25=37, Q75=54), min=37 Од/л, max=54 Од/л.
В перші три дні після госпіталізації середній рівень АлАТ у хворих із хронічним вірусним гепатитом В був Ме=46 Од/л (Q25=36, Q75=114), min=24 Од/л, max=902 Од/л.
В перші три дні після госпіталізації середній рівень АлАТ у хворих із хронічним вірусним гепатитом С був Ме=131 Од/л (Q25=47, Q75=178), min=31 Од/л, max=255 Од/л. В перші три дні після госпіталізації середній рівень АсАТ у всіх категорій був Ме=59 Од/л (Q25=38, Q75=112,5),
min=8 Од/л, max=1 666,2 Од/л.
В перші три дні після госпіталізації середній рівень АсАТ у хворих із гострим вірусним гепатитом В був Ме=70 Од/л (Q25=43, Q75=295), min=24 Од/л, max=450 Од/л.
В перші три дні після госпіталізації середній рівень АсАТ у хворих із гострим вірусним гепатитом С був Ме=40,5 Од/л (Q25=38, Q75=43), min=38 Од/л, max=43 Од/л.
В перші три дні після госпіталізації середній рівень АсАТ у хворих із хронічним вірусним гепатитом В був Ме=43,5 Од/л (Q25=34, Q75=90), min=20 Од/л, max=304 Од/л.
В перші три дні після госпіталізації середній рівень АсАТ у хворих із хронічним вірусним гепатитом С був Ме=98,5 Од/л (Q25=87, Q75=116), min=34 Од/л, max=304 Од/л.
Рівень загального білірубіну був Ме=19,65 мкмоль/л (Q25=15,25, Q75=25,15), min=11,5 Од/л, max=156,5 мкмоль/л. Рівень прямого білірубіну був Ме=15,3 мкмоль/л (Q25=5,2, Q75=42,1), min=5,1 мкмоль/л, max=121 мкмоль/л. Рівень Гамма-глутамінтрансферази був Ме=70,5 Од/л (Q25=37, Q75=175), min=24 Од/л, max=294 Од/л.
Високі показники амінотрансфераз спостерігали у хворих із коронавірусною інфекцією, із гострими гепатитами В та С, з хронічним вірусним гепатитом В із фіброзом F4.
Висновок. У військовослужбовців, окрім вірусних гепатитів як гострих, так і хронічних, зустрічаються різноманітні захворювання печінки, при яких спостерігаються зміни рівня амінотрансфераз від незначних до виражених. Потребує уточнення в діагностиці гострих та хронічних гепатитів.
Література
- Brown R., Johnson C. “Impact of Pneumonia on Liver Function in Active Duty ” Military Health Research Reviews 2016. 64:73– 842
- Thompson , White L. “Military Medicine: Understanding the Interplay of Pneumonia and Hepatic Complications. 2022. Р. 124–131
- Davis M., Clark P. “Liver Pathophysiology in Infectious Diseases: A Comprehensive 2019. Р. 300.
- Johnson , Smith F. “Hepatic Manifestations of Respiratory Infections: A Comprehensive Review.” Annual Review of Military Medicine. 2014. 320–359. https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC7438449/
М. Ю. Слєпченко, З. О. Прохоренкова, Д. О. Платонова
ЗНАЧЕННЯ РІВНЯ ФНП-α У ПРОГНОЗУВАННІ АКТИВАЦІЇ ЛАТЕНТНОЇ ФОРМИ ГЕРПЕСВІРУСНОЇ ІНФЕКЦІЇ В ДІТЕЙ, ХВОРИХ НА РОТАВІРУСНИЙ ГАСТРОЕНТЕРИТ
Харківський національний медичний університет, м. Харків, Україна
Е-mail: Dr.MargaritaSl@gmail.com
Вступ. У доступній літературі є велика кількість робіт, присвячена питанням впливу герпесвірусної інфекції (ГВІ) на імунну відповідь організму хазяїна та перебіг супутньої патології як інфекційного, так і неінфекційного ґенезу [1, 2]. У зв’язку з цим, тривають дослідження спрямовані на пошук маркерів наявності та активації ГВІ [3, 4]. Метою нашого дослідження було встановлення діагностичної значущості концентрації ФНП-α у прогнозуванні активації латентної форми герпесвірусної інфекції (лГВІ) в дітей, хворих на ротавірусний гастроетерит.
Матеріали та методи. Було обстежено 48 дітей віком від 12 до 36 місяців, які знаходились на лікуванні у КНП ХОР «ОДІКЛ» м. Харкова. Серед них 33 дитини з моно-ротавірусною інфекцією — 1 група, та 15 дітей, у яких до періоду ранньої рековалесценції ротавірусної інфекції (РВІ) відбулась активація лГВІ (ЦМВ, ВЕБ, ВГЛ6) — 2 група. Діагноз встановлювався на підставі виявлення ротавірусного антигену у фекаліях методом імунохроматографічного аналізу. Наявність інфікування вірусами групи герпес та фаза ГВІ встановлювались на основі виявлення специфічних імуноглобулінів класу М та G (ІФА) та нуклеїнової кислоти (ПЛР) до вірусів герпесу (1, 2, 4, 5, 6) у сироватці крові хворих.
Для розрахунку показників чутливості (Se), специфічності (Sp) класифікатора та визначення граничного значення використано ROC-аналіз.
Результати. У ході дослідження було проведено аналіз клінічних показників перебігу ротавірусної інфекції та концентрації різних прота протизапальних цитокінів у порівнюваних групах. Було встановлено, що у хворих 2 групи достовірно довше тривала лихоманка порівняно з пацієнтами 1 групи (7,0 [6,0; 8,0]; 6,0 [5,0; 7,0] р=0,053). Також в дітей 2 групи були достовірно вищі рівні ФНП-α проти показників пацієнтів 1 групи (9,4 [8,1;10,5]; 7,2 [6,3; 8,4] <0,001). Цей факт спонукав нас оцінити прогностичну цінність концентрації ФНП–α для активації лГВІ в дітей хворих на ротавірусний гастроентерит. Для оцінки діагностичної значущості рівня ФНП-α у прогнозуванні активації лГВІ в дітей до періоду реконвалесценції РВІ використовувався метод аналізу ROC кривих з подальшим виділенням граничного значення. За результатами оцінки ROC кривої залежності вмісту ФНП–α та активації лГВІ до періоду ранньої реконвалесценції РВІ отримано характеристичну криву, яка не перетинала контрольну діагональ, забезпечувала чутливість та специфічність на рівні понад 50%, площа під кривою AUC=0,826 (дуже добра якість моделі) при рівні статистичної значущості р<0,001.
Результат аналізу концентрації ФНП-α у сироватці крові демонструє, що при рівні ФНП-α більше ніж 7,75 пг/мл, з чутливістю 93,3% та специфічністю 61,8%(AUC=0,826±0,049 [95,0% ДІ 0,731–0,921], р<0,001), вірогідна активація латентної форми герпесвірусної інфекції до періоду ранньої реконвалесценції ротавірусного гастроентериту. З нашого погляду, вищі рівні протизапального цитокіну ФНП-α є відображенням активації лГВІ та пролонгації запального процесу, що, імовірно, і пояснює більш тривале збереження лихоманки у хворих 2 групи.
Висновок. За результатами аналізу ROC-кривих встановлено, що при рівні ФНП-α більше ніж 7,75 пг/мл, у період ранньої реконвалесценції РВІ, можна запідозрити наявність активації латентної форми герпесвірусної інфекції в дітей хворих на ротавірусний гастроентерит.
Література
- Söderberg-Nauclér Does reactivation of cytomegalovirus contribute to severe COVID-19 disease? Immun Ageing. 2021 Mar 12;18(1):12. doi: 10.1186/s12979-021-00218-z. PMID: 33712035; PMCID: PMC7952506.
- Genizi , Golan-Shany O., Tarazov T., Pechter S., Assaf N., Segal et al. Does Herpes 6 Infection Have a Role in Bell’s Palsy Among Children and Adolescents? Pediatr Infect Dis J. 2019 May;38(5):481– doi: 10.1097/INF.0000000000002278. PMID: 30724837
- Soderberg-Naucler C. // Immunity and Ageing. 2021. Vol. 18 (1). DOI: 10.1186/sl2979-021-00218-z Budiningsih I., Dachlan Y. P., Hadi U., Middeldorp J. Quantitative cytokine level of TNF-α, IFN-γ, IL-10, TGF-β and circulating Epstein-Barr virus DNA load in individuals with acute Malaria due to P. falciparum or P. vivax or double infection in a Malaria endemic region in Indonesia. PLoS One. 2021 Dec 28;16(12):e0261923. doi: 10.1371/journal.pone.0261923. PMID: 34962938; PMCID: PMC8714090
- Pachnio , Ciaurriz M., Begum J., Lal N., Zuo J., Beggs A. et al. Cytomegalovirus Infection Leads to Development of High Frequencies of Cytotoxic Virus-Specific CD4+ T Cells Targeted to Vascular Endothelium. PLoS Pathog. 2016 Sep 8;12(9):e1005832. doi: 10.1371/journal.ppat.1005832. PMID: 27606804; PMCID: PMC5015996
О. О. Шахова, Р. І. Гончарук
ОЦІНКА ЕФЕКТИВНОСТІ КОМПЛЕКСНОГО ЛІКУВАННЯ ДІТЕЙ ІЗ ФЕБРИЛЬНИМИ НАПАДАМИ БРОНХІАЛЬНОЇ АСТМИ ВІРУСНОЇ ТА БАКТЕРІАЛЬНОЇ ЕТІОЛОГІЇ
Буковинський державний медичний університет, м. Чернівці, Україна
Е-mail: shahova.olga@bsmu.edu.ua
Вступ. Всупереч тому, що бронхіальна астма (БА) найчастіше розвивається в дітей раннього та дошкільного віку, вирішення питань щодо лікування даного захворювання у цій віковій групі вирізняється суперечливістю і недостатньою обґрунтованістю та ефективністю. Це насамперед пов’язано з нечіткими уявленнями про патогенез БА в дітей даного віку та, зокрема, щодо взаємозв’язків даного захворювання з респіраторною інфекцією.
Мета. Оцінити ефективність комплексного лікування дітей із фебрильними нападами бронхіальної астми вірусної та бактеріальної етіології.
Матеріали і методи. Для оцінки ефективності комплексної терапії дітей із фебрильними нападами БА на тлі наявності бактеріальної (основна, І клінічна група — 54 хворих, в результаті бактеріологічного дослідження мокротиння та/або позитивних серологічних тестів підтверджено наявність бактеріальних збудників при фебрильних нападах БА) та вірусної (група порівняння, ІІ клінічна група — 48 дітей, за допомогою вірусологічних досліджень підтверджено вірусний характер загострень БА на тлі підвищення температури тіла) респіраторної інфекції, проведений аналіз її обсягу, інтенсивності та ефективності в наведених групах порівняння.
Результати дослідження. У хворих на бактеріальну інфекцію дихальних шляхів глюкокортикостероїди переважно вводилися парентерально (60,7%) і лише у 1 хворого (1,8%) вони призначалися у вигляді інгаляцій. У групі порівняння призначення глюкокортикостероїдів як інгаляцій було у 8,7% випадків (Рφ<0,05), а парентерально — у 47,8% (Рφ=0,05). Середня тривалість призначення глюкокортикостероїдів у І клінічній групі становила 2,2±0,13 доби, а у групі порівняння — 3,1±0,32 доби (Р>0,05). У хворих основної клінічної групи антибіотики цефалоспоринового ряду використовувалися в лікуванні 31 хворого (55,4%), препарати макролідної групи — у 18 хворих (32,1%), захищені амінопеніциліни — у 12 дітей (21,4%), антибіотики аміноглікозидної групи — 9 хворих (16,1%), протигрибкові препарати — 7 пацієнтів (12,5%), а протитуберкульозні засоби — 3 пацієнтів (5,4%). У групі порівняння наведені антибіотики відповідно призначалися у наступній кількості випадків: 17 (36,9%, Рt<0,05), 11 (23,9%, Рt>0,05), 6 (13,0%, Рt>0,05), 6 (13,0%, Рt>0,05), 1 (2,2%, Рt<0,05) та 3 (6,5%, Рt>0,05).
Середня тривалість курсу антибіотикотерапії у хворих І клінічної групи становила 6,0±0,2 доби, а в групі порівняння — 6,0±0,2 доби (Р>0,05). Середня тривалість призначення препаратів ксантинового ряду в комплексній терапії дітей І клінічної групи сягала 4,8±0,63 доби, а у ІІ групі — 5,0±0,81 доби (Р>0,05), а β2-агоністів відповідно 8,5±0,58 та 7,8±0,59 доби (Р>0,05). Інфузійна терапія у І клінічній групі проводилася 22 хворим (39,3%) та 17 хворим (37%) у групі порівняння (Р>0,05), а середня тривалість її у групах відповідно сягала 3,5±0,26 доби та 3,2±0,26 доби (Р>0,05). Відхаркувальні препарати у хворих І клінічної групи використовувалися в комплексному лікуванні 33 хворих (58,9%), а у ІІ клінічній групі вони застосовувалися 34 хворим (73,9%, Pt<0,05). Середня тривалість призначення відхаркувальних препаратів у І клінічній групі становила 8,8±0,3 доби, а ІІ клінічній групі — 8,8±0,32 доби (Р>0,05). Фізіотерапевтичне лікування проводилося з однаковою частотою в групах порівняння і середня його тривалість становила у І клінічній групі 8,6±0,27 доби і 8,7±0,27 доби в групі порівняння (Р>0,05).
Отже, комплексна терапія дітей у групах порівняння з урахуванням частоти використання основних лікарських засобів суттєво не відрізнялася. Це підтверджувалося також і відсутністю істотних розбіжностей її комплексної оцінки (у балах). Зокрема, оцінюючи проведену терапію у вигляді рейтингу, нами комісійно використана така рейтингова бальна оцінка: використання глюкокортикостероїдів (не використовувалися — 0 балів, призначалися перорально — 2 бали, призначалися інгаляційно — 3 бали, призначалися парентерально — 4 бали); використання метилксантинових препаратів (не використовувалися — 0 балів, призначалися перорально — 2 бали, призначалися парентерально — 3 бали); використання β2-агоністів (не використовувалися — 0 балів, призначалися інгаляційно — 2 бали); використання антибактеріальних засобів (не використовувалися — 0 балів, призначалися перорально — 2 бали, призначалися парентерально — 3 бали), проведення інфузійної терапії (не використовувалася — 0 балів, призначалася — 2 бали); відхаркувальні препарати (не використовувалися — 0 балів, призначалися — 1 бал); використання антигістамінних препаратів (не використовувалися — 0 балів, призначалися — 1 бал).
Висновки. Використовуючи наведену рейтингову оцінку комплексного лікування обстежених дітей відмічено, що у І клінічній групі вона у середньому становила 12,1±0,72 бала, а у ІІ групі — 10,8±0,89 бала (Р>0,05). Під впливом наведеного комплексного лікування відмічалося суттєве зменшення таких інтегральних клінічних синдромів, як бронхіальна обструкція та ендотоксикоз. Водночас не відмічено істотних відмінностей між ефективністю лікування в дітей груп порівняння з урахуванням зменшення клінічних проявів вказаних синдромів.
Література
- Global Initiative for Global Strategy for Asthma Management and Prevention (2023 Update):155. Available from: https://ginasthma.org/wp-content/uploads/2023/07/GINA-2023-Full-report-23_07_06-WMS.pdf
- Hon K. E., Leung T. F., Leung A. K. C. Clinical effectiveness and safety of montelukast in asthma. What are the conclusions from clinical trials and meta-analyses. Drug Des Devel Ther. 2014;8:839–850. https://doi.org/10.2147/DDDT.S39100
- Shilpa , Patel and Stephen J. Asthma. Pediatrics in Review. 2019;40(11):549–567. DOI: https://doi.org/10.1542/pir.2018–0282
- Castro-Rodriguez A. et al. Daily inhaled corticosteroids or montelukast for preschoolers with asthma or recurrent wheezing: A systematic review. Pediatric pulmonology. 05 November 2018. https://doi.org/10.1002/ppul.24176
- Lv J., Zhong Z. Effect of leukotriene receptor antagonist on clinical symptoms, Th1/ Th2 cytokines and pulmonary function in children with bronchial Int J Clin Exp Med. 2019;12(12):13890–13895. www.ijcem.com /ISSN:1940–5901/IJCEM0101248
