Клінічні та деякі імунологічні особливості проявів герпесвірусних уражень нервової системи на фоні постковідного синдрому
УДК 616.523:578.834+616.831
DOI : https:/doi.org/10.61948/prevmed-2014-1-25
П. А. Дьяченко, О. Л. Панасюк, О. Г. Андрєєва, В. Ю. Клюс, B.A. Parkhomets
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ, Україна
Адреса для листування. Е-mail: padyac@gmail.com
У статті наводяться дані сучасної літератури про актуальність серйозної проблеми охорони здоров’я, проблеми у діагностиці постковідного синдрому, ускладнення, складну Т-клітинну та перехресну відповідь імунної системи.
Проведено детальний аналіз та аргументовано літературними даними проявів уражень центральної та периферичної нервової системи при герпесвірусних інфекціях на фоні постковідного синдрому. Наведено прояви імунних відповідей та аутоімунних змін при COVID-19.
Метою роботи було дослідити клінічні та імунологічні особливості перебігу герпесвірусних уражень нервової системи у пацієнтів з постковідним синдромом та без нього.
Було обстежено 96 пацієнтів з ураженнями нервової системи герпесвірусної етіології, що перенесли COVID-19 в анамнезі (в середньому за 2–2,5 міс. до надходження у відділення). У пацієнтів, які перенесли COVID, значно частіше проявляється ураження окремих ЧМН (у 2,14 раза), порушення функції ФТО (2,1 раза), розсіяна неврологічна симптоматика (у 2 рази), розлади психіки (у 1,8 раза), розлади сну (у 3,5 раза) та лихоманка (у 2,4 раза).
Авторами статті встановлено, що у хворих з ураженнями нервової системи на тлі постковідного синдрому та активації нейротропних збудників найчастіше зустрічався головний біль, прояви атаксії та вегетативної дисфункції, розсіяна неврологічна симптоматика, пірамідна недостатність.
Усім пацієнтам було визначено активність аутоантитіл до нейроантигенів (основного білку мієліну, NSE, S100, загального мозкового антигену людини). У хворих із постковідним синдромом виявлено статистично достовірне підвищення рівню аутоантитіл до основного білку мієліну, білку S100 та нейроспецифічної енолази, порівнюючи з групою спостереження. Ці дані показують більш тяжкий перебіг уражень нервової системи на тлі постковідного синдрому, що зі свого боку пов’язано з більш глибоким ураженням структур нервової системи.
Ключові слова: постковідний синдром, ураження нервової системи, аутоімунна відповідь, герпесвіруси.
A. Dyachenko, O. L. Panasyuk, B. A. Parkhomet, O. G. Andreeva,V. Yu. Klyus,
Clinical and some immunological features of the manifestations of herpesvirus lesions of the nervous system against the background of the post-covid syndrome
SI «L. V. Hromashevskyi Institute of Epidemiology and Infectious Diseases of the National Academy of Medical Sciences of Ukraine», Kyiv, Ukraine
The article presents data from the current literature on the relevance of a serious health problem, problems in the diagnosis of post-COVID syndrome, complications, complex T-cell and cross-talk immune system responses.
A detailed analysis of the manifestations of central and peripheral nervous system lesions in herpesvirus infections with post-COVID syndrome is carried out and substantiated by the literature. The manifestations of immune responses and autoimmune changes in COVID-19 are presented.
The aim of the study was to investigate the clinical and immunological features of the course of herpesvirus lesions of the nervous system in patients with and without post-COVID syndrome.
We examined 96 patients with nervous system lesions of herpesvirus etiology who had a history of COVID-19 (on average 2–2.5 months before admission to the department). Patients who have had COVID are much more likely to have lesions of individual CNS (2.14 times), PTO dysfunction (2.1 times), diffuse neurological symptoms (2 times), mental disorders (1.8 times), sleep disorders (3.5 times) and fever (2.4 times).
The authors of the article found that in patients with nervous system lesions against the background of post-COVID syndrome and activation of neurotropic pathogens, headac he, ataxia and autonomic dysfunction, diffuse neurological symptoms and pyramidal insufficiency were most common.
The activity of autoantibodies to neuroantigens (myelin basic protein, NSE, S100, and human general brain antigen) was determined in all patients. In patients with post-COVID syndrome, a statistically significant increase in the level of autoantibodies to myelin basic protein, S100 protein, and neurospecific enolase was detected compared to the control group. These data indicate a more severe course of nervous system lesions in the setting of post-COVID syndrome, which in turn is associated with deeper damage to the structures of the nervous system.
Key words: Long-COVID, nervous system injures, autoimmune response, herpesviruses.
Розлади нервової системи при COVID-19 дуже мінливі [1, 2]. Вони включають інфекційно-токсичні енцефалопатії, ураження периферичних нервів і м’язів, гострі порушення мозкового кровообігу (ГПМК), а також пості параінфекційні аутоімунні ураження нервової системи [3]. Імовірність розвитку істинних вірусних енцефалітів при COVID-19 є спірним питанням. У літературі є повідомлення про розвиток енцефалітів у пацієнтів із COVID-19. Однак привертає увагу слабке лабораторне підтвердження даних випадків. У всіх спостереженнях у хворих відзначався нормальний або трохи змінений склад цереброспінальної рідини (ЦСР), а РНК SARS-CoV-2 була виявлена тільки в поодиноких випадках [4].
Однією з найчастіших форм ураження ЦНС при COVID-19 [5, 6] є вторинна інфекційно-токсична енцефалопатія. В її основі можуть лежати пряме пошкодження гематоенцефалічного бар’єру, гіпоксичне, дисметаболічне та імунно-опосередковане ураження нервової системи [7, 8]. За даними Helms та співавт. [5], симптоми залучення ЦНС супроводжувалися пірамідною недостатністю з посиленням сухожильних рефлексів, клонусами стоп та двосторонніми розгинальними патологічними рефлексами у 67% випадків. У поодиноких випадках відбувається розвиток атаксії та симптоматичних судом [3]. У периферичній крові у пацієнтів із симптомами ураження ЦНС виявлявся нижчий рівень лімфоцитів, ніж у пацієнтів без таких. Даний показник може свідчити про більш виражену імуносупресію, а пацієнти з ознаками ураження ЦНС можуть мати найгірший прогноз перебігу захворювання.
Ураження периферичної нервової системи та м’язі при COVID-19 можуть бути пов’язані як з безпосереднім вірусним ушкодженням, так і з постінфекційними аутоімунними механізмами. Mao та співавт., які проаналізували клінічні дані у 214 пацієнтів з COVID-19, у 78 (36,4%) виявили неврологічні порушення.
Синдром тривалого COVID, або пост-COVID-19, спочатку отримав широке визнання серед груп соціальної підтримки, а потім у наукових і медичних спільнотах. Ця хвороба погано вивчена, оскільки вона вражає тих, хто пережив COVID-19 будь-якого рівня тяжкості захворювання, навіть молодших дорослих, дітей та тих, хто не був госпіталізований. Патофізіологія цього стану невідома, навіть якщо деякі гіпотези були висунуті, але ще не продемонстровані. Тривалий COVID характеризується дуже гетерогенною групою підгострих та/або хронічних симптомів і ознак, які виникають після гострої фази інфекції SARS-CoV-2 і мають дуже різну тривалість. Наявність цього синдрому у людини не залежить від тяжкості гострої інфекції SARS-CoV-2. Крім симптомів і ускладнень, люди з тривалим COVID-19 часто повідомляли про погіршення якості життя, психічного здоров’я та проблеми з роботою [10, 11]. Кількість людей, які страждають від тривалого COVID-19, є високою, навіть якщо це спостерігається лише у частини суб’єктів, які хворіли на COVID-19. Таким чином, тривалий COVID є серйозною проблемою охорони здоров’я, і з ним потрібно боротися, щоб забезпечити належний доступ до допомоги всім людям, які цього потребують [9].
Тривалий COVID може мати безперервний або рецидивуючий і ремітуючий перебіг [12]. Може спостерігатися збереження одного чи кількох ознак гострого COVID-19 або поява нових симптомів. Більшість людей із пост-COVID-синдромом ПЛР-негативні, що вказує на мікробіологічне відновлення. Іншими словами, постCOVID-синдром — це часовий ланцюг між мікробіологічним та клінічним відновленням [13]. Існує кілька проблем у діагностиці тривалого COVID-19. Час клінічного одужання залежить від тяжкості захворювання; тоді як супутні ускладнення заплутують визначення часу для діагностики. У значної частини інфікованих осіб SARS-CoV-2 протікає безсимптомно, і багато людей не пройшли б жодного тесту для підтвердження інфекції SARS-CoV-2. Якщо у цих осіб згодом з’являться множинні симптоми, поставити діагноз тривалої хвороби COVID без попередніх ознак інфекції SARS-CoV-2 буде складно.
Відмічено, що у пацієнтів з пригніченням імунітету та тих, хто проходить діаліз, відповідь антитіл (АТ), може сприяти хронічній персистенції вірусу [14]. Також показано, що Т-клітини CD4+ і CD8+, викликані інфекцією SARS-CoV-2, спрямовані проти ряду антигенів, включаючи структурні та неструктурні білки та значною мірою пов’язані з більш м’якими дисоціаціями [14]. В експерименті показано, що AТ-опосередковане виснаження CD8+ Т-клітин у реконвалесцентних макак частково скасовує захист від повторного зараження SARS-CoV-2, що може свідчити про роль Т-клітин CD8+ [15]. З огляду на значущість цього механізму для індукції нейтралізуючих АТ у реконвалесцентів була вивчена дуже детально відповідь Т-клітин CD4+ на білок S [16–18]. Ці дослідження виявили численні Т-клітинні епітопи в рецептор-зв’язуючому домені, включаючи імунодомінантний сайт, який є висококонсервативним. Одним із обмежень, які накладає важка форма COVID-19, є виражена Т-клітинна лімфопенія, що впливає на здатність господаря створити стійку імунну відповідь. Антитіла і Т-клітини пам’яті, сформовані після вакцинації загалом нагадують такі при інфекції SARS-CoV-2, але їх роль у протекції чи патології ще належить встановити. Крім того, було встановлено, що виявлення CD4+ Т-клітин пам’яті, специфічних для комплексу транскрипції ранньої транскрибованої реплікації можуть забезпечувати перехресний захист від SARS-CoV-2 [19]. До того ж, перехресно реактивні АТ, викликані сезонними коронавірусами, можуть впливати на перебіг захворювання, а також імунної відповіді de novo на SARS-CoV-2 [21, 22]. Індукція як CD4+, так і CD8+ Т-клітин відіграє центральну роль в ефективному Т-клітинному імунітеті при інфекційних і злоякісних захворюваннях [22]. Перехресна реактивність Т-клітин до різних видів вірусів або навіть до різних патогенів — добре відоме явище для забезпечення гетерологічного імунітету після контакту з неідентифікованим патогеном [23]. Перехресно-реактивні Т-клітини при контакті з АГ SARS-CoV-2 відповідають посиленням імунної відповіді як при зараженні, так і вакцинації [24]. Показана велика частота спайк-специфічних Т-клітинних відповідей у когорті до пандемічних донорів, які не підвищилися від експансії Т-клітин в системі in vitro. Відповідно, інтенсивність і різноманітність цих раніше наявних Т-клітинних відповідей були значно нижчими, ніж у реконвалісцентів і вакцинованих осіб. Проте, на відміну від попередніх даних, показано, що перехресно-реактивні Т-клітинні відповіді проти пептидного пулу Prot_S1, що покриває всю N-кінцеву частку домену S1 шиповидного білка, який описаний як HCoV гомологічний, ніж S-кінцеву частку, покритий пептидним пулом Prot_S. Це вказує на те, що перехресна реактивність заснована не тільки на схожості послідовностей, але також на фізико-хімічних і HLA-зв’язуючих властивостях.
Мета роботи — дослідити клінічні та імунологічні особливості перебігу герпесвірусних уражень нервової системи у пацієнтів з постковідним синдромом та без нього.
Матеріали і методи. Відповідно до поставленої мети, нами було проаналізовано медичні картки 96 хворих (24 чоловіків та 72 жінок, середнім віком 41,9±7,2 року) пролікованих у відділенні нейроінфекцій протягом 2020–2023 рр., які мали в анамнезі перенесену коронавірусну хворобу — в середньому за 2–2,5 міс. до надходження у відділення, з виявленими АТ IgG до SARS-CoV-2 та з ознаками уражень нервової системи. Усім пацієнтам було визначено активність аутоантитіл до нейроантигенів (основного білку мієліну, NSE, S100, загальному мозковому антигену людини). Діагноз встановлювався відповідно до наказів МОЗ України, міжнародних клінічних рекомендацій, на підставі даних анамнезу, результатів клінічного, інструментального та лабораторного обстежень (ПЛР(+) SARS-CoV-2, Ag SARS-CoV-2, наявності в крові IgG SARS-CoV-2). Лабораторна частина дослідження проводилася на базі клінічної лабораторії ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України»
У групу зіставлення (група 2) було взято 107 історій хвороб пацієнтів з верифікованими запальними ураженнями нервової системи, які лікувались у відділенні нейроінфекцій у період 2015–2019 рр. Чоловіків було 33 (30,8%) пацієнти, жінок — 74 (69,3%), співвідношення чоловіків і жінок дорівнювало 1:2,2. Середній вік хворих склав 36,9 року (діапазон 20–65 років).
Вакциновані особи та особи, які мали клінічні прояви ураження нервової системи до захворювання на коронавірусну інфекцію, були виключені з дослідження.
Результати та обговорення.
Нами було обстежено 96 пацієнтів з ураженнями нервової системи герпесвірусної етіології, що перенесли COVID-19 в анамнезі (в середньому за 2–2,5 міс. до надходження у відділення) та мали скарги неврологічного характеру, які з’явились після перенесеної коронавірусної інфекції. Перенесення COVID-19 підтверджувалось даними анамнезу та виявленням специфічних антитіл у сироватці крові пацієнтів.
Щодо залучення в патологічний процес структур центральної та периферійної нервової системи виокремлено: менінгоенцефаліт, енцефаліт, розсіяний енцефаломієліт, енцефаломієлополірадикулоневрит, арахноїдит, арахноенцефаліт, синдром Гієна-Барре.

Щодо залучення в патологічний процес збудників інфекційних хвороб виокремлено: HSV½, VZV, EBV, CMV, HHV6, HHV7, а також їхні асоціації.
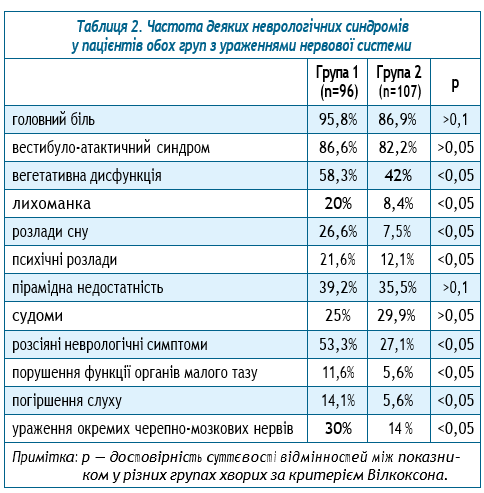
Як ми бачимо з таблиці 2, у хворих з ураженнями нервової системи на фоні постковідного синдрому та активації герпесвірусів найчастіше (але статистично не достовірно) зустрічався головний біль, прояви атаксії та вегетативної дисфункції, розсіяна неврологічна симптоматика та пірамідна недостатність. При порівнянні з пацієнтами групи зіставлення звертає на себе увагу, що у пацієнтів, які перенесли COVID, значно частіше проявлялися ураження окремих черепно-мозкових нервів (у 2,14 раза), порушення функції тазових органів (у 2,1 раза), розсіяна неврологічна симптоматика (у 2 рази), розлади психіки (у 1,8 раза), розлади сну (у 3,5 раза) та лихоманка (у 2,4 раза). Ці дані показують більш тяжкий перебіг уражень нервової системи на фоні постковідного синдрому, що зі свого боку пов’язано з більш глибоким ураженням структур нервової системи.
При вивченні неврологічної симптоматики у пацієнтів обох груп виявлено достовірне підвищення тривалості цефалгічного синдрому, вегетативної дисфункції, розсіяної неврологічної симптоматики, порушень функції органів малого тазу та погіршення слуху в пацієнтів з перенесеним COVID в анамнезі, що вказує на більш тяжкий і торпідний перебіг захворювання.
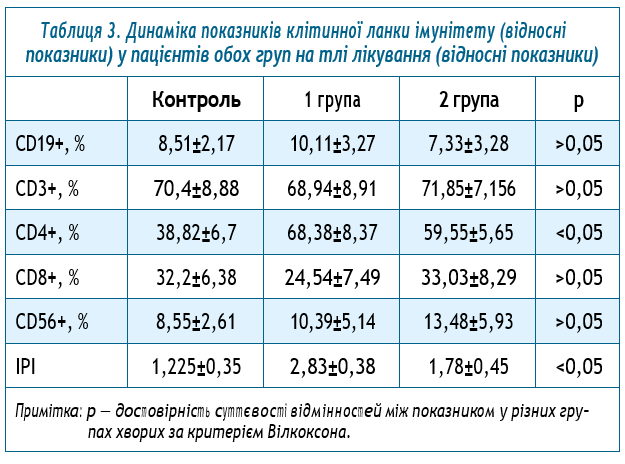
При обстеженні клітинної ланки імунітету виявлено, що у хворих із ураженнями нервової системи та постковідним синдромом відбуваються досить виражені зміни: зростання рівня лімфоцитів з маркерами CD4+,
імунорегуляторного індексу, зниження CD8+. Ці зміни говорять про виражені порушення клітинної імунної відповіді, зменшення функціональної активності ефекторних клітин імунної системи у хворих з постковідним синдромом та активністю герпесвірусів.
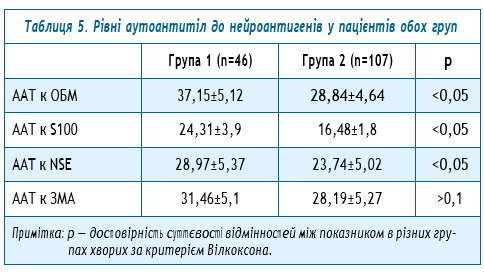
Враховуючи те, що аутоімунні процеси відіграють велику негативну роль у патогенезі уражень нервової системи, нами було проведено вивчення рівня деяких аутоантитіл до нейроантигенів у пацієнтів з постковідним синдромом та без нього.

При аналізі рівня аутоантитіл до нейроантигенів звертає на себе увагу суттєве підвищення рівня аутоантитіл до основного білку мієліну, білку S100 та нейроспецифічної енолази порівняно з групою спостереження, що дає уявлення про більш активний аутоімунний процес щодо нервової тканини у хворих з постковідним синдромом.
Наводимо клінічний приклад.
Хвора 53 роки. Звернулася зі скаргами на зникнення чутливості, зі слів хворої: «Спочатку на нижніх кінцівках, через кілька днів на верхніх», неможливість
встати з ліжка, нездатність відчувати температуру навколишнього середовища, порушення координації, зниження працездатності, біль в очах, диплопію, гіперакузію, сльозогінність. У неврологічному статусі: у свідомості, емоційно лабільна, орієнтована, на питання відповідає адекватно. Очні щілини S=D, зіниці S=D, фотореакція не знижена, тремор повік незначний, при конвергенції не доводить ліве око, спостерігається горизонтальний ністагм зліва і справа. Зазначається диплопія. Гіперакузія. Асиметрія обличчя (більше праворуч) внаслідок ураження лицевого нерву. Легка девіація язика вліво. Черевні рефлекси різко знижені. Сухожильні рефлекси на в/к знижені, S≥D, на н/к знижені S≥D. C-м Шофара (+), с-м Россолімо (-), с-м Ласега (+). С-м Нері (-), Гордона (+), Штрюмпеля (-), с-м Шарапова (-) з обох боків, Чаддока (-), Пуссепа (-), Бабінського (-), Марінеску-Радовичі (-). Знижено м’язову силу на нижніх кінцівках справа — 0,5б, зліва 1б. На верхніх кінцівках м’язова сила 2б. Менінгеальні симптоми не виявляються. Чутливість нижньої кінцівки різко знижена до середньої третини стегна, S≥D. На верхніх кінцівках різко знижено S≥D до ліктя. Сечовипускання вільне. Закрепи.
Хворіє з 22.03.2021 р., коли з’явилася гіпостезія в нижніх кінцівках. Звернулася по медичну допомогу до сімейного лікаря (при обстеженні виявлено тромбоцитоз, коагулопатію). За 3 тижні до початку захворювання перенесла COVID-19 у легкій формі (лікувалась вдома, мала позитивний тест на АГ SARS-CoV-2). Стан різко погіршувався (з’явилась висхідна слабкість у нижніх кінцівках, гіпоа потім і анестезія нижніх кінцівок та тулуба до рівня лобкового синтезу). Хвора була направлена у відділення нейроінфекцій ДУ ІЕІХ НАМНУ.
При обстеженні під час госпіталізації до стаціонару виявлено антитіла IgG EA EBV у сироватці крові. Ліквор (29/03): цитоз — 2 (87,5% лімфоцити, 12,5% нейтрофіли), білок — 1,1 г/л. Реакція Панді (++), Апельта (+). Глюкоза — 5 ммоль/л, хлориди 107,7 ммоль/л. IgG, DNA EBV — виявлені, IgG, DNA інших герпесвірусів, tbc, Tox. gondii, мікрофлора — не виявлені.
Діагноз: пост-COVID-синдром у вигляді синдрому Гійєна-Барре з переважним ураженням кінцівок у вигляді млявого тетрапарезу (більше нижнього парапарезу), з порушенням функції тазових органів, на тлі EBV-інфекції у стадії активації, тяжкий, затяжний перебіг.
Було проведено лікування: ганцикловір внутрішньовенно крапельно у дозі 10 мг/кг/добу, імуноглобулін людський для внутрішньовенного введення у дозі 2 г/кг/курс, нейропротекторна, протизапальна, дезінтоксикаційна, ангіопротекторна терапія.
У результаті лікування протягом 3 тижнів, хвора виписана з одужанням, відсутністю неврологічного дефіциту. При проведенні контрольних досліджень крові та спинномозкової рідини маркерів активності EBV не виявлено.
Висновки.
Вперше в Україні було проведено порівняльне дослідження клінічного перебігу уражень нервової системи, викликаних персистуючими збудниками на фоні постковідного синдрому. Показано, що у пацієнтів, які перенесли COVID, значно частіше проявляється ураження окремих ЧМН (у 2,14 раза), порушення функції тазових органів (2,1 раза), розсіяна неврологічна симптоматика (у 2 рази), розлади психіки (у 1,8 раза), розлади сну (у 3,5 раза) та лихоманка (у 2,4 раза). Ці дані показують більш тяжкий перебіг уражень нервової системи герпесвірусної етіології на фоні постковідного синдрому, що зі свого боку пов’язано з більш глибоким ураженням структур нервової системи.
При обстеженні клітинної ланки імунітету виявлено, що у хворих із ураженнями нервової системи та постковідним синдромом відбуваються досить виражені зміни: зростання рівня лімфоцитів з маркерами CD4+, імунорегуляторного індексу, зниження CD8+. Ці зміни говорять про виражені порушення клітинної імунної відповіді, зменшення функціональної активності ефекторних клітин імунної системи у хворих із герпесвірусними ураженнями нервової системи та постковідним синдромом.
При проведенні порівняльного аналізу рівнів аутоантитіл до деяких нейроантигенів, у хворих із постковідним синдромом виявлено статистично достовірне підвищення рівня аутоантитіл до основного білку мієліну, білку S100 та нейроспецифічної енолази порівняно з групою спостереження, що дає уявлення про більш активний аутоімунний процес щодо нервової тканини у хворих із постковідним синдромом та герпесвірусними ураженнями нервової системи.
Література
- Inciardi R. M. Cardiac involvement in a patient with coronavirus disease 2019 (COVID-19). JAMA Cardiol. 2020;. URL:http://refhub. com/S0889-1591(20)30685-1/h0025 (дата звернення: 11.05.2020).
- Huang C. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, Lancet. 2020; Vol.395,№10223: 497–506.
- Mao et al. Neurologic Manifestations of Hospitalized Patients With Coronavirus Disease 2019 in Wuhan, China. JAMA Neurol. 2020. URL:https://www.ncbi.nlm.nih.gov/pmc/articles/ PMC7149362 (дата звернення: 11.05.2020).
- Xiang P. et al. First case of 2019 novel coronavirus disease with ChinaXiv. 2020. T202003, 00015. URL:http://www. chinaxiv.org (дата звернення: 08.05.2020).
- Helms et al. Neurologic Features in Severe SARS-CoV-2 Infection. N Engl J Med. 2020. URL:https://www.ncbi.nlm.nih.gov/ pmc/articles/PMC7179967 (дата звернення: 08.05.2020).
- Filatov et al. Neurological Complications of Coronavirus Disease (COVID-19): Encephalopathy. Cureus. 2020. URL: https:// www.ncbi.nlm.nih.gov/pmc/articles/PMC7170017 (дата звернення: 11.05.2020).
- Steardo L. et al. Neuroinfection may contribute to pathophysiology and clinical manifestations of COVID-19. Acta Physiol (Oxf). 2020; URL:https://onlinelibrary.wiley.com/doi/full/10.1111/apha.13473 (дата звернення: 05.2020).
- Wu et al. Nervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav Immun. 2020; Vol.1591(20): 30357-3.
- Silvia Staffolani, Valentina Iencinell, Matteo Cimatti, Marcello Long COVID-19 syndrome as a fourth phase of SARS-CoV-2 infection. eCollection 2022 Mar 1;30(1):22–29. DOI: 10.53854/liim-3001-3.
- Harry Crook, Sanara Raza, Joseph Nowell, Megan Young, Paul Long covid-mechanisms, risk factors, and management. BMJ. 2021 Jul 26;374:n1648. DOI: 10.1136/bmj.n1648.
- Olalekan Lee Aiyegbusi, Sarah E Hughes, Grace Turner. Symptoms, complications and management of long COVID: a review. J R Soc 2021; Sep 114(9):428-442. DOI: 10.1177/01410768211032850. Epub 2021 Jul 15
- Nabavi Long covid: how to define it and how to manage it. BMJ. 2020; 370. DOI:10.1136/bmj.m3489.m3489. [PubMed] [CrossRef] [Google Scholar]
- Garg P., Arora U., Kumar A., Wig N. The «post-COVID» syndrome: how deep is the damage? J Med 2020 Aug DOI:10.1002/ jmv.26465. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lucas C., Fernández F., Bañón S. et al. Impact of circulating SARS-CoV-2 variants on mRNA vaccine-induced immunity. Nature 2021; 600: 523–529.
- Kemp S. A., Collier D. A., Datir R. P. et al. SARS-CoV-2 evolution during treatment of chronic infection. Nature 2021; 592: 277–28
- Rydyznski Moderbacher , Kim C., Mateus J. et al. Antigen-Specific Adaptive Immunity to SARS-CoV-2 in Acute COVID-19 and Associations with Age and Disease Severity. Cell. 2020; 183: 996–1012
- McMahan K., Yu J., Mercado N. B., Loos C. et al. Correlates of protection against SARS-CoV-2 in rhesus Nature 2021; 590: 630–634.
- Grifoni A., Weiskopf D., Ramirez S. I. et al. Targets of T Cell Responses to SARS-CoV-2 Coronavirus in Humans with COVID-19 Disease and Unexposed Cell.2020; 181: 1489–1501.
- Le Bert , Tan A. T., Kunasegaran K. et al. SARS-CoV-2-specific T cell immunity in cases of COVID-19 and SARS, and uninfected controls. Nature 2020; 584: 457–462.
- Low S., Vaqueirinho D., Mele Fet al. Clonal analysis of immunodominance and cross-reactivity of the CD4 T cell response to SARS-CoV-2. Science. 2021; 372: 1336–1341.
- Sette A., S. Crotty S. Pre-existing immunity to SARS-CoV-2: the knowns and Nat. Rev. Immunol. 2020; 20: 457–458.
- Guthmiller J. J., Wilson P. C. Remembering seasonal coronaviruses. 2020; 370: 1272–1273.
- Tan А. , La Gruta N. L., Zeng W., Jackson D. C. Precursor frequency and competition dictate the HLA-A2-restricted CD8+ T cell responses to influenza A infection and vaccination in HLA-A2.1 transgenic mice. J. Immunol. 2011; 187: 1895–1902.
- L.B. Rodda, J. Netland, L. Shehata, K. B. et al. Functional SARS-CoV-2-specific immune memory persists after mild COVID-19. Cell 2021; 184:169–183.
Відомості про авторів:
Дьяченко П. А. — к. м. н., завідувач відділу нейроінфекції Центру інфекційних уражень нервової системи ДУ «Інститут епідеміології та інфекційних хвороб імені Л. В. Громашевського НАМН України».
ORCID 0000-0002-0459-9861
Панасюк О. Л. — д. м. н, керівник Центру інфекційних уражень нервової системи ДУ «Інститут епідеміології та інфекційних хвороб імені Л. В. Громашевського НАМН України». ORCID: 0000-0002-5849-6606
Андрєєва О. Г. — к. м. н., с. н. с. відділу нейроінфекції Центру інфекційних уражень нервової системи ДУ «Інститут епідеміології та інфекційних хвороб імені Л. В. Громашевського НАМН України».
Клюс В. Ю. — к. м. н., с. н. с. відділу нейроінфекції Центру інфекційних уражень нервової системи ДУ «Інститут епідеміології та інфекційних хвороб імені Л. В. Громашевського НАМН України».
Пархомець Б. А. — н. с. відділу нейроінфекції Центру інфекційних уражень нервової системи ДУ «Інститут епідеміології та інфекційних хвороб імені Л. В. Громашевського НАМН України».
Information about the authors:
Dyachenko P. A. — PhD of medicine, Head of the department of neuroinfection Cеntег of infectious disorders of the nervous system, SI «L. V. Hromashevskyi institute of epidemiology and infection diseases of NAMS of Ukraine».
ORCID 0000-0002-0459-9861
Panasyuk O. L. — Doctor of Medicine, Head of the Center for Infectious Diseases of the Nervous System of the SI «L. V. Hromashevskyi Institute of Epidemiology and Infectious Diseases of National Academy of Medical Sciences of Ukraine».
ORCID: 0000-0002-5849-6606
Andreeva O. G. — PhD of medicine, senior researcher of the department of neuroinfections of the Center for Infectious Lesions of the Nervous System of the SI «L. V. Hromashevskyi Institute of Epidemiology and Infectious Diseases of National Academy of Medical Sciences of Ukraine».
Klyus V. Yu. — PhD of medicine, senior researcher of the department of neuroinfections of the Center for Infectious Lesions of the Nervous System of the SI «L. V. Hromashevskyi Institute of Epidemiology and Infectious Diseases of National Academy of Medical Sciences of Ukraine».
Parkhomets B. A. — a researcher at the neuroinfection department of the Center for Infectious Lesions of the Nervous System of the SI «L. V. Hromashevskyi Institute of Epidemiology and Infectious Diseases National Academy of Medical Sciences of Ukraine».
