Предиктори відповіді на терапію Софосбувір + Ледіпасвір пацієнтів, інфікованих 1 генотипом HCV
УДК 616-036-085+578.833.2
С. В. Федорченко, Ж. Б. Клименко, Т. Л. Мартинович, І. В. Соляник, В. А. Резник, К. О. Загірська, А. І. Афанасьєва
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України»
Встановлено, що терапія софосбувір+ледіпасвір хворих на ХГС з 1-им генотипом HCV є високоефективною і дозволяє досягти СВВ у 98,87% пацієнтів з різним ступенем фіброзу. Показано, що вірогідність досягнення СВВ у таких хворих не залежить від вірусного навантаження, ступеня фіброзу та кінетики віремії у перші чотири тижні лікування.
Ключові слова: хронічний гепатит С, генотип 1, софосбувір+ледіпасвір, HCV-інфекція.
Response predictors to the sofosbuvir+ledipasvir therapy of patients with genotype 1 hcv infection
SI “The Lev Gromashevsky Institute of Epidemiology and Infectious Diseases of NAMS of Ukraine”
It was established that the the sofosbuvir+ledipasvir therapy of chronic hepatitis C patients with genotype 1 HCV infection is highly efficient and makes it possible to achieve a sustained viral response (SVR) with 98.87% of patients with various fibrosis rate. The research proved that the probability of achievement of
SVR of such patients does not depend on the viral load, fibrosis rate and/or viremia kinetics within first four weeks of treatment.
Key words: chronic hepatitis C, genotype 1, sofosbuvir+ledipasvir, HCV infection.
Захворюваність на хронічний вірусний гепатит С (ХГС) і смертність від його наслідків у світі невпинно зростає, незважаючи на про-
філактичні заходи [1–4]. Найчастішою причиною формування цирозу печінки (ЦП), гепатоцелюлярної карциноми (ГЦК) та смертності, пов’язаної з цим, а також проведених і запланованих трансплантацій печінки у світі є хронічна НСV-інфекція [5, 6].
За оцінками ВООЗ, у світі приблизно 71 млн людей хворіє на хронічну НСV-інфекцію, причому щороку реєструється близько 1,5 млн нових випадків. Приблизно 3,2 млн підлітків і дітей мають ХГС [7]. За оціночними даними ДУ МОЗ України «Центр громадського здоров’я», станом на 2020 р. 1 342 418 осіб інфіковано вірусом гепатиту С (НСV), під медичним наглядом перебуває 87 269 осіб, що становить 6,5% від оціночної кількості.
За підтримки ВООЗ, із залученням національних експертів у сфері епідеміології та лікування ВГ, для України були розроблені сценарії елімінації вірусних гепатитів В (ВГВ) та С (ВГС). У рамках розроблених сценаріїв, на основі попередньо проведеної тріангуляції даних щодо вірусних гепатитів (ВГ), було розраховано скільки хворих необхідно лікувати щорічно, щоб досягти запланованих очікувань ВООЗ до 2025 і 2030 років. Для досягнення глобальних цілей в Україні щодо ВГС мали отримати лікування 15 000 хворих у 2019 р., в 2020 р. — 25 000, в
2021 р. — 45 000, з 2022 до 2025 рр. — 60 000 людей щорічно. Після 2025 р. необхідно лікувати не менше 100 000 хворих на рік. Згідно з іншим варіантом сценарію, для досягнення 50% глобальних цілей з елімінації у 2019 р. необхідно було пролікувати мінімум 7 000 хворих, в 2020 р. — 10 000, в 2021 р. — 25 000, з 2022 до 2025 рр. — 32 000 щорічно. Після 2025 р. необхідно забезпечувати лікуванням 49 000 хворих на рік. Розроблено основні та допоміжні індикатори контролю за епідемією ВГС, до яких входить вивчення поширеності та рівня захворюваності на HCV-інфекцію [6].
Лікування інтерферонами, яке проводилось у минулі роки, пов’язане з низкою побічних ефектів, серед яких грипоподібний симптом, депресія та цитопенія. Побічні ефекти рибавірину включали ге-молітичну анемію, втому, свербіж та висип [7, 8, 9].Нові схеми лікування противірусними препаратамипрямої дії зменшили частоту захворюваності та тяж-кість побічних явищ, спростили лікування пацієнтів ізHCV-інфекцією і забезпечили можливість лікування пацієнтів, які мали протипоказання до лікування інтерфероном або рибавірином.
Ледіпасвір — інгібітор HCV NS5A з потужною противірусною активністю щодо генотипів HCV 1a та 1b. Софосбувір — інгібітор полімеразної нуклеїдної кислоти NS5B, затверджений для лікування генотипів HCV 1–4 [10, 11]. Дослідження ION-1, -2, -3 продемонструвало у пацієнтів, які раніше отримували ПВТ та наївних пацієнтів, зокрема з компенсованим цирозом, досягнення стійкої вірусологічної відповіді (СВВ) у 94–99% випадків після 12 тижнів лікування софосбувіром+ледіпасвіром [12].
Метою нашого дослідження було визначення позитивних та негативних предикт-факторів досягнення СВВ на терапію софосбувір+ледіпасвір у групі хворих на ХГС з 1 генотипом НСV.
Завданнями дослідження було встановлення залежності індукції СВВ від ступеня фіброзу печінки, стартового рівня віремії, кінетики негативації РНК-НСV.
Матеріали і методи. У дослідження увійшли 443 хворих на ХГС з 1-м генотипом НСV, які знаходились на стаціонарному та амбулаторному лікуванні у відділенні вірусних гепатитів ДУ «Інститут епідеміології та інфекційних хвороб НАМН України» та отримували противірусну терапію софосбувір+ледіпасвір протягом 12 тижнів з або без рибавірину за- лежно від ступеня фіброзу печінки в рамках програми лікування ХГС.
Генотип ВГС визначали з використанням аналізу VERSANT HCV Genotype 2.0 (LiPA; Siemens Medical Solutions Diagnostics, Tarrytown, NY). Усі аналізи проводились відповідно до інструкцій виробника. Рівні РНК ВГС у плазмі також вимірювали за допомогою аналізу COBAS Tag Man RNA HCV, версія 1.0 (Roche), з нижньою межею кількісного визначення 43 МО/мл та нижньою межею виявлення 12 МО/мл у певні клінічні моменти часу. РНК HCV у кількісному тесті < 2 000 000 МО/мл вважалось низьким,
> 2 000 000 — високим (EASL – 2018).
Були проаналізовані такі показники:
- ступінь фіброзу печінки за METAVIR;
- вірусне навантаження (ВН) на початку лікування;
- кінетика РНК HCV — досягнення швидкої вірусологічної відповіді (ШВВ) на 4-ому тижні лікування; ПЛР, якісний тест;
- досягнення стійкої вірусологічної відповіді (СВВ) на 12 тижні після завершення лікування; ПЛР, якісний тест.
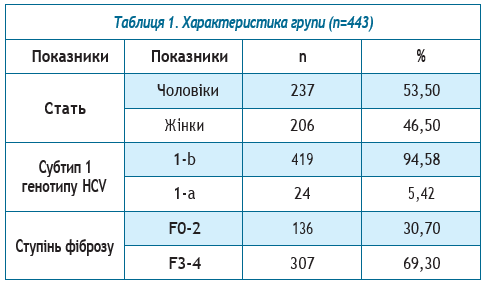
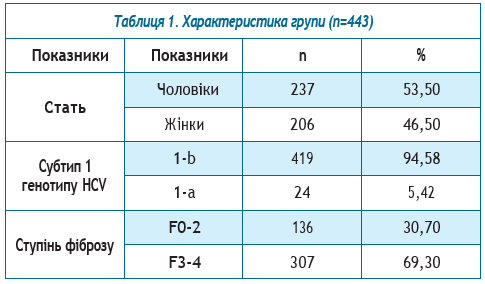
Результати досліджень та їх обговорення. У досліджуваній групі було 237 чоловіків (53,50%) та 206 жінок (46,50%) у віці від 20 до 85 років; загальний середній вік склав 51,49±0,63, середній вік чоловіків — 48,44±0,84 р., жінок — 55±0,88 року.
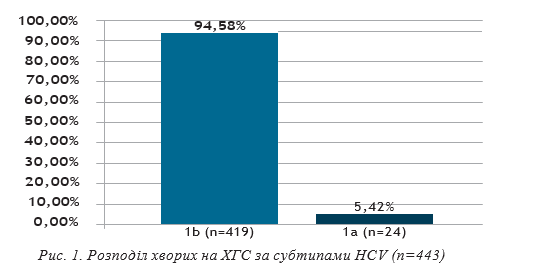
За субтипами HCV хворі розподілилися так:
1b генотип HCV був встановлений у 419 осіб (94,58%), 1а — у 24 (5,42%).
З 24 хворих з 1а субтипом НСV переважну більшість склали чоловіки — 21 (87,5%) (таблиця 1).
Активність АлАТ коливалась у межах від нормальних показників (до 40 ОД/л) з мінімальним показником 10 ОД/л до високих (вище 100 ОД/л) з максимальним значенням у загальній групі 481 ОД/л. Нормальна активність АлАТ у загальній групі була зафіксована у 84 (18,96%) осіб, помірна та висока — у 359 (81,04%).
Активність АсАТ коливалась у межах від нормальних показників (до 40 ОД/л) з мінімальним показником 12 ОД/л до високих (вище 100 ОД/л) з максимальним значенням у загальній групі 557 ОД/л. Нормальні показники активності АсАТ у загальній групі мали 118 пацієнтів (26,64%), високі та помірно підвищені — 325 (73,36%).
Вірусне навантаження вважали низьким при значенні РНК HCV у сироватці крові в кількісному тесті
< 2 000 000 МО/мл, високим — > 2 000 000 МО/мл. У загальній групі 318 хворих (71,78%) мали низьке вірусне навантаження, 125 (28,22%) — високе.
Фіброз печінки визначали за шкалою MЕTAVIR згідно з даними фіброскану або еластографії печінки методом зсувної хвилі. Залежно від ступеню фіброзу пацієнтів було розділено на 2 групи. І група — з нормальними та помірно підвищеними показниками щільності печінкової паренхіми — F0-2 та ІІ група — з високим ступенем фіброзу та з компенсованим цирозом печінки — F3-4.
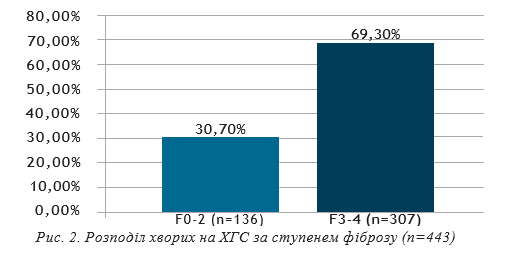
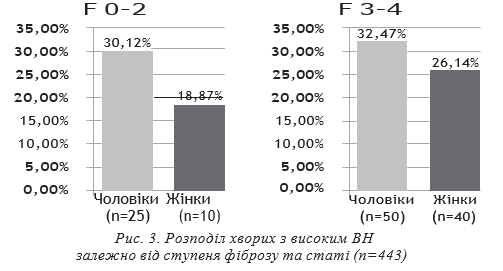
Мінімальний фіброз печінки F0-2 визначався у 136 хворих (30,70%), серед них чоловіків — 83 (61,03%), жінок — 53 (38,97%). У групу не ввійшли пацієнти з декомпенсованим цирозом печінки. 1b субтип НСV визначався у 126 (92,65%) пацієнтів, у 10 (7,35%) — 1а субтип НСV. Середній вік хворих у загальній групі склав 53,13±0,74 р., чоловіків — 47,79±1,09 р., жінок —56,17±1,01 року. У 101 хворого (74,26%) було низькевірусне навантаження, у 35 (25,74%) — високе. Нор-мальна активність АлАТ визначалась у 36 (26,47%)осіб, помірна та висока — у 100 (73,53%). Нормаль-ні показники активності АсАТ були у 62 пацієнтів(45,59%), високі та помірно-підвищені — у 74 (54,41%).У групі чоловіків з мінімальним фіброзом (n=83) у58 хворих (69,88%) було визначено низьке вірусненавантаження, у 25 (30,12%) — високе. Нормальна активність АлАТ визначалась у 15 (18,07%) осіб, помірна та висока — у 68 (81,93%). Нормальні показники активності АсАТ були у 33 пацієнтів (39,76%), високі та помірно підвищені — у 50 (60,24%).
У групі жінок з мінімальним фіброзом (n=53) у 43 хворих (81,13%) було низьке вірусне навантаження, у 10 (18,87%) — високе. Нормальна активність АлАТ визначена у 21 особи (39,62%), помірна та висока — у 32 (60,38%). Нормальні показники активності АсАТ у групі були у 29 пацієнток (54,72%), високі та помірно підвищені — у 24 (45,28%) хворих.
Ступінь фіброзу F3-4 діагностували у 307 (69,30%) пацієнтів, серед них 154 чоловіки (50,16%) та 153 жінки
(49,84%). 1b субтип НСV був визначений у 293 (95,44%) пацієнтів і лише у 14 (4,54%) — 1а субтип НСV. Середній вік хворих склав 53,13±0,74, чоловіків — 50,12±1,04, жінок — 56,17±1,01. У 217 хворих (70,68%) було низьке вірусне навантаження, у 90 (29,32%) — високе. Нормальна активність АлАТ визначена у 48 (15,64%) осіб, помірна та висока — у 259 (84,36%). Нормальні показники активності АсАТ визначені у 56 пацієнтів (18,24%), високі та помірно підвищені — у 251 (81,76%).
У групі чоловіків з фіброзом F3-4 (n=154) у 104 хворих (67,53%) було низьке вірусне навантаження, у 50 (32,47%) — високе. Нормальна активність АлАТ визначена у 20 (12,99%) осіб, помірна та висока — у 134 (87,01%). Нормальні показники активності АсАТ у групі мали 25 пацієнтів (16,23%), високі та помірно підвищені — 129 (83,77%).
У групі жінок з фіброзом F3-4 (n=153) 113 хворих (73,86%) мали низьке вірусне навантаження,
40 (26,14%) — високе. Нормальна активність АлАТ визначалась у 28 (18,30%) осіб, помірна та висока — 125 (81,70%). Нормальні показники активності АсАТ у групі мала 31 пацієнтка (20,26%), високі та помірно підвищені — 122 (79,74%).
Варто зауважити, що 32 хворих (7,22%) на ХГС з 1b субтипом у загальній групі мали в анамнезі неуспіх попереднього лікування, тобто для них теперішній курс противірусної терапії (ПВТ) був повторним (переліковування після противірусної терапії (ПВТ) ПЕГ+РИБ або ПЕГ+СОФ+РИБ).
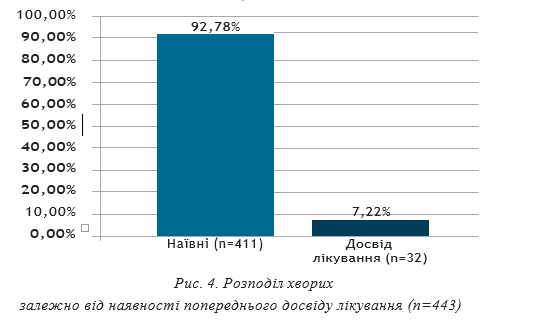
Фіброз печінки F3-4 встановлений у 14 з 32 хворих (43,75%), із них — у 6 (42,86%) чоловіків та 8 (57,14%) жінок. У хворих зі ступенем фіброзу F0-2 неуспіх попереднього лікування був у 18 (56,25%) пацієнтів, з них — у 10 (55,56%) чоловіків та у 8 (44,44%) жінок.
Швидка вірусологічна відповідь (ШВВ) — відсутність реплікації РНК НСV на 4 тижні ПВТ спостерігалась у 429 (96,84%) хворих і лише у 14 (3,16%) пацієнтів РНК НСV виявлялась у якісному тесті в сироватці крові.
Аналізуючи активність АлАТ та АсАТ на 4 тижні ПВТ, виявлено наявність цитолітичного синдрому лише у 13 (2,95%) та 25 (5,67%) хворих відповідно, тобто у 97,05% та 94,33% відмічалась нормалізація активності печінкових ензимів.
СВВ зафіксована у 438 (98,87%) пацієнтів. Серед усіх пацієнтів, які отримували лікування софосбувіром+ледіпасвіром, рецидив спостерігався у 5 хворих (1,13%), серед них — у 3 чоловіків (60%) і у 2 жінок (40%). Високе вірусне навантаження на старті ПВТ визначалось у 3 осіб (60%), низьке — у 2 (40%).
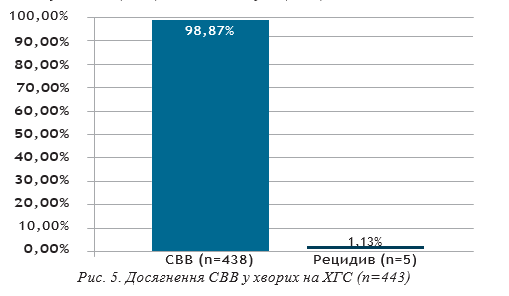
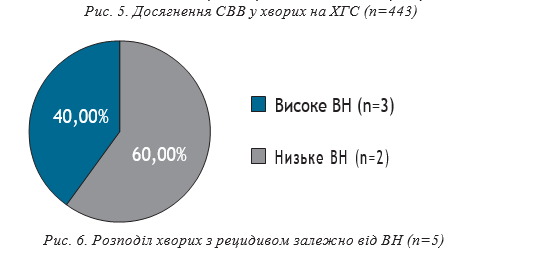
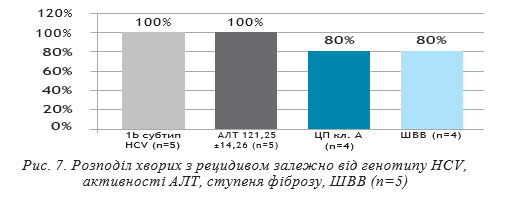
У всіх 5 хворих з рецидивом визначався 1b субтип НСV, виражений цитолітичний синдром на старті ПВТ (АлАТ 121,25±14,26 ОД/л, АсАТ 150,25±20,83 ОД/л). Цироз печінки (клас А за Чайлд-П’ю) діагностований у 4 хворих, F0 — у 1. ШВВ встановлена у 4 хворих, в одного хворого РНК НСV визначалась у якісному тесті на 4 тижні ПВТ.
Висновки
- Противірусна терапія софосбувір+ледіпасвір є високоефективною у хворих на ХГС з 1 генотипом НСV — СВВ зареєстрована у 98,87% пацієнтів.
- Рецидив спостерігався лише у 1,13% пацієнтів. Всі пацієнти з рецидивом мали 1b генотип НСV.
- Вірогідність досягнення СВВ у хворих на ХГС з 1 генотипом НСV, які отримували лікування софосбувіром+ледіпасвіром, не залежить від стартового вірусного навантаження, ступеня фіброзу та кінетики віремії в перші 4 тижні лікування.
Література
- GBD 2016 Disease and Injury Incidenceand Prevalence Collaborators. Global, regional, andnationalincidence, prevalence, and years lived with disability for 328 diseases and injuriesfor 195countries, 1990–2016: a systematic analysis for the Global Burden of Disease Study 2016. (2017) The Lancet. Sep 16;390(10100):1211-1259. doi: 10.1016/S0140-6736(17)32154-2.
- GBD 2016 Mortality Global, regional, andnational under-5 mortality, adultmortality, age-specifi c mortality, andlifeexpectancy, 1970–2016: a systematic analysis for the Global Burden of Disease Study 2016. The Lancet. 14 Sept 2017: 390;1084– 1150. DOI: https://doi.org/10.1016/S0140-6736(17)31833-0.
- Global Burden of Disease Liver Cancer Collaboration. The burden of primary liver cancer and underlying etiologies from 1990 to 2015 at the global, regional, and national (2017) JAMA Oncology. 5 Oct 2017. doi:10.1001/jamaoncol.2017.3055.
- Щорічна доповідь про стан здоров’я населення, санітарно-епідемічну ситуацію та результати діяльності системи охорони здоров’я України. 2016 рік / МОЗ України, ДУ «УІСД МОЗ України». Київ, 516 с. https://library.gov.ua/shhorichna-dopovid-pro-stan-zdorov-ya-naselennya-sanitarno-epidemichnu-sytuatsiyu-ta-rezultaty-diyalnosti-system-ohorony-zdorov-ya-ukrayiny-2016-rik/
- Вивчення якості життя хворих на хронічний вірусний гепатит С / Шевченко-Макаренко О. П., Шостакович-Корецька Л. Р., Чикаренко З. О., Ткаченко В. Д., Лісніча О. О. // Медичні перспективи. 2017. Т. 22, №4. С. 81–86. https://doi.Org/10.26641/2307-0404.2017.4.117677.
- WHO. Global Hepatitis Report. Geneva: (2017) WHO; 2017 April, P.13–14.
- Afdhal , Dieterich D., Pockros P. et al. Epoetin alfa maintains ribavirin dose in HCV-infected patients: a prospective, double-blind, randomized controlled study// Gastroenterology. 2004. Vol. 126. P. 1302–1311.
- Barbaro G., Grisorio B., Fruttaldo L. et al. Good safety profile and efficacy of leucocyte interferon-alpha in combination with oral ribavirin in treatment-naive patients with chronic hepatitis C: a multicentre, randomised, controlled study // BioDrugs. – 17 (6). P. 433–439.
- Dev , Patel K., Muir A., McHutchison J. G. Erythropoietin for ribavirininduced anemia in hepatitis C: more answers but many more questions // Am. J. Gastroenterol. 2003. Vol. 98 (11). P. 2344–2347.
- Afdhal , Reddy K. R., Nelson D. R. et al. Ledipasvir and sofosbuvir for previously treated HCV genotype 1 infection. N Engl J Med 2014;370:1483-93.
- Kowdley K. V., Gordon S. C., Reddy K. R., et al. Ledipasvir and sofosbuvir for 8 or 12 weeks for chronic HCV without N Engl J Med 2014;370:1879-88.
- Treatment with ledipasvir and sofosbuvir improves patientreported outcomes: Results from the ION-1, -2, and -3 clinical trialsHepatology 2015;61:1798–1808.
Відомості про авторів:
Федорченко С. В. – д. м. н., завідувач відділу вірусного гепатиту та СНІД, ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ.
E-mail: fedorchenkosv@i.ua
Клименко Ж. Б. – к. м. н., старший науковий співробітник, лікар консультативної поліклініки ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ
Мартинович Т. Л. – к. м. н., старший науковий співробітник, в.о. заступника директора з лікувальної роботи ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ
Соляник І. В. – науковий співробітник, відділу вірусного гепатиту та СНІД, ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ.
Резник В. А. – лікар відділення вірусного гепатиту та СНІД, ДУ «Інститут епідеміології та інфекційних хвороб ім. Л.В.Громашевського НАМН України», Київ.
Загірська К. О. – завідувачка консультативної поліклініки ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ
Афанасьєва Г. І. – лікар консультативної поліклініки ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», Київ
Information about the authors:
Fedorchenko S. V. – Doctor of Medicine, Head of the Department of Viral Hepatitis and AIDS, SI “L. V. Gromashevsky Institute of Epidemiology and Infectious Diseases of National Academy of Sciences of Ukraine”, Kyiv.
E-mail: fedorchenkosv@i.ua
Klymenko Zh. B. – PhD of medicine, senior researcher, doctor of the consulting polyclinic of the SI “L. V. Gromashevsky Institute of Epidemiology and Infectious Diseases of National Academy of Sciences of Ukraine”, Kyiv.
Martynovych T. L. – PhD of medicine, senior researcher, deputy director for medical work of the SI “L. V. Gromashevsky Institute of Epidemiology and Infectious Diseases of National Academy of Sciences of Ukraine”, Kyiv.
Solyanyk I. V. – researcher, department of viral hepatitis and AIDS, SI “L. V. Gromashevsky Institute of Epidemiology and Infectious Diseases of National Academy of Sciences of Ukraine”, Kyiv.
Reznyk V. A. – doctor of the department of viral hepatitis and AIDS, SI “L. V. Gromashevsky Institute of Epidemiology and Infectious Diseases of National Academy of Sciences of Ukraine”, Kyiv.
Zahirska K. O. – head of the consulting polyclinic of the SI “L. V. Gromashevsky Institute of Epidemiology and Infectious Diseases of National Academy of Sciences of Ukraine”, Kyiv.
Afanasyeva H. I. – doctor of the consulting polyclinic of the SI “L. V. Gromashevsky Institute of Epidemiology and Infectious Diseases of National Academy of Sciences of Ukraine”, Kyiv.
