Біологічні властивості Helicobacter pylori та сучасні методи діагностики Гелікобактеріозу (проблемна лекція)
УДК 616.33-002.44-022.7-053.3
Д. Л. Кирик, О. І. Нікольська, А. П. Брудько, О. К. Єркін
Національний університет охорони здоров’я України ім. П. Л. Шупика, м. Київ, Україна
Широка розповсюдженість та високий рівень інфікованості населення нашої планети, етіопатогенетичний зв’язок H. pylori з найбільш значущими захворюваннями шлунка та дванадцятипалої кишки диктують необхідність оптимізації діагностики цієї інфекції з урахуванням чутливості та специфічності тестів, а також умов їх проведення. До призначення терапії збудника має бути виявлено, а після лікування — підтверджено його ерадикацію. Тяжкість хронічних захворювань гелікобактеріозної етіології залежить від ступеня патогенності штамів, наявності тих чи інших цитотоксичних генів. У лекції проаналізовано сучасну інформацію щодо біологічних властивостей збудника гелікобактеріозу та методи його діагностики. Їх можна розділити на інвазивні (передбачають взяття біопсії при ендоскопічному дослідженні) та неінвазивні. Серед інвазивних виділяють бактеріологічний та морфологічний методи дослідження. Гістологічний метод визнаний «золотим стандартом» діагностики гелікобактеріозу. Суть методу полягає у виготовленні препаратів слизової оболонки шлунка та їх фарбуванні за Гімзою з метою виявлення бактеріальних клітин у препараті. Метод дозволяє визначити особливості збудника та оцінити стан слизової оболонки шлунка. Бактеріологічний метод вважається незамінним для перевірки штамів щодо резистентності до тих чи інших антибактеріальних препаратів, що дозволяє прогнозувати результати лікування. В даний час найбільшого поширення набули неінвазивні методи діагностики. Поряд із дихальним уреазним тестом використовують серологічні методи (імуноферментний аналіз, імуноблотинг), а також імунохроматографічний метод. Молекулярний метод діагностики, а саме ПЛР застосовується для вивчення генотипових та фенотипових характеристик штамів H. pylori у зразках біопсії шлунка, слини, випорожнень, шлункового соку, зубного нальоту. ПЛР забезпечує відмінну чутливість та специфічність, понад 95%, порівняно з іншими тестами, і має більш точні результати виявлення H. pylori у пацієнтів із кровотечею. Накопичена за цей період часу інформація дозволить сформувати принципово новий персоніфікований підхід до комплексного обстеження пацієнтів і визначити альтернативні варіанти терапії з урахуванням особливостей генотипу та популяційної належності збудників гелікобактеріозу.
Ключові слова: гелікобактеріоз, цитотоксичні гени, інвазивні тести, неінвазивні тести, дихальний уреазний тест, імунохроматографічний метод, молекулярно-генетичний метод, персоніфікований підхід.
Biological properties of helicobacter pylori and modern methods of diagnosing Helicobacteriosis (problematic lecture)
D. L. Kyryk, O. I. Nicolska, A. P. Brudko, O. K. Yerkin
The widespread and high level of infection of the world’s population, the etiopathogenetic relationship of H. pylori with the most significant diseases of the stomach and duodenum dictates the need to optimize the diagnosis of this infection, taking into account the sensitivity and specificity of tests, as well as the conditions of their implementation. Before prescribing therapy, the pathogen must be identified, and after treatment, its eradication must be confirmed. The severity of chronic diseases of helicobacter etiology depends on the degree of pathogenicity of the strains, the presence of certain cytotoxic genes. The lecture analyzes the current information on the biological properties of the helicobacter pathogen and methods of its diagnosis. They can be divided into invasive, which involve taking a biopsy during endoscopic examination, and non-invasive. Among the invasive ones, bacteriological and morphological methods of examination are distinguished. The histological method is recognized as the “gold standard” for the diagnosis of helicobacteriosis. The essence of the method is the preparation of gastric mucosa preparations and their Gram staining to detect bacterial cells in the preparation. The method allows to determine the characteristics of the pathogen and assess the condition of the gastric mucosa. The bacteriological method is indispensable for testing strains for resistance to certain antibacterial drugs, which allows predicting the results of treatment. Currently, non-invasive diagnostic methods are the most widely used. Along with the respiratory urease test, serological methods (enzyme-linked immunosorbent assay, immunoblotting) and immunochromatographic methods are used. The molecular diagnostic method, namely PCR, is used to study the genotypic and phenotypic characteristics of H. pylori strains in samples of gastric biopsy, saliva, stool, gastric juice, and plaque. PCR provides excellent sensitivity and specificity, more than 95%, compared to other tests, and has more accurate results in detecting H. pylori in patients with bleeding. The information accumulated over this period of time will allow us to form a fundamentally new personalized approach to the comprehensive examination of patients and to develop alternative therapies based on the genotype and population of helicobacter pathogens.
Key words: helicobacteriosis, cytotoxic genes, invasive tests, non-invasive tests, breath urease test, immunochromatographic method, molecular genetic method, personalized approach.
З моменту відкриття в 1983 р. австралійськими вченими B. Marshall та J. Warren бактерій Helicobacter pylori (H. pylori), науковий інтерес
до цього мікроорганізму продовжує зростати. Бактерія була спочатку названа Campylobacter pyloridis, згодом Campylobacter pylori (після корекції назви відповідно до латинської граматики), і лише в 1989 році, після того, як аналіз послідовностей ДНК цієї бактерії показав, що насправді вона не належить до роду Campylobacter, її та близькі до неї види виділили в окремий рід Helicobacter [1]. Згідно з даними літератури, H. pylori інфіковано 80,0–90,0% жителів країн Азії та Африки, 40,0–80,0% жителів Східної Європи та Південної Америки, 25,0–40,0% населення розвинених країн Європи та Північної Америки [2, 3]. Бактерії H. pylori у 70,0–80,0% випадків є причиною розвитку хронічного гастриту, у 50,0–60,0% випадків — найважливішим фактором патогенезу виразкової хвороби дванадцятипалої кишки і шлунка та у понад 90,0% пацієнтів викликають розвиток MALT-лімфом шлунка [4]. Все це зумовлює актуальність вивчення біологічних особливостей збудника гелікобактеріозу та розробки нових методів діагностики для оптимізації сучасного алгоритму його лікування.
H.pylori — дрібні, мікроаерофільні, грамнегативні, не спороутворюючі бактерії, за формою являють собою S-подібні або злегка вигнуті палички. У зв’язку зі старінням бактеріальної культури або за несприятливих впливів зовнішнього середовища можуть переходити в кокову форму. Товщина бактеріальної клітини становить 0,5–1,0 мкм, довжина — 2,5–3,5 мкм. Зверху клітина покрита гладкою оболонкою, на одному з полюсів є 1–6 однакових за розміром джгутиків. Зовні від мембрани бактерії розташований електроннощільний глікокалікс товщиною більше 40 нм, до складу якого входять вуглеводомісткі полімери, що забезпечують адгезію. Бактерії
H.pylori є мікроаерофілами, що потребують оптимального вмісту кисню для вирощування — не більше 5,0%, азоту — 85,0%, вуглекислого газу — 10,0%. В анаеробних умовах гелікобактерії не ростуть. Сприятливими умовами для життя та розмноження мікроорганізмів є температура 37 °С. У процесі еволюції бактерії набули необхідних властивостей для проживання в кислому середовищі шлунка: H. pylori зберігають життєздатність при pH 1,0–1,5 протягом 30 хвилин у присутності 0,05 М сечовини [5].
Для культивування H. pylori використовують середовища з додаванням 5,0–10,0% крові або сироватки тварин (коня, барана), а також шоколадний агар (при цьому використовуються лізовані нагріванням еритроцити, тому кров набуває шоколадного кольору, а ростові речовини стають доступнішими для клітин). Селективність живильного середовища досягається додаванням антибіотиків (ванкоміцину, поліміксину, ністатину, амфотерицину тощо). До ростових добавок також відносять яєчний жовток, крохмаль, вугілля [6]. На вологих живильних середовищах бактерії ростуть у вигляді глянсової плівки. На підсушених агарових середовищах через 48–72 год утворюються прозорі, близько 1 мм у діаметрі, глянсові колонії. На рідких живильних середовищах бактерії ростуть із дуже слабким його помутнінням та формуванням сіро-блакитної плівки на поверхні. При використанні загальноприйнятих методів дослідження ферментативну активність щодо вуглеводів виявити не вдається. Більшість штамів утворюють каталазу, оксидазу, редукують нітрати, виробляють лужну фосфатазу, алкогольдегідрогеназу, ліпазу, уреазу. Для диференціювання від бактерій сімейства Campylobacteriaceae використовують тести до здатності виділених штамів рости в середовищах, що містять 2,3,5-трифенілтетразолін хлорид (0,4 та 1 мг/л), селеніт натрію (0,1%), гліцин (1,0%), а також відсутність росту в 8,0% розчині глюкози та 3,5% хлориду натрію. H. pylori на відміну від кампілобактерій чутливі до цефалотину та стійкі до налідиксової кислоти [7].
H. pylori мають низку факторів патогенності, які умовно можна поділити на фактори колонізації, фактори персистенції та фактори, що викликають захворювання. Рухливість — головний фактор колонізації, пов’язаний з наявністю джгутиків, що забезпечують швидке пересування мікроорганізмів у шарі густого слизу вздовж градієнта рН. Джгутики представлені комплексом білків — флагеллінами HpaA, FlaA, FlaB, FlaD, FlgK. Крім рухливості, важливу роль у процесі колонізації слизової оболонки шлунка грає механізм захисту бактерій від його кислого середовища. Для цього клітини оточені щільною гладкою клітинною стінкою та глікокаліксом, які не лише захищають бактерії від низького рН середовища, а й сприяють антибіотикостійкості та захисту мікроорганізмів від імунної відповіді господаря. До складу глікокаліксу входять ліпополісахариди та білки, які необхідні для адгезії. Найважливішим фактором патогенності є адгезія H. pylori до епітеліоцитів шлунка, яка полегшує доступ мікроорганізмів до поживних речовин та доставку ефекторних молекул. Рецептори адгезії для бактерій виявлені у слизі. Це є залишки сіалових кислот, сульфогрупи глікопротеїнів, гліколіпідів, фосфоліпідів. Також виявлено здатність мікроорганізмів прикріплюватися до таких білків сполучної тканини, як колаген, ламінін, вітронектин [8]. Для створення оптимальної рН H. pylori продукують фермент уреазу, який викликає розще- плення сечовини з утворенням вуглекислого газу та аміаку, що нейтралізує соляну кислоту шлункового соку.
Активність ферменту регулюється спеціальними мембранними каналами UreI, які відкриваються при низькому рН середовища та закриваються при нейтральному. Крім цього, уреаза діє як токсин. Іони амонію, які утворюються при гідролізі сечовини, пошкоджують епітелій, що посилює запальні реакції за рахунок активації моноцитів і нейтрофілів, стимулює секрецію цитокінів, утворення радикалів кисню та окису азоту. Персистенції бактерій в організмі господаря сприяють літичні ферменти. Фосфоліпази бактерій гідролізують фосфоліпіди мембран клітин шлунку з утворенням високотоксичних лізолецитинів, а також руйнують гідрофобний шар слизу, що містить фосфоліпіди та запобіжний епітелій від прямої дії соляної кислоти та пепсину. Протеаза руйнує захисні білкові комплекси, а муциназа — білок муцин, що міститься у шлунковому слизу. Внаслідок цього навколо бактерій відбувається формування зони локального зниження в’язкості шлункового слизу, зменшуються її гідрофобні властивості та товщина, порушується шарувата структура гелю слизу. Виділення каталази дозволяє пригнічувати імунну відповідь організму, каталізує реакцію перетворення бактерицидних сполук кисню, що дозволяє уникнути деструктивного впливу з боку нейтрофілів. Інфікування H. pylori, з одного боку, призводить до пошкодження слизового бар’єру шлунка та більшої вразливості епітеліоцитів, а з іншого, підвищує агресивні властивості (кислотність) шлункового соку. Сукупність цих процесів посилює пошкодження клітин слизової оболонки шлунка, викликаючи їх дистрофію та загибель, що полегшує проникнення бактерій углиб слизової оболонки [9, 10].
Тяжкість хронічних захворювань гелікобактеріозної етіології залежить від ступеня патогенності штамів, наявності тих чи інших цитотоксичних генів. Серед них найбільше значення мають такі гени [11, 12]:
- фактори вірулентності: vacA (vacuolating cytotoxin-associated gene) — вакуолізуючий цитотоксинасоційований ген, присутній у геномах усіх штамів pylori, активує процес утворення вакуоль у клітинах епітелію, що сприяє проникненню бактерій усередину клітин. Продукт гена vacA — цитотоксин (140 кДа) — збільшує проникність мембрани клітин епітелію стосовно аніонів, порушує транспорт білків, ушкоджує цитоскелет та стимулює апоптоз клітин. Виділяють підтипи (s1a, s1b, s1c, s2) та алельні комбінації (m1 та m2) цього гена. Найбільш патогенні штами мають генотип s1/m1, а штами з генотипом s2/m2 майже не мають цитотоксичної активності [13];
- ген cagA (cytotoxic-associated gene) — цитотоксинасоційований ген, який виявляється лише у деяких штамів pylori. Крім того, ген може бути представлений у різних алельних варіаціях. Ген cagA є маркером «пулу патогенності», що містить близько 30 генів. Він є специфічним для даної бактерії, оскільки виник у зв’язку з персистенцією H. pylori у шлунку. Білок cagA асоційований з виразковою хворобою, раком шлунка та лімфомою. Його пенетрація до епітеліоцитів слизової оболонки шлунка викликає мобілізацію та реорганізацію актину, індукцію росткових факторів, продукцію різних цитокінів. Вважається, що у таких пацієнтів ризик розвитку кишкової метаплазії у 12 разів, а атрофічного гастриту у 3 рази вищий порівняно з інфікованими cagА штамами. Генотип cagА+vacA достовірно частіше асоціюється з гастродуоденальною виразкою [14];
- ген iceA (induced by contact with epithelium gene) — ген цитотоксичності, що існує у двох алельних варіантах: iceA1 та iceA2. Білок iceA є фактором, що ініціює контакт бактерії з епітеліальними клітинами;
- ген babA (blood group antigen-binding adhesion) — також має дві алелі — babA1, babA2. Їх мембранні білки гомологічні до антигенів груп крові, що призводить до утворення аутоантитіл до слизової оболонки шлунка та розвитку аутоімунного гастриту. Білки babA1, babA2 пов’язані з високою частотою розвитку виразкової хвороби дванадцятипалої кишки та є факторами адгезії до епітеліоцитів [15];
- ген dupA (duodenal ulcer promoting gene) — локалізований у пластичному регіоні геному бактерії, що спочатку був описаний як маркер розвитку виразкової хвороби дванадцятипалої кишки. Пізніше було показано його зв’язок із розвитком раку шлунка [16].
Після відкриття H. pylori як етіологічного агента захворювань шлунково-кишкового тракту людини було запропоновано багато методів діагностики. Їх можна розділити на інвазивні (передбачають взяття біопсії при ендоскопічному дослідженні) та неінвазивні. Серед інвазивних виділяють бактеріологічний та морфологічний методи дослідження. Бактеріологічний метод заснований на ідентифікації збудника шляхом посіву біоптату слизової оболонки шлунка [17]. Метод дозволяє культивувати H. pylori, ідентифікувати бактерію, вивчити її морфологічні, біохімічні та біологічні властивості, простежити фактори патогенності. Основною перевагою культурального методу є можливість проведення тестів на антибіотикочутливість для вибору оптимальних схем ерадикації та запобігання розвитку резистентності. Метод культивування має майже 100% специфічність, чутливість 76–90%, за іншими даними 50–90%. Метод досить дорогий, трудомісткий, потребує чіткого виконання алгоритму дослідження. Біологічні особливості H. рylori при культивуванні in vitro вимагають особливого транспортного середовища, середовища накопичення та середовища інкубації. Забір біоптату при ендоскопічному дослідженні має здійснюватись стерильним біопсійним зондом через стерильний зондовий канал. Отримані при ендоскопії біоптати одразу мають бути поміщені у пробірки з транспортними середовищами (Cary Blaer або Pylori-середовищем), оскільки H. pylori мікроаерофіл й швидко гине при взаємодії з киснем. У транспортному середовищі, такому як Portagerm pylori, або Стюарта, зразки біопсії можуть зберігатися протягом 24 годин при 4 °C. Після доставки в лабораторію проби підлягають обробці та посіву на спеціальні середовища. Посів матеріалу необхідно виконати у перші 2–4 години після отримання біоптату. Для культивування використовують різні живильні середовища: агар Pylori, середовище Скірроу, агар «Колумбія», агар для виділення бруцел, соєвий агар Trypticase, з додаванням цільної або лізованої крові вівці або коня. Чашки агару інкубують у мікроаерофільному середовищі (80–90% N2, 5–10% CO2, 5–10% O2) при температурі 35–37 °C протягом 5–7 днів. Надалі проводиться ідентифікація виділених культур, визначаються їх морфологічні, тинкторіальні властивості, чутливість до антибіотиків. Певна кількість помилково-негативних результатів виникає при недотриманні або неточному дотриманні таких методик дослідження, як погана якість зразків, затримка транспорту, вплив аеробного середовища. Фактори пацієнта, такі як низьке бактеріальне навантаження, кровотеча з верхніх відділів шлунково-кишкового тракту, вживання алкоголю, прийом препаратів вісмуту, антагоністів Н2-рецепторів, антибіотиків, несприятливо впливають на виділення культури. Тому необхідно відмовитися протягом двох тижнів від прийому препаратів перед проведенням культурального методу. Щоб уникнути негативних результатів через нерівномірний розподіл H. pylori в шлунку, підвищити чутливість і специфічність методу, необхідно брати кілька зразків біопсій зі слизової оболонки шлунка, два зразки з антрального відділу та два з тіла шлунка. Незважаючи на точність методу, для первинної діагностики бактеріологічний метод занадто дороговартісний і трудомісткий (середня тривалість дослідження 7 днів), він рідко використовується у звичайній клінічній практиці. Проте він незамінний для отримання штамів мікроорганізму для перевірки щодо резистентності до тих чи інших антибактеріальних препаратів, що дозволяє прогнозувати результати лікування. Метод рекомендується після двох невдалих курсів ерадикаційної терапії, для корекції лікування після повторного визначення чутливості збудника до антибіотиків.
До морфологічних методів належать гістологічний, цитологічний та імуногістохімічний [18]. Гістологічний метод визнаний «золотим стандартом» діагностики гелікобактеріозу. Суть методу полягає у виготовленні гістологічних препаратів слизової оболонки шлунка та їх фарбуванні за Гімзою з метою виявлення бактеріальних клітин у препараті. Метод дозволяє визначити особливості збудника та оцінити стан слизової оболонки шлунка. Крім виявлення у зразку H. pylori, метод дозволяє визначити ступінь обсіменіння матеріалу: слабкий — до 20 мікробних тіл у полі зору; середній — 20–50; високий — понад 50 мікробних тіл у полі зору. Імуногіcтохімічний метод є більш специфічним, ніж гістологічний метод, і має кращі аналітичні характеристики. Суть методу полягає в обробці гістологічних зрізів поліабо моноклональними антитілами до антигену, що виявляється. Недоліком методу є неможливість застосування цих антитіл для дослідження тканин фіксованих у формаліні.
Отриманий при ендоскопічному дослідженні біопсійний матеріал можна проаналізувати на наявність ДНК бактерій методом ПЛР, що має високу специфічність і чутливість, а також шляхом постановки швидкого уреазного тесту, здійснюваного за допомогою занурення біоптату в рідке або гелеподібне середовище, що містить субстрат, буфер та індикатор [19]. До переваг усіх уреазних тестів належать простота виконання та швидкість, до недоліків — непряма сутність методу, тобто виявлення не самого H. pylori, а лише його уреазної активності. Тест дає хибнонегативні результати при невисокому ступеню обсіменіння тканин, коли сумарна уреазна активність буде невисокою, а також при уреазонегативних штамах H. pylori. З іншого боку, хибнопозитивні результати пов’язані з присутністю уреазопродуцентних мікроорганізмів (протеї, псевдомонади, стрептококи та інші), особливо при тривалій 24-годинній експозиції в термостаті. У зв’язку з цим, більшу специфічність мають лише «холодні тести», тобто ті, які проводяться при кімнатній температурі, що дозволяє отримати позитивну відповідь лише на уреазу, накопичену в тканині, специфічну для H. pylori, а не ту, що виробляють бактерії в процесі культивування.
Основний недолік інвазивних методів — можливість отримання «хибно-негативних» результатів, пов’язаних із «помилкою зразка», якщо береться лише один шматочок біопсії з одного відділу шлунка. Тому рекомендується брати на дослідження кілька фрагментів слизової оболонки із різних відділів шлунка.
В даний час найбільшого поширення набули неінвазивні методи діагностики. Дихальний уреазний тест є важливим етапом у діагностиці гелікобактеріозу [20]. Суть методу полягає у визначенні у видихуваному хворим повітрі ізотопів С14 або С13, які виділяються в результаті розщеплення в шлунку хворого міченої цими ізотопами сечовини під дією уреази бактерій H. pylori. Поряд із дихальним уреазним тестом Європейська група з вивчення збудника гелікобактеріозу рекомендує використовувати серологічні методи діагностики (імуноферментний аналіз, імуноблотинг тощо) [21]. Основним недоліком серологічних методів є неможливість їх застосування для контролю ефективності ерадикаційної терапії, у зв’язку з тим, що через 12–21 місяців після ерадикації виявляється зниження рівня специфічних IgG на 20,0% і показники чутливості тесту наближаються до 93,0%.
В останні роки для імунодетекції бактерій та вірусів часто використовують високочутливий та високоспецифічний імунохроматографічний метод, який позбавлений недоліків, пов’язаних із наявністю дорогого обладнання та кваліфікованого персоналу, а також забезпечує отримання результату у короткий термін. Принцип методу заснований на тонкошаровій хроматографії та утворенні забарвленого комплексу «антиген-антитіло», візуалізація якого можлива за рахунок мічених сполук, для цього найчастіше використовують наночастинки колоїдного золота [22].
Молекулярний метод діагностики, а саме застосування ПЛР використовується для вивчення генотипових та фенотипових характеристик штамів H. pylori у зразках біопсії шлунка, слини, випорожнень, шлункового соку, зубного нальоту [23]. ПЛР забезпечує відмінну чутливість і специфічність (більше 95%) порівняно з іншими тестами, і має більш точні результати виявлення H. pylori у пацієнтів із кровотечею.
Альтернативою ПЛР методу є використання флюоресцентної гібридизації in situ (FISH) [24]. Вона є високочутливим (97%) та високоспецифічним методом (100%). При флуоресцентній гібридизації in situ використовують ДНК-зонди, що зв’язуються з комплементарними мішенями у зразку. До складу ДНК-зондів входять нуклеозиди, мічені флюорофорами (пряме мічення) або кон’югатами, як біотин або дигоксигенін. Методика заснована на обробці зрізів міченими нуклеотидами, після чого бактерії виявляються при флюоресцентній мікроскопії. З її допомогою можна ідентифікувати різноманітні штами H. pylori. Метод FISH може ідентифікувати кокоподібну форму H. pylori, яка зазвичай не виявляється шляхом рутинного гістологічного дослідження. Крім того, FISH — це швидкий, точний та економічно ефективний метод виявлення стійкості до кларитроміцину H. pylori. Обмеження цього методу включають деградацію нуклеотидів протеазами та нуклеазами, присутніми у зразку, погану проникність мікробної клітинної стінки для ДНК-зондів та низьку доступність зонда до цільової ділянки рРНК через вторинну структуру рибосоми [25]. Для молекулярної діагностики перед початком ерадикаційної терапії береться біоптат з антрального відділу шлунка під час ендоскопічного дослідження. При контролі лікування взяття біопсійного зразка проводиться не раніше ніж через 4 тижні після закінчення курсу антигелікобактерної терапії з тіла шлунка. Біоптат занурюється у стерильну суху пробірку та негайно доставляється до лабораторії. Можливе заморожування взятого біопсійного матеріалу при температурі -20 °С для більш тривалого зберігання. За наявності у пацієнтів гастродуоденальної патології у поєднанні з гінгівітом, парадонтозом можливе дослідження біопсійного матеріалу з ясен, мазка зубного нальоту, слини. Матеріал також поміщається у стерильну суху пробірку та доставляється до лабораторії для проведення ПЛР діагностики. Але частота виявлення мікроба в зубному нальоті менша, ніж у біоптаті слизової оболонки шлунка, тому ці методики в клінічній практиці не застосовуються.
Виявлення H. pylori у зразках калу (стул-тест) за допомогою ПЛР діагностики показало досить високу чутливість — 83,8% та специфічність — 98,4% [26]. У низці досліджень було виявлено високий відсоток його хибнопозитивних результатів, особливо при проведенні тесту на 4–6 тижні після успішно проведеної антигелікобактерної терапії. Хибнопозитивні результати стул-тесту у пролікованих пацієнтів можна пояснити персистенцією в організмі кокових форм збудника, кількість яких з часом зменшується і повністю зникає на 8–12 тижні. Загалом молекулярний метод дозволяє виявляти та диференціювати штами бактерії H. pylori між собою за різними ознаками, у тому числі за факторами вірулентності, такими як cagA та vacA. Також ПЛР може ідентифікувати специфічні мутації, які призводять до стійкості до антибіотиків, що дозволяє до початку терапії виявити резистентність до макролідів та фторхінолонів. Метод виявляє мікроб у будь-якій формі, у тому числі й коковій. Праймери для ПЛР отримують з нуклеотидної послідовності гена уреази А або H. pylori. Ці праймери є специфічними для всіх штамів і не виявляються в інших видах бактерій, що робить ПЛР високоспецифічним методом. Крім того, ПЛР — це найбільш чутливий метод порівняно з іншими методами діагностики гелікобактеріальної інфекції та дозволяє виявити навіть 1,47 µg ДНК. Чутливість та специфічність цього методу становлять відповідно 99% та 100% [27].
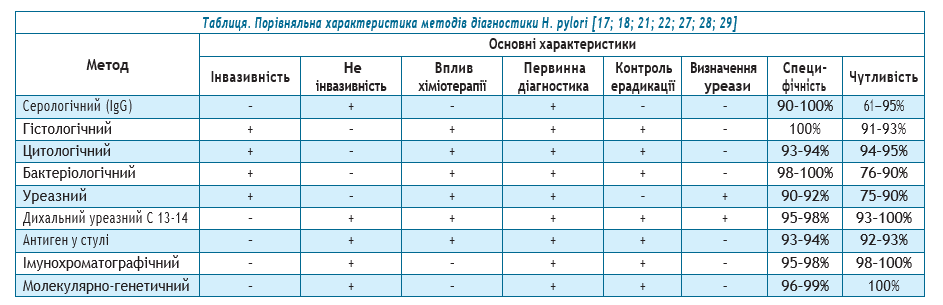
У порівняльному дослідженні найвищу специфічність показали мікробіологічний (100%), гістологічний (100%) методи; швидкий уреазний тест (91,7%); дихальний уреазний тест (87,5%); стул-тест (79,2%). Найвищу чутливість мали швидкий уреазний тест (96,0%), стул-тест (93,8%); дихальний уреазний тест (92,0%). Для пацієнтів, які проходять гастроскопію, доцільне поєднання швидкого уреазного тесту та гістологічного дослідження. У випадках протипоказань до процедури ендоскопії у хворих застосували комбінації неінвазивних тестів (дихальний уреазний тест; стул-тест) [28]. Узагальнюючу характеристику сучасних методів діагностики гелікобактеріозу представлено у таблиці.
Широка розповсюдженість та високий рівень інфікованості населення нашої планети, етіопатогенетичний зв’язок H. pylori з найбільш значущими захворюваннями шлунка та дванадцятипалої кишки диктує необхідність оптимізації діагностики цієї інфекції з урахуванням чутливості та специфічності тестів, а також умов їх проведення. До призначення терапії, збудника має бути виявлено, а після лікування — підтверджено його ерадикацію. Важливо підкреслити, що відсутність оцінки ефективності ерадикації H. pylori, з одного боку, не дозволяє документувати досягнення мети у конкретного хворого, а з іншого боку, позбавляє лікаря можливості оцінити ефективність схем лікування. Широкий арсенал діагностичних тестів при їх раціональному застосуванні забезпечує успішне вирішення цих завдань. Накопичена за цей період часу інформація дозволить сформувати принципово новий персоніфікований підхід до комплексного обстеження пацієнтів і визначити альтернативні варіанти терапії з урахуванням особливостей генотипу та популяційної належності збудників гелікобактеріозу.

Література
- Correa , Piazuelo M. B. Natural history of Helicobacter pylori infection. Dig Liver Dis. 2008 .V.40,N.7.P.490-496. doi: 10.1016/j.dld.2008.02.035.
- Hooi K. Y., Lai W.Y., Ng W. K. et al.Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017.V.153,N.2.P.420-429. doi: 10.1053/j.gastro.2017.04.022.
- Hunt R. H., Xiao S. D., Megraud F. et al. World Gastroenterology Helicobacter pylori in developing countries. World Gastroenterology Organisation Global Guideline. J Gastrointestin Liver Dis. 2011.V.20,N.3. P. 299–304. PMID: 21961099.
- Graham D. Y. History of Helicobacter pylori, duodenal ulcer, gastric ulcer and gastric World J Gastroenterol. 2014 V.20, N.18. P. 5191–5204. doi: 10.3748/wjg.v20.i18.5191.
- Krzyżek P., Gościniak G. Morphology of Helicobacter pylori as a result of peptidoglycan and cytoskeleton Prz Gastroenterol. 2018.V.13,N.3. P. 182–195. doi: 10.5114/pg.2018.78284.
- Sabbagh P., Mohammadnia-Afrouzi M., Javanian M. et al. Diagnostic methods for Helicobacter pylori infection: ideals, options, and Eur J Clin Microbiol Infect Dis. 2019. V.38. P. 55–66. https:// doi.org/10.1007/s10096-018-3414-4
- Adinortey B., Ansah C., Adinortey C. A. et al.Isolation of Helicobacter pylori from Gastric Biopsy of Dyspeptic Patients in Ghana and In Vitro Preliminary Assessment of the Effect of Dissotis rotundifolia Extract on Its Growth.J Trop Med. 2018 V.31, N10. Article ID 8071081, 6 pages. doi: 10.1155/2018/8071081.
- Denic , Touati E., De Reuse H. Review: Pathogenesis of Helicobacter pylori infection. Helicobacter. 2020. V.25, Suppl. 1.Р.e12736. doi: 10.1111/hel.12736.
- Alam , Srivastava A., Dutta A., Sau A. K. Biochemical and biophysical studies of Helicobacter pylori arginine decarboxylase, an enzyme important for acid adaptation in host.IUBMB Life. 2018. V.70, N7. P. 658–669. doi: 10.1002/iub.1754.
- Kafarski P., Talma M. Recent advances in design of new urease inhibitors: A J Adv Res. 2018. V.31, N.13. P. 101–112. doi: 10.1016/j. jare.2018.01.007.
- Matsuo , Kido Y., Yamaoka Y. Helicobacter pylori Outer Membrane Protein-Related Pathogenesis. Toxins (Basel). 2017. V.9, N.3. P. E101. doi: 10.3390/toxins9030101.
- Imkamp , Lauener F. N., Pohl D. P. et al.Rapid characterization of virulence determinants in Helicobacter pylori isolated from non- atrophic gastritis patients by next-generation sequencing.J Clin Med.2019.V.8,N7.Р.e1030.http://dx.doi.org/10.3390/jcm8071030.
- Imoto , Oka S., Katsurahara M. et al. Helicobacter pylori infection: is there circulating vacuolating cytotoxin A or cytotoxin-associated gene A protein?.Gut Pathog. 2022. V.14, N.1. Р.e43. doi: 10.1186/ s13099-022-00519-8.
- Suharsono , Wibawa D. N., Muttaqin Z., Agustina K. K. Structure of cytotoxic associated antigen A protein of Helicobacter pylori from Bali and Lombok isolates of Indonesia. Vet World. 2020. V.1,N.7. P. 1319–1326. doi: 10.14202/vetworld. 2020. 1319–1326.
- Doohan D., Rezkitha Y. A., Waskito L. A. et al. Helicobacter pylori BabA-SabA Key Roles in the Adherence Phase: The Synergic Mechanism for Successful Colonization and Disease Development. Toxins (Basel). V.13, N7. Р.e 485. doi: 10.3390/toxins13070485.
- Jolaiya T. F., Fowora M. A., Onyekwere C.et al. Duodenal ulcer promoting gene (DupA), plasticity region genes and sigma factors in H. pyloristrains from Nigeria.J Infect Dev Ctries. 2020 .V.14, N.2. P. 162–168. doi: 3855/jidc.11746.
- Hortelano , Moreno Y., Vesga F. J. et al. Evaluation of different culture media for detection and quantification of H. pylori in environmental and clinical samples. Int Microbiol.2020.V. 23. P. 481–487. https://doi. org/10.1007/s10123-020-00135-z.
- Lee J. Y., Kim N. Diagnosis of Helicobacter pylori by invasive test: Ann Transl Med. 2015.V.3, N1.e10. doi: 10.3978/j.issn.2305– 5839.2014.11.03.
- Fan C., Chen C. H., Chou C. et al. A time-saving-modified Giemsa stain is a better diagnostic method of Helicobacter pylori infection compared with the rapid urease test.J Clin Lab Anal. 2020. V.34, N.4. P.e 23110. doi: 10.1002/jcla.23110.
- Gisbert P., Pajares J. M. Review article: 13C-urea breath test in the diagnosis of Helicobacter pylori infection — a critical review. Aliment Pharmacol Ther. 2004. V.20, N.10. P. 1001–1017. doi: 10.1111/j.1365- 2036.2004.02203.x.
- Herbrink P., van Doorn L. J. Serological methods for diagnosis of Helicobacter pylori infection and monitoring of eradication Eur J Clin Microbiol Infect Dis.2000. V.19, N.3. P. 164–173. doi: 10.1007/ s100960050454.
- Nares-Cisneros , Jaramillo-Rodríguez Y., Martínez-Ordaz V. A. et.al. Immunochromatographic monoclonal test for detection of Helicobacter pylori antigen in stool is useful in children from high- prevalence developing country. Helicobacter. 2007 .V.12, N.4. P. 354– 358. doi: 10.1111/j.1523-5378.2007.00514.x.
- Sekhar Goud E. S., Kannan R., Rao U. K. et al.Identification of Helicobacter pylori in Saliva of Patients with and without Gastritis by Polymerase Chain Reaction. J Pharm Bioallied Sci. 2019. V.11, P. 523–529. doi: 10.4103/jpbs.JPBS_260_18.
- Demiray-Gürbüz , Yılmaz Ö., Olivares A. Z. et al. Rapid identification of Helicobacter pylori and assessment of clarithromycin susceptibility from clinical specimens using FISH. J Pathol Clin Res. 2016. V. 26,N.3(1). P. 29–37. doi: 10.1002/cjp2.57.
- Benigno D., Ribeiro Junior H. L., Azevedo O. R. et al.Clarithromycin- resistant H. pylori primary strains and virulence genotypes in the Northeastern region of Brazil. Rev Inst Med Trop Sao Paulo. 2022. V.13, N64. Р. e47. doi: 10.1590/S1678-9946202264047.
- Korkmaz H., Kesli R., Karabagli P., Terzi Y. Comparison of the diagnostic accuracy of five different stool antigen tests for the diagnosis of Helicobacter pylori infection.Helicobacter. 2013. V.18, P. 384–391. doi: 10.1111/hel.12053.
- Lage P., Godfroid E., Fauconnier A. et al. Diagnosis of Helicobacter pylori infection by PCR: comparison with other invasive techniques and detection of cagA gene in gastric biopsy specimens. J Clin Microbiol. 1995 .V.33, N.10. P. 2752–2756. doi: 10.1128/jcm.33.10.2752- 2756.1995.
- Aktepe O. C., Ciftçi I. H., Safak B. et al.Five methods for detection of Helicobacter pylori in the Turkish World J Gastroenterol.2011. V.17, N 47. P. 5172–5176. doi: 10.3748/wjg.v1
- Pohl , Keller P. M., Bordier V., Wagner K. Review of current diagnostic methods and advances in Helicobacter pylori diagnostics in the era of next generation sequencing. World J Gastroenterol. 2019. V.25, N.32. P..4629–4660. doi: 10.3748/wjg.v25.i32.4629.
Відомості про авторів:
Кирик Д. Л. — д. м. н., професор, Національний універси- тет охорони здоров’я України ім. П. Л. Шупика, кафедра мікробіології та вірусології, професор кафедри.
E-mail:kyryk@ukr.net ORCID:0000-0001-8521-3782
Участь у статті: ідея, керівництво, зібрання матеріалу, під- готовка чорнового варіанту, редагування.
Нікольська О. І. — к. м. н., доцент, Національний універси- тет охорони здоров’я України ім. П. Л. Шупика, кафедра мікробіології та вірусології, доцент кафедри.
E-mail: elenanikolska@gmail.com ORCID:0000-0002-3797-5237
Участь у статті: підготовка чорнового варіанту, редагу- вання.
Брудько А. П. — асистент, Національний університет охо- рони здоров’я України ім. П. Л. Шупика, кафедра мікробі- ології та вірусології, асистент кафедри.
E-mail: vual@ukr.net
Участь у статті: зібрання матеріалу, підготовка чорнового варіанту, редагування.
Єркін О. К. — асистент, Національний університет охоро- ни здоров’я України ім. П. Л. Шупика, кафедра мікробіоло- гії та вірусології, асистент кафедри.
E-mail: alex.yerkin@gmail.com
Участь у статті: зібрання матеріалу, підготовка чорнового варіанту, редагування.
Information about the authors:
Kyryk D. L. — Doctor of medical science, professor, Shupyk National Healthcare University of Ukraine,Department of Microbiology and Virology,professor of the department.
E-mail:kyryk@ukr.net ORCID:0000-0001-8521-3782
Contribution to the article: idea, guidance, collection of material, drafting, editing.
Nicolska O. I. — candidate of medical science, associate professor. Shupyk National Healthcare University of Ukraine,Department of Microbiology and Virology, associate professor of the department.
E-mail: elenanikolska@gmail.com ORCID:0000-0002-3797-5237
Contribution to the article: drafting, editing.
Brudko A. P. — assistant, Shupyk National Healthcare University of Ukraine, Department of Microbiology and Virology, assistant of the department.
E-mail: vual@ukr.net
Contribution to the article: collection of material, preparation of the draft, editing.
Yerkin O. K. — assistant, Shupyk National Healthcare University of Ukraine, Department of Microbiology and Virology, assistant of the department.
E-mail: alex.yerkin@gmail.com
Contribution to the article: collection of material, preparation of the draft, editing.
