Зміни чутливості до антибіотиків у штамів бактерій при їх сумісному культивуванні з культурами клітин людини та тварин

УДК 616.002.828: [577.181.5+62-581 /584] +57.017.4
Д. П. Єгоров1, C. Л. Рибалко2, С. М. Григор’єва2, Д. Б. Старосила2, В. П. Широбоков1
1Національний медичний університет ім. О. О. Богомольця МОЗ України, м. Київ, Україна 2ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України», м. Київ, Україна
Аутомікрофлора постійно підтримує біологічну рівновагу макроорганізму, але стреси, інфекції, нераціональна антибіотикотерапія, екологічні негаразди можуть змінювати її вплив. Для корекції порушень нормофлори здавна використовують препарати-пробіотики, які містять штами представників нормофлори. Проте процес взаємодії представників аутомікрофлори та пробіотичних штамів при корекції порушень нормофлори недостатньо вивчено. В роботі представлено результати визначення чутливості штамів ентерококів, виділених з препарату-пробіотика, та клебсієл, ізольованих від людини, при сумісному культивуванні їх у культурах клітин, які слугували моделлю макроорганізму. Встановлено, що після сумісного культивування штаму Klebsiella pneumoniae з резистентним пробіотичним штамом Enterococcus faecium у культурі клітин штам Klebsiella pneumoniae з чутливого став резистентним до амікацину; щодо меропенему та цефтазидиму штам Klebsiella pneumoniae став із чутливого помірно стійким. Така реверсія може вказувати на наявність плазмідної резистентності штаму Klebsiella pneumoniae, яка з’явилася після сумісного культивування з резистентним пробіотичним штамом у культурі клітин.
Ключові слова: антибіотики, культури клітин, ентерококи, клебсієли, резистентність.
- P. Yegorov1, C. L. Rybalko2, S. M Grigor’eva2, D. B. Starosila2, V. P. Shirobokov1
CHANGES IN SENSITIVITY TO ANTIBIOTICS IN BACTERIAL STRAINS DURING THEIR
CO-CULTIVATION WITH HUMAN AND ANIMAL CELL CULTURES
1O. O. Bogomolets National Medical University of Ministry of Health of Ukraine, Kyiv, Ukraine 2SI “The L. V. Gromashevsky Institute of Epidemiology and Infectious Diseases of National Academy of Sciences of Ukraine”, Kyiv, Ukraine
Аutomicroflora constantly supports the biological balance of the macroorganism, but stress, infections, irrational antibiotic therapy, and environmental disturbances can disrupt its effect. Probiotic preparations, which contain strains of representatives of the normal flora, have long been used to correct violations of
the normal flora. However, the process of interaction between representatives of the automicroflora and probiotic strains in the correction of violations of the normal flora has not been sufficiently studied. The paper presents the results of determining the sensitivity of strains of enterococci isolated from the probiotic preparation and Klebsiella isolated from humans, when they are co-cultivated in cell cultures that served as a model macroorganism. It was established that after the co-cultivation of the strain of Klebsiella pneumoniae with the resistant probiotic strain of Enterococcus faecium in cell culture, the strain of Klebsiella pneumoniae became resistant to amikacin from being sensitive; in relation to meropenem and ceftazidime, the strain of Klebsiella pneumoniae became moderately resistant from sensitive. Such reversion may indicate the presence of plasmid resistance of the Klebsiella pneumoniae strain, which appeared after co-cultivation with a resistant probiotic strain in cell culture.
Key words: antibiotics, cell cultures, enterococci, Klebsiella, resistance.
Актуальність. Одним із критеріїв оцінки пробіотиків є властивість їх антибіотикорезистентності, яка повинна бути характеристикою відбору перспективних для виробничої технології штамів. Але ці властивості здатні до значного варіювання, наприклад, може відбуватися їх втрата при технологічних пасажах або може бути присутня так звана надбана резистентність (плазмідна). Плазмідна резистентність зумовлена присутністю R-плазмід та може виникати при антибіотикотерапії, хіміотерапії, променевій терапії макроорганізму. Присутність у мікроорганізмах рухливих елементів (транспозонів) дозволяє здійснити перенесення генів антибіотикорезистентності не тільки серед близьких видів бактерій, але й серед видів, що таксономічно віддалені один від одного.
Для з’ясування природної чутливості штамів ентерококів, виділених із препарату-пробіотика, та клебсієл, ізольованих від людини, використовували спосіб визначення чутливості бактерій та грибів до антибіотиків при культивуванні їх в клітинах людини і тварин [1, 2].
У клініко-діагностичних лабораторіях МОЗ України використовується стандартний диско-дифузійний метод визначення чутливості мікроорганізмів до антибіотиків. Однак відомо, що при взаємодії мікробних клітин із клітинами макроорганізму змінюються адгезивні властивості бактерій, що веде до зміни чутливості у бактерій. Феномен реверсії чутливості до антибіотиків вперше було виявлено у молочнокислих бактерій при їх взаємодії з лімфобластоїдними клітинами людини.
Метою досліджень було визначення природної чутливості штамів ентерококів, виділених з препарату-пробіотика, та клебсієл, ізольованих від людини, при культивуванні їх у культурах клітин.
Матеріали та методи. Штами мікроорганізмів: штам Enterococcus faecium, виділений з «лінексу»; штам Klebsiella pneumoniae, виділений з біоматеріалу — вміст товстого кишечника здорової дитини. Культури клітин: HЕp-2 — клітинна лінія пухлини людини; ВНК — клітини нирки сірійського хом’яка; MDCK — клітини нирки собаки; RK-13 — клітини нирки кролика. Середовище RPMI-1640 для вирощування культур клітин без додавання антибіотиків. Поживні середовища для вирощування ентерококів і ентеробактерій та визначення антибіотикочутливості: ентерококагар, агар Ендо, агар Мюлера-Хінтона. Диски з антибіотиками виробництва Himedia, Індія та «Аспект» (Україна), зареєстровані в Україні: аміноглікозиди; цефалоспорини; макроліди; фторхінолони; ванкоміцин, лінезолід, амоксицилін, тайгециклін. Для дослідження використовували диско-дифузійний метод. Чутливість до антибіотиків вивчали перед культивуванням (вихідна) та після культивування в культурах клітин. Контроль здійснювали стандартними тест-культурами: Escherichia coli 25922, aureus ATCC 25923 и P. aeruginosa ATCC 27853. Враховуючи діаметр зони затримки росту досліджува- них бактерій навкруги дисків з антибіотиками, вивчені штами були поділені на три групи: чутливі — S; стійкі — R, помірно стійкі або помірно чутливі — І.
Результати дослідження та їх обговорення. Досліджуваний штам Enterococcus faecium попередньо культивували на ентерококагарі, відбирали та відсівали ізольовану колонію на простий поживний агар у пробірці. Вирощену через 24 години інкубування в термостаті при температурі +37 0С культуру використовували для вивчення її чутливості до антибіотиків. Суспензію клітин досліджуваних бактерій (в концентрації 0,5 ОД) засівали на середовище Мюлера-Хін- тона, накладали диски з антибіотиками. Вимірювання зон затримки росту здійснювали через 18–24 години за допомогою штангель-циркуля.
Отримані результати чутливості Enterococcus faecium («лінекс») до антибіотиків надано в таблиці 1.
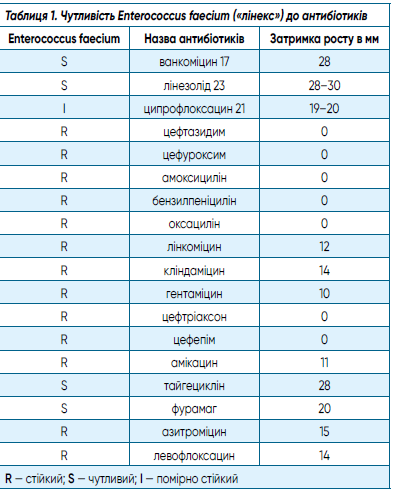
Досліджуваний штам Enterococcus faecium виявився стійким до 13 антибіотиків: цефалоспоринів 3-го покоління: цефтазидиму, цефуроксиму, цефтріаксону; 4-го покоління — цефепіму; також до амоксициліну, бензилпеніциліну, оксациліну, лінкоміцину, кліндаміцину; аміноглікозидів 2-го та 3-го покоління: гентаміцину та амікацину; до макроліду — азитроміцину. Чутливість була виявлена до ванкоміцину, лінезоліду, тайгецикліну та фурамагу. Щодо двох різних фторхінолонів Enterococcus faecium виявився помірно стійким до ципрофлоксацину та стійким до левофлоксацину.
Для внесення в культури клітин використовували чисту бактеріальну культуру Enterococcus faecium, ізольовану з ентерококагару та попередньо вирощену на щільному поживному агарі в пробірці. Далі штам Enterococcus faecium вирощували в культивованих одношарових клітинних лініях протягом 24 годин. Для цього 1 см3 суспензії мікроорганізмів (у концентрації 1,0×108 КУО/мл–0,5 ОД за стандартом Мак-Фарланда) вносили в культури клітин та культивували в середовищі RPMI-1640 без додавання сироватки та антибіотиків в термостаті при температурі +37 0С. Як контроль використовували виготовлену суспензію мікроорганізмів (в концентрації 0,5 ОД за стандартом Мак-Фарланда)
У таблиці 2 наведено результати дослідження чутливості Enterococcus faecium після пасажу через культури клітин.
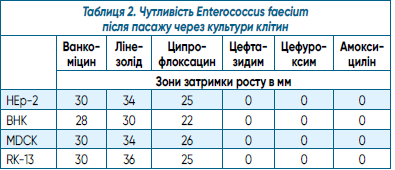
У таблиці 2 вказано зони затримки росту після пасажу через культури клітин.
Після культивування знову ізолювали методом висіву на ентерококагар штам E.faecium та вивчали, чи змінилися показники чутливості до антибактеріальних препаратів.
У таблиці 3 наведено результати дослідження порівняння чутливості E.faecium до та після пасажу через культури клітин.
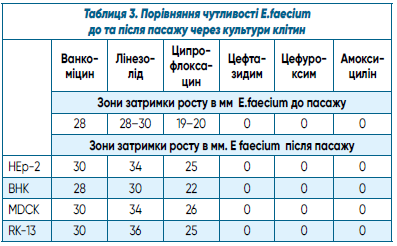
Як випливає з таблиці 3, зони затримки росту E.faecium після пасажу через культуру клітин HЕp- 2 збільшилася на 2 мм щодо ванкоміцину, на 4–6 мм щодо лінезоліду, на 5-6 мм щодо ципрофлоксацину (від І до S). До таких антибіотиків, як цефтазидим, цефуроксим та амоксицилін E.faecium залишився стабільно резистентним. Після пасажу через культуру клітин BHK показники, що досліджувалися, практично не змінилися, за винятком чутливості до ципрофлоксацину, яка збільшилася на 2 мм. У такий спосіб з помірно чутливого E.faecium став чутливим (від І до S).
Після пасажу через культури клітин MDCK та RK- 13 відмічено також зростання діаметрів зони затримки росту E.faecium на 2 мм до ванкоміцину, на 4–6–8 мм до лінезоліду, на 6-7мм до ципрофлоксацину (від І до S); до цефтазидиму, цефуроксиму та амоксициліну E.faecium залишився стабільно резистентним також.
Наступним етапом досліджень було приготування суміші мікроорганізмів різних родів: клебсієл (грам- негативні) та ентерококів (грампозитивні). Для цього штам Klebsiella pneumoniae попередньо вирощували на агарі Ендо, штам E.faecium на ентерококагарі. Пересівали ізольовані колонії на щільний поживний агар, після вирощування на ньому протягом 24 годин вико- ристовували для приготування суспензій мікроорга- нізмів. Суспензію клітин бактерій, які досліджувались (в концентрації 0,5 ОД за стандартом Мак-Фарлан- да), в рівних кількостях змішували в пробірці та по 1 см3 суспензії суміші мікроорганізмів додавали до культур клітин та культивували в середовищі RPMI-1640 без додавання антибіотиків в термостаті при температурі
±37 0С. Через 24 години інкубування отримували культуральну рідину та вивчали її чутливість до антибактеріальних препаратів диско-дифузійним методом.
В таблиці 4 наведено результати порівняння чутливості до а/б суспензій штаму Klebsiella pneumoniae до пасажу та суміші штамів Klebsiella pneumoniae та Enterococcus faecium після пасажу через культуру клітин.
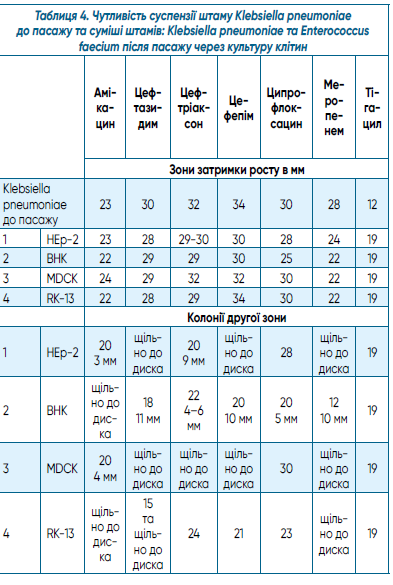
Як випливає з таблиці 4, після пасажу спостерігалося розділення зон затримки росту на дві зони. В зоні затримки росту при дослідженні методом мікроскопії за Грамом визначали наявність грампозитивних диплококів та грамнегативних паличок.
Було проведено розділення суміші Klebsiella pneumoniae та Enterococcus faecium методом висіву на різні середовища: Ендо та ентерококагар. Було ізольовано штам Klebsiella pneumoniae, виділено із суміші з ентерококом з середовища Ендо та визначено його чутливість до антибіотиків.
В таблиці 5 наведено дані порівняння чутливості чистої культури Klebsiella pneumoniae до а/б до та після пасажу через культури клітин.
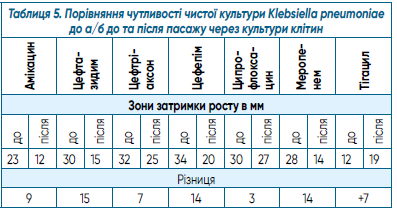
Як видно на таблиці 5, зони затримки росту Klebsiella pneumoniae навкруги дисків з антибіотиками після пасажу через культури клітин значно зменшилися. Зі штаму, чутливого до антибіотика амікацину, штам Klebsiella pneumoniae, що досліджувався, набув резистентності. Стосовно меропенему та цефтазидиму штам Klebsiella pneumoniae став помірно стійким з чутливого. Зони затримки росту навколо цефтріаксону, цефепіму та ципрофлоксацину також зменшилися на 5 мм, 12 мм, 8 мм, тобто штам залишився чутливим до вищевказаних препаратів. Чутливість штаму Klebsiella pneumoniae до тігацилу після пасажу не змінилася.
Паралельно з цим дослідженням вивчалась чутливість до антибіотиків у штаму Klebsiella pneumoniae, який було проведено через культури клітин як монокультуру. Отримані дані чутливості Klebsiella pneumoniae до та після пасажу через культури клітин наведено в таблицях 6 та 7.
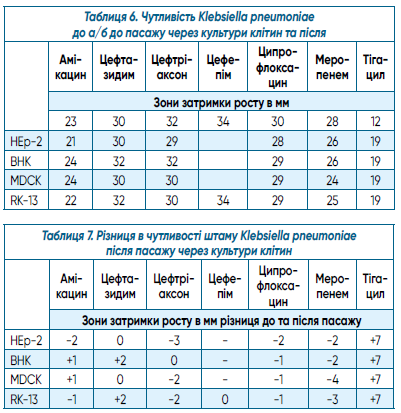
З даних таблиці 7 з’ясовується, що до всіх антибіотиків, які використовувались в дослідженнях, відбулися незначні зміни чутливості штаму Klebsiella pneumoniae, що віддзеркалювалося як скорочення або збільшення зон затримки росту на 3-4 мм. Тобто штам залишився чутливим до вищевказаних препаратів. При цьому зона затримки росту штаму Klebsiella pneumoniae до тігацилу після пасажу збільшилася на 7 мм, чутливість залишилася.
Було проведено моніторинг змін чутливості до антибіотиків у пробіотичного штаму ентерококу, клінічного штаму клебсієл та їх суміші до та після їх пасажів через культури клітин. Зазначено, що після сумісного пасажу клінічного штаму клебсієл з пробіотичним штамом ентерококу, досліджуваний штам Klebsiella pneumoniae перетворився з чутливого на резистентний щодо антибіотика амікацину; стосовно меропенему та цефтазидиму штам Klebsiella pneumoniae став помірно стійким із чутливого.
Щодо монокультури клінічного штаму клебсієл змін чутливості на резистентність виявлено не було. Така трансформація може вказувати на наявність плазмідної резистентності штаму Klebsiella pneumoniae, яка з’явилася після сумісного культивування з резистентним пробіотичним штамом у культурі клітин. Відновлення чутливості у клінічного штаму клебсієл спостерігалося через декілька пасажів на поживних середовищах, які містили кров.
Отже, при конструюванні пробіотиків, щоб не призвести до мікроекологічних порушень мікробіоценозів людини та тварин, доцільно вибирати штами з резистентністю, яка не зумовлена плазмідним фактором. Для цього можна використовувати методику пасажів через культури клітин, що слугуватиме моделлю взаємодії штамів мікроорганізмів між собою у макроорганізмі.
Висновки
- Для запобігання мікроекологічних порушень мікробіоценозів людини та тварин при конструюванні пробіотиків доцільно використовувати методику пасажів через культури клітин для виявлення штамів з набутою резистентністю.
- За рахунок культивування в перещеплюваних культурах клітин людини і тварин, визначення чутливості клінічних штамів бактерій до антибіотиків найбільш ефективне, бо дозволяє виявити ті антибіотики, які не призводять до зміни чутливості мікроорганізмів.
Література
- Rybalko L., Pokas Ye. V., Deyev V. A., Liaskovski Т. M., Furzikova Т. M., Ivanskaya N.V. et al. Antibiotic resistance changes in strains of bacteria and yeast-like fungi following their growth in established cell lines of human and animal origin. ISSN 0233-7657. Біополімери і клітина. 2006. Т. 22. № 5.
- Рыбалко С. Л., Лясковский Т. М., Подгорский В. С., Гармашева И. Л., Коваленко Н. К. Реверсия антибиотикочувствительности молочно- кислых бактерий в перевиваемых культурах лимфобластоидных клеток человека. Микробиологический журнал. Т. 68. №6. 43–51 с.
- Рибалко С. Л., Покас О. В., Дєєв В. А., Лясковський Т. М., Дядюн С. Т., Саєнко В. Ф. Спосіб зміни антибіотикорезистентності ентеробактерій на антибіотикочутливість. Патент України на корисну модель № 20587 від 01.2007 р.
- Anvar H., van Biesen М., Dasgupta К. Ineraction of biofilm bacteria with antibiotics in a novel in vitro chemostat system. Antimicrob. Agents 1989. 33. P. 1824–1826.
- Anvar , Costerton J. W. Effective use of antibiotics in the treatment of biofilm-associated infections. ASM News. 1992. 58. P. 665–668.
- Gilbert , Collier J., Brown M. R. Influence of growth rate on susceptibility to antimicrobial agents: biofilms, cell cycle, dormancy, and stringent response. Antimicrob. Agents Chemother. 1990. 34. P. 1865–1868.
- Costerton , Cheng K-J., Geesey G. G., Anvar H. Bacterial biofilms in nature and disease. Ann. Rev. Microbiol. 1987. 41. P. 435–464.
- Gilbert P. Attachment and biofilm formation: the critical event in microbial J. Pharm. Pharmacol. 1997. 49. suppl. 4. P. 8.
- Голубев Д. Б., Соминина А. А., Медведева М. Н. Руководство по применению клеточных культур в вирусологии. Ленинград: Медицина. 1976. 54 с.
- National Committee for Clinical Laboratory Standards. Performance standards for antimicrobial susceptibility testing; eleventh informational New York., 2001. Vol. 2. P. 79.
- Серия технических докладов ВОЗ (критерии для интерпретации результатов испытаний, основанные на методе Бауэр-Кирби). Женева. N 673. 147–169 c.
- Onveji С. О., Nicolau D. P., Nightingale С., Bow L. Interferon-gamma effects on activities of gentamicin and vancomycin against Enterococcus faecalis resistant to the drugs: an in vitro study with human Int. J. Antimicrob. Agents. 1999. П. P. 31–37.
- Ouadrhiri Y, Scorneaux В, Sibille Y, Tulkens PM. Mechanism of the intracellular killing and modulation of antibiotic susceptibility of Listeria monocytogenes in THP-1 macrophages activated by gamma- Antimicrob. Agents Chemother. 1999. 43. P. 1242–1251.
- Difco Manual Dehydrated culture media and reagents for microbiology: Tenth edition.—Detroit, 1994. P. 844–850. УДК 002.828: [577.181.5+62-581 /584] +57.017.4.
- Жалко-Титаренко В. П., Бондаренко В. Н., Григорьев А. В. Динамика взаимодействия шигелл с эпителием в процессе заражения. Журнал микробиологии, эпидемиологии и иммунобиологии. 1986. № 4, 21–24 c.
