Сьогоднішні проблеми поліомієліту. Ситуація у світі та Україні. Шляхи вирішення*
УДК 616.832.21-002:616-036.22+004.02(15+477)
В. І. Задорожна, Н. П. Винник, І. Г. Кононова, О. В. Мурашко
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л. В. Громашевського НАМН України»
Натепер у світі припинена циркуляція «дикого» поліовірусу типів 2 і 3, також трапляється зниження щорічної кількості випадків поліомієліту, викликаного «диким» поліовірусом типу 1 (6–176 випадків протягом 2016–2021 рр.). Водночас спостерігається зростання випадків поліомієліту, викликаних циркулюючими вакциноспорідненими поліовірусами (сVDPVs), зокрема циркулюючим вакциноспорідненим поліовірусом типу 2 (сVDPV2). Інтенсивність циркуляції сVDPV2 зросла серед людей (випадки поліомієліту: з 2 у 2016 р. до 1 081 — у 2020 р.; інші випадки виявлення вірусу у людей: з 3 у 2016 р. до 332 — у 2021 р.) і в об’єктах навколишнього середовища (з 5 штамів у 2016 р. до 537 — у 2020 р.). Така тенденція почалася після переходу у світі на використання bOPV замість tOPV, який відбувся в квітні–травні 2016 р. і мав на меті припинити формування та циркуляцію саме сVDPV2. Зазначене є ще одним свідченням необхідності всебічного наукового підходу, який повинен передувати глобальним практичним діям. Нова моновалентна вакцина nOPV2, розроблена на основі модифікованого поліовірусу типу 2, та фракційна IPV натепер не пройшли всіх етапів ліцензування, хоча використовуються в деяких країнах Азії, Африки та Латинської Америки. Нові інактивовані вакцини із штамів Себіна (sIPV) є перспективними препаратами для кінцевої стадії ерадикації поліомієліту. Але натепер вони потребують подальших досліджень щодо тривалості збереження рівнів специфічних антитіл, а також визначення їх безпеки й ефективності при одночасному використанні з іншими вакцинами, які передбачені календарями щеплень.
В Україні епідемічна ситуація щодо поліомієліту є незадовільною. Це пов’язано з низьким рівнем охоплення щепленнями дитячого населення, недостатньою ефективністю епідеміологічного нагляду та тим фактом, що спалах поліомієліту, який у 2021 р. був викликаний сVDPV2, фактично залишився без адекватної відповіді. Якомога швидший перехід України на застосування виключно IPV на всіх етапах вакцинації з обов’язковим дотриманням рівня охоплення щепленнями 95% і вище є тією необхідністю, що дозволить підтримувати статус вільної від поліомієліту території.
Ключові слова: поліомієліт, «дикий» поліовірус, вакцина.
- I. Zadorozhna, N. P. Vinnyk, I. G. Kononova, O. V. Murashko
TODAY’S PROBLEMS OF POLIOMYELITIS. SITUATION IN THE WORLD
AND UKRAINE. SOLUTION WAYS
SI “The L.V. Gromashevsky Institute of Epidemiology and Infectious Diseases of NAMS of Ukraine”
For now, circulating the “wild” poliovirus types 2 and 3 is stopped in the world, also decreases annually number of poliomyelitis cases caused by the “wild” poliovirus type 1 (6–176 cases during 2016–2021). At the same time, there is an increase in cases of poliomyelitis caused by circulating vaccine-associated polioviruses (cVDPVs),
particularly circulating vaccine-associated poliovirus type 2 (cVDPV2). The intensity of cVDPV2 circulation has increased among people (polio cases: from 2 in 2016 to 1,081 in 2020; other cases of detection of virus in humans: from 3 in 2016 to 332 in 2021) and in environmental objects (from 5 strains in 2016 to 537 in 2020). This trend began after the world transition to bOPV instead of tOPV, which took place in April–May 2016 and was intended to stop the formation and circulation of cVDPV2. This is another evidence of the need for a comprehensive scientific approach, which must precede global practical actions. The new monovalent vaccine nOPV2 developed based on a modified poliovirus type 2 and fractional IPV have not yet passed all stages of licensure, although they are used in some countries in Asia, Africa and Latin America. New inactivated vaccines from Sebin strains (sIPV) are promising drugs for the end-stage of polio eradication. But at present, they need further research on the duration of maintenance of specific antibody levels, as well as to determine their safety and effectiveness when used simultaneously with other vaccines provided for by vaccination schedules.
The epidemic situation of poliomyelitis is unsatisfactory in Ukraine. This is due to the low level of vaccination coverage of the child population, insufficient effectiveness of epidemiological surveillance and the outbreak of poliomyelitis in 2021 (induced by cVDPVs) remained without an adequate response. The transition of Ukraine as soon as possible to the use of exclusively IPV at all stages of vaccination with mandatory compliance with the level of vaccination coverage of 95% and above is the necessity that will allow maintaining the status of the territory free from poliomyelitis.
Key words: poliomyelitis, “wild” poliovirus, vaccine.
Поліомієліт є першою відомою ентеровірусною інфекцією. Його історія перевищує 3 500 років. Про те, що ця інфекція викликала захворювання ще у Стародавньому Єгипті, стало відомо завдяки кам’яній стелі, на якій зображено жерця з наслідками поліомієліту. Ця стела зараз зберігається в музеї «Нова гліптотека Карлсберга» в Копенгагені (Данія). Ми не будемо детально зупинятися на історії поліомієліту, оскільки це питання та наш особистий 30-річний досвід, спрямований на припинення циркуляції поліовірусу в Україні, узагальнений у монографії [1]. Поліомієліт став 2-ою після натуральної віспи інфекційною хворобою, яку було вирішено ліквідувати за допомогою вакцинації. Рішення про це було прийнято на 41-ій сесії Всесвітньої асамблеї охорони здоров’я в 1988 році. Також було визначено термін — 2000 рік. Тоді ж розпочалася реалізація Глобальної ініціативи ерадикації поліомієліту (ГІЕП). Розрахункова щорічна кількість випадків поліомієліту в світі на той час становила 300–350 тисяч. Саме тоді ГІЕЛ була спрямована на припинення циркуляції у світі «дикого» поліовірусу.
Однак, ще на початку виконання ГІЕП було зрозуміло, що визначений початково термін не відповідає реальним можливостям і не враховує як біологічні властивості поліовірусу, так і стратегічний та тактичний потенціал, за допомогою якого передбачалося її реалізувати. Крім того, нами наголошувалося на переліку важливих моментів: поліомієліт — єдина контрольована інфекція, для профілактики якої застосовується жива вакцина, атенуйовані віруси якої здатні до широкої циркуляції в людській популяції, підключаючись до епідемічного процесу, маючи здатність поступово втрачати властивості атенуйованого вірусу та маючи потенціал до утворення рекомбінантів з іншими ентеровірусами. У процесі тривалої циркуляції такі віруси набувають все більше генетичних розбіжностей зі штамами Себіна, і коли ці розбіжності в ділянці геному, що відповідає за синтез білка PV1, досягнуть 1% і більше, вірус для сприйнятливих осіб буде становити таку ж загрозу щодо розвитку гострого в’ялого паралічу, як і «дикий». Водночас ми підкреслювали факт: якщо навіть ерадикація «дикого» поліовірусу буде досягнута, то імунізацію слід буде проводити ще ретельніше. Крім того, реалізація програм ліквідації інфекційних хвороб є надзвичайно дороговартісною, і часто кошти необхідно суттєво збільшувати через непередбачувані обставини, якими в більшості випадків є нехтування науковими підходами на початку обґрунтування цих програм [2]. Такі генетично змінені поліовіруси набули назву вакциноспоріднених (VDPV — vaccine-derived poliovirus), водночас показник 1% і більше застосовується тепер лише для поліовірусу типів 1 і 3, а для поліовірусу типу 2 його значення знизилося до 0,6% і більше [3]. Класифікація циркулюючих VDPV (сVDPV), які натепер також є об’єктом епідеміологічного нагляду так само, як і «дикий» поліовірус, була уточнена ВООЗ у 2015 році [4]. Також слід пам’ятати про великий ризик генетичних змін у вакцинного поліовірусу при його реплікації в організмі пацієнтів із порушеннями імунного статусу, що теж призводить до формування VDPV, які класифікуються як іVDPV. Натепер є повідомлення про персистенцію таких вірусів до 27,8 року [5, 6].
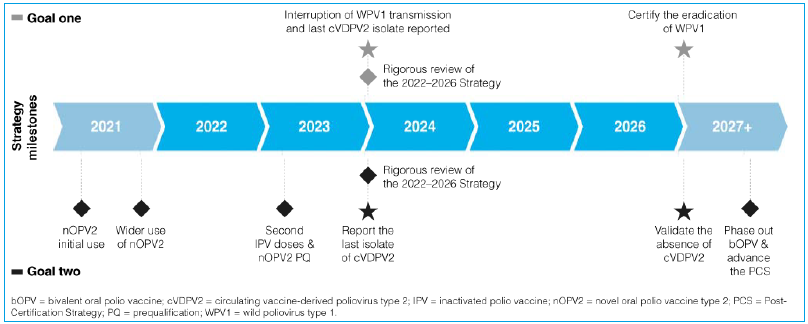
Як нами передбачалося, строки досягнення ерадикації поліомієліту в світі переносилися декілька разів (2000, 2005, 2008, 2013, 2018 роки). Натепер, згідно зі Стратегією ерадикації поліомієліту на 2022–2026 рр., сертифікацію ерадикації «дикого» поліовірусу типу 1 передбачається завершити у 2027 році (рис. 1) [7].
За розрахунками, в 2011 р. були очікування, що вигода від ерадикації поліомієліту за 25 років буде становити 50 млрд доларів США, водночас на реалізацію ГІЕП вже було витрачено 8 млрд доларів. Також підкреслювалося, що дуже важливим є не допускати прогалин у фінансуванні [8]. У 2020 р. ці розрахунки було переглянуто і наголошено на тому, що стратегія ерадикації з часом заощадить більше коштів, порівнюючи з постійним контролем, водночас, починаючи з 2025 р., щорічні витрати на стратегію контролю стануть вищими, ніж щорічні витрати на стратегію ерадикації. Щорічні витрати на стратегію контролю будуть залишатися на рівні понад 1 млрд доларів США до 2042 р. і понад 500 млн — до 2066 року. До 2050 р. прогнозована сукупна економія витрат становитиме 14 млрд доларів [9].
Натепер вільними від «дикого» поліовірусу вважаються 5 із 6 регіонів ВООЗ. Успіхами останнього десятиріччя була ерадикація «дикого» поліовірусу типів 2 і 3 (відповідно в 2015 та 2019 рр.) та отримання 2 регіонами ВООЗ статусу вільних від циркуляції «дикого» поліовірусу — Південно-Східної Азії (2014 р.) та Африканським регіоном (2020 р.). Однак великою проблемою на шляху реалізації ГІЕП виявилися сVDPV та пов’язані з ними випадки поліомієліту.

Рис. 1. Етапи плану стратегії ерадикації поліомієліту на 2022–2026 роки [7].
Метою роботи є оцінка епідемічної ситуації щодо поліомієліту в світі й Україні з урахуванням інтенсифікації циркуляції сVDPV та визначення шляхів збереження Україною статусу країни, вільної від поліомієліту.
Матеріали і методи. На підставі власних досліджень та аналізу світових даних надано оцінку епідемічній ситуації щодо поліомієліту на сучасному етапі реалізації ГІЕП, визначено причини спалаху поліомієліту в Україні в 2021 р. та шляхи подальшого збереження Україною статусу вільної від поліомієліту. Проаналізовано результати епідеміологічного нагляду за гострими в’ялими паралічами (ГВП)/поліомієлітом (2009–2021 рр.); статистичні звіти МОЗ України — форма 5 «Виконання плану профілактичних щеплень за рік» (2009– 2021 рр.). Було застосовано бібліосемантичний, епідеміологічний, статистичний методи досліджень.
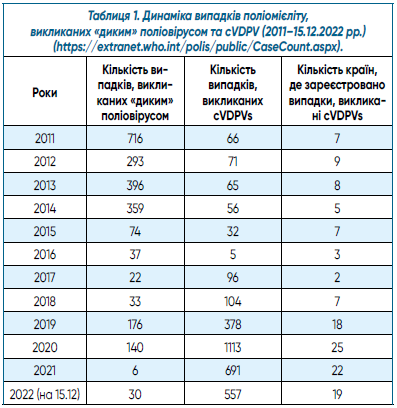
Динаміка випадків поліомієліту у світі та зміна тактики застосування оральної поліомієлітної вакцини. Внаслідок багаторічної реалізації ГІЕП кількість випадків поліомієліту у світі, викликана «диким» поліовірусом, останніми роками різко знизилася. Протягом 2011–2015 рр. цей показник становив 74–716 випадків (табл. 1) [10]. Водночас щорічно реєструвалися 32–71 випадок цієї хвороби, етіологічно пов’язаний із сVDPV.
З огляду на той факт, що серед цих випадків як етіологічний агент превалювали поліовіруси типу 2 (сVDPV2) на тлі припинення циркуляції «дикого» поліовірусу цього типу, ВООЗ було прийнято рішення припинити з квітня–травня 2016 р. використання у світі тривалентної оральної поліомієлітної вакцини (tOPV), замінивши її на бівалентну (bOPV). Було зазначено, що починаючи з січня 2006 р. по травень 2016 р., серед загальної кількості ідентифікованих сVDPV (721 випадок) сVDPV2 становили понад 94%. Такий перехід на bOPV розглядався як перший крок щодо припинення використання живої вакцини. Він обов’язково передбачав застосування в календарі щеплень щонайменше 1 дози інактивованої поліомієлітної вакцини (ІПВ) [11].
Однак, Стратегічна консультативна група експертів з імунізації ще в 2012 р. наголошувала на необхідності введення хоча б 1 дози ІПВ у календарі щеплень кожної країни. Також передбачалося, що до 2018 р. мають бути доступні варіанти безпечного виробництва IPV у країнах, що розвиваються (наприклад, Sabin-IPV), щоб гарантувати, що всі країни мають можливість виробляти IPV для своїх програм імунізації. Про це також було зазначено в Плані ерадикації поліомієліту на 2013–2018 роки [12, 13]. Проте, у 2016 р. через дефіцит ІПВ не всі країни змогли впровадити 1 дозу ІПВ. Хоча всі 155 країн, які на той момент використовували tOPV, перейшли на bOPV, на 31.08.2016 р. тільки 173 (89%) із 194 держав-членів ВООЗ додали ІПВ до своїх графіків щеплень [11]. Тоді ж було розроблено Глобальний план дій ВООЗ щодо мінімізації ризику після типоспецифічної ерадикації «диких» поліовірусів і послідовного припинення використання OPV [14].
Одночасно передбачалося, що в 2019–2020 рр. після припинення циркуляції «диких» поліовірусів відмовляться й від використання оральної вакцини [15].
Однак, перехід на bOPV, всупереч очікуванням ВООЗ, різко посилив інтенсивність формування та циркуляції сVDPV2 (рис. 2). Протягом 2016–2018 рр. було зареєстровано 17 спалахів у 9 країнах, що належать до 4 регіонів ВООЗ. 14 із цих спалахів були викликані саме сVDPV2 [16].
Надалі інтенсивність циркуляції сVDPV продовжувала зростати.
Характеристика циркуляції сVDPVs у світі від початку застосування bOPV. Починаючи з 2017 р., щорічно реєстрували від 96 (2017 р.) до 1 113 випадків поліомієліту (2020 р.), викликаних сVDPV (табл. 1). На 27.10.2022 р. кількість таких випадків дорівнювала 448. Про виявлення сVDPV2 почали повідомляти навіть у тих країнах, де вже не одне десятиріччя не використовується OPV (зокрема США, Велика Британія) [17, 18]. Як і в роки, коли застосовувалася tOPV, серед сVDPV превалюють сVDPV2 (на 9.08.2022 р. — 93%) [19]. Проведений нами аналіз наведених у зазначених джерелах даних показав, що починаючи з 2016 р. до 9.08.2022 р., загалом із усіх обстежених/досліджених об’єктів (пацієнти з ГВП, інші люди, проби з об’єктів навколишнього середовища (ОНС)) ізольовано 5 284 сVDPV, із них серед усіх ізолятів сVDPV1 та сVDPV3 становили лише 5,5% і 1,6% відповідно (рис. 3а). Частка сVDPV, виявлених при обстеженні випадків ГВП, дорівнювала 49,6% (2 621 ізолят) (тобто всі вони є випадками паралітичного поліомієліту), при обстеженні контактних або пацієнтів з іншими діагнозами — 20,2% (1 049), із проб об’єктів навколишнього середовища (ОНС) — 30,2% (1 594) (рис. 3б).
Найнеблагополучнішими роками були 2020 р. (1 950 ізолятів) та 2021 р. (1 594), незважаючи на пандемію COVID-19 та пов’язані з нею карантинні заходи, які б мали обмежити розповсюдження зазначених вірусів. З іншого боку, на тлі пандемії повсюдно спостерігається зниження рівня охоплення імунопрофілактикою, що сприяє інтенсифікації циркуляції вакцинних поліовірусів та їх подальшим генетичним змінам. Статистика за 2022 р. поки що є незавершеною. Хоча частка сVDPV2 залишається домінуючою як за весь період спостереження, так і за окремими роками, прослідковується тенденція до зростання цього показника для сVDPV1 (внаслідок циркуляції в Мадагаскарі) та
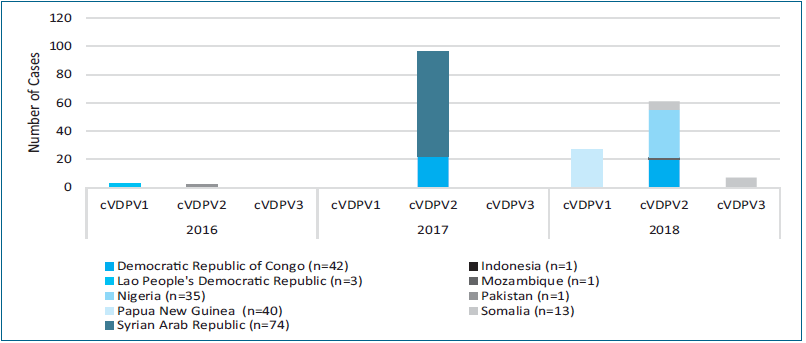
Рис. 2. Випадки поліомієліту у світі, викликані циркулюючими вакциноспорідненими поліовірусами, 2016–2018 роки [16].
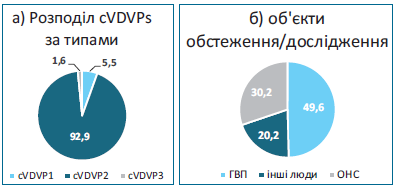
Рис. 3. Розподіл сVDPV2, ізольованих у світі протягом 2016–09.08.2022 рр., за типами та об’єктами обстеження/дослідження (за аналізом даних) [17, 19].
сVDPV3 (внаслідок циркуляції в Ізраїлі), циркулюючих в ОНС (рис. 4). Зазначене свідчить про наявну проблему з ефективністю епідеміологічного нагляду за ГВП/ поліомієлітом, що не дозволяє вчасно виявити формування циркулюючих вакциноспоріднених поліовірусів серед людей та провести відповідні протиепідемічні та профілактичні заходи. У такій ситуації вірусологічний моніторинг ОНС є додатковим інструментом, що дозволяє оперативно оцінити наявні ризики.
Отже, вилучення з оральної вакцини поліовірусу типу 2 призвело до різкої інтенсифікації формування сVDPV, зокрема й сVDPV2, та посилення їх циркуляції.
У цьому часовому періоді було описано унікальний випадок поліомієліту, викликаний VDPV3. Він виник у 2017 р. у Китаї у дитини віком < 3 років. Вірус виявився рекомбінантом Sabin 3/Sabin 1 VDPV із кросинговером в регіоні Р2. Було ідентифіковано заміни нуклеотидів, включаючи U → C (472) і C → U (2 493), обидві з яких часто спостерігаються як реверсійні мутації в нейровірулентному поліовірусі типу 3. Унікальним аспектом цього випадку є те, що пацієнт був вакцинований 4 дозами IPV, а сироваткові нейтралізуючі антитіла до типів 1 і 3 становили 1:16 і 1:512 відповідно, тобто, як прийнято вважати, мали захисний рівень. Крім того, автори зазначають, що вірус продовжував розмножуватися в організмі пацієнта щонайменше 41 день [21]. Цей випадок ставить додаткові питання щодо перспективи ерадикації поліомієліту, оскільки до цього вважалося, що навіть 2 дози IPV захищають від вакциноасоційованого поліомієліту, а 3 щеплення є тим базовим комплексом, на підставі якого оцінюють специфічну захищеність популяції.
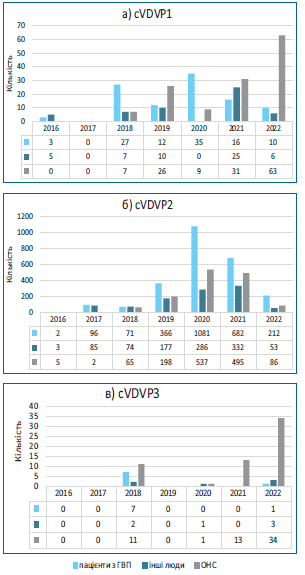
Рис. 4. Динаміка визначення сVDPV у людей та в об’єктах навколишнього середовища (2016–09.08.2022 рр.) (за аналізом даних) [19, 20].
У деяких розвинутих країнах, наприклад, Японії, вакцинація проти поліомієліту взагалі обмежується лише 4 щепленнями IPV. У цьому випадку детальніше потрібно вивчити сам рекомбінантний вірус та ступінь його нейтралізації післявакцинальними антитілами.
Прикладом негативних результатів поспішного рішення про перехід на використання bOPV на тлі дефіциту IPV став Таджикистан, де протягом 2020–2021 рр. виник 31 випадок паралітичного поліомієліту, викликаний сVDPV2. Як зазначає ВООЗ, основною причиною цього спалаху стала наявність великої популяції дітей 2016 та 2017 рр. народження без імунітету до поліовірусу 2 типу через відстрочене введення ІПВ у країні [22]. Спалах був викликаний сVDPV2 (штам PAK-GB-1), завезеним із сусідньої ендемічної країни. Припинення спалаху потребувало значних зусиль. Було проведено підчищаючі тури імунізації ІПВ та 2 загальнонаціональних тури з використанням нової моновалентної оральної вакцини, що містить генетично модифікований поліовірус типу 2 (nOPV2 натепер дозволена лише для екстреного застосування), у віковій групі 0–63 міс. та субнаціональний тур — у віковій групі 0–56 місяців. Деякі країни, що межують із Таджикистаном, також здійснили додаткові заходи щодо імунізації.
Епідемічна ситуація щодо поліомієліту в Україні. Незважаючи на проведені заходи, циркуляція сVDPV2 у Таджикистані не обмежилася тільки територією цієї країни. Випадок поліомієліту, викликаний сVDPV2, виник в Україні (Рівненська обл.) у 17-місячної дитини, у якої симптоми ГВП розвинулися 3 вересня 2021 року. Ізоляти аналогічного вірусу були отримані від 6 здорових дітей із тієї ж сім’ї. На 6 жовтня 2021 р. за результатами генетичного аналізу вірусу було показано його спорідненість зі штамом, ізольованим у Таджикистані з проби з об’єкта довкілля [23].
Другий випадок поліомієліту, викликаний cVDPV2, зареєстровано у 2-річної невакцинованої дитини, у якої ГВП виник 24.12.2021 року. Випадок зареєстровано в Закарпатській обл., хоча до появи ГВП пацієнт уже протягом 2 тижнів перебував у стаціонарі в лікарні м. Львова з приводу лангергансоклітинного гістіоцитозу (починаючи з 10.12.2021 р., а виписаний був 21.01.2021 року). До «Карти епідеміологічного обстеження» цього хворого виникає багато питань з погляду розуміння дотримання вимог нормативної документації щодо епідеміологічного нагляду за ГВП/поліомієлітом. Вірусологічно обстежили лише 2 дорослих як контактних осіб та дослідили декілька проб з абіотичних об’єктів із негативним результатом.
Заходи щодо імунізації, які необхідно було провести у відповідь на спалах поліомієліту, у належному обсязі вчасно проведені не були ні після першого, ні після другого випадку. А їх запланована реалізація на лютий 2022 р. стала неможливою у зв’язку з початком військових дій в Україні.
Цей спалах не можна вважати таким, що виник випадково. Україна належить до зони ризику протягом багатьох років, що було пов’язано спочатку зі зниженням рівнів охоплення щепленнями, а потім і зі зниженням ефективності епідеміологічного нагляду за ГВП/ поліомієлітом. ВООЗ вперше про це наголосила в 2012 році [24]. У 2015 р. спалах поліомієліту, викликаний cVDPV типу 1 (cVDPV1), виник у Закарпатській обл., коли захворіли 2 дитини віком 4 роки та 10 місяців. Рівень охоплення 3 дозами поліомієлітної вакцини в 2014 р. мав найнижчі показники за всі попередні роки (44,7%). Проведені у відповідь на спалах 3 раунди імунізації виявилися нижчими, ніж заплановані, які мали би бути 90% і вище, а реально становили відповідно 64,4, 71,7 та 80,7% від загальної кількості дітей цільової групи [25]. Напередодні спалаху, що виник у 2021 р., на щорічному 35-му засіданні Європейської регіональної сертифікаційної комісії щодо ерадикації поліомієліту (RCC), яке відбулося в Копенгагені (Данія) 6–7 вересня 2021 р., Україну, як і в попередні роки, було віднесено до високого рівня ризику щодо спалаху поліомієліту в разі завозу «дикого» поліовірусу або появи cVDPV через низький рівень охоплення вакцинацією останніми роками та нездатність надати адекватну відповідь на спалахи інших хвороб, які можна попередити за допомогою вакцинації [26].
Аналіз рівня охоплення дітей першого року життя 3 дозами поліомієлітної вакцини протягом 2009–2021 рр. (табл. 2) не дозволяє говорити про його позитивну динаміку. Навіть в наступні роки після спалаху поліомієліту в 2015 р., викликаного cVDPV1, ситуація не покращилася. Рівень охоплення вакцинальним комплексом (3 дози поліомієлітної вакцини у дітей до 1 року), який в усьому світі є критерієм оцінки стану імунопрофілактики проти цієї інфекції та повинен становити 95% і вище, загалом в Україні був лише 55,2–83,0%. Мінімальний показник в окремих регіонах дорівнював у цей період 20,7–68,5%. Дійсно, при такому стані імунопрофілактики неможливо забезпечити збереження Україною статусу вільної від поліомієліту. Навпаки, на тлі продовження використання оральної вакцини існує сприятливе підґрунтя для формування VDPV, їх закріплення в сприйнятливій популяції з подальшим набуттям характеристик cVDPV та розвитком нових спалахів. Також формування широкого неімунного прошарку не зможе стримати розповсюдження «дикого» поліовірусу в разі його завозу з ендемічної території.
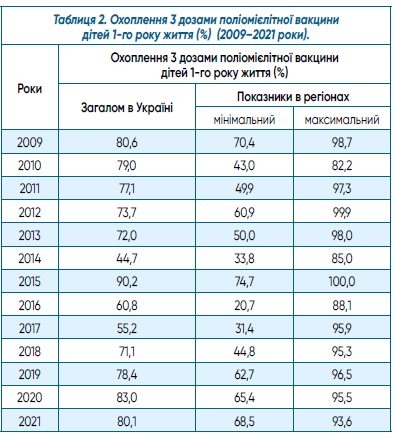
Водночас, якщо звернути увагу на максимальні показники охоплення окремих регіонів, які в цей же період сягали 95,0–100%, виникає питання причини невиконання нормативних вимог як у окремих регіонах, де ці показники нижчі, так і в Україні загалом. Чим пояснити такі розбіжності в організації роботи органів охорони здоров’я різних адміністративних рівнів, і як повернути функціонування системи імунопрофілактики до належного стану, який був у країні до 2007 р. включно? Для порівняння цікаво навести, як приклад, обсяги щеплених дітей згідно з календарем щеплень у 1994 і 1995 рр., коли в Україні вже була припинена циркуляція «дикого» поліовірусу, країна готувалася до відповідної сертифікації, а система імунопрофілактики функціонувала належним чином. Зокрема, вакцинальним комплексом було охоплено відповідно 96,3 і 97,5% дітей цільової групи, 1-ою ревакцинацією — 94,3 і 96,8%, 2-ою — 93,5 і 95,1%, 3-ою — 98,0 і 98,1%, 4-ою — 93,7 і 95,7%.
Що стосується епідеміологічного нагляду за ГВП/ поліомієлітом, то його в Україні впроваджено в 1998 р. разом зі створенням лабораторної мережі з діагностики поліомієліту та ГВП. Також тоді було затверджено і перший «Оперативний план дій з ліквідації поліомієліту і удосконалення нагляду за ГВП». На той час на тлі належного рівня охоплення щепленнями одним із критеріїв ефективного функціонування цієї системи епіднагляду було виявлення 1 і більше випадків ГВП на 100 тис. дітей віком до 15 років (індикаторний показник).
Починаючи з 2011 р., на тлі зниження рівнів вакцинації, яке розпочалося у 2008 р., цей показник для України на щорічному 25-му засіданні RCC було підвищено до 2 на 100 тис. дітей віком до 15 років у зв’язку з її серйозною стурбованістю потенційною передачею «дикого» поліовірусу в разі його завезення в Україну. Також у своєму звіті RCC закликала Україну терміново відновити повну програму імунізації та швидко досягти високого охоплення імунізацією [26]. На жаль, протягом наступного десятиріччя ситуація не покращилася, а індикаторний показник виявлення ГВП, починаючи з 2015 р., для України було підвищено до 3 на 100 тис. дітей віком до 15 років.
Аналізуючи динаміку реєстрації випадків ГВП в Україні, слід відмітити, що за останніх 7 років (2015–2021 рр.)
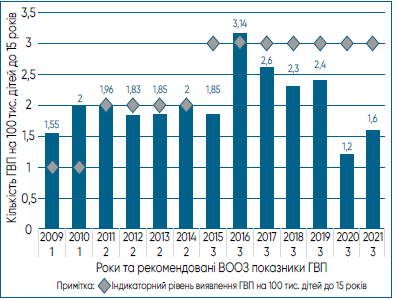
Рис. 5. Динаміка показників виявлення ГВП в Україні (2009–2021 рр.) у зіставленні з рекомендованими показниками ВООЗ [25].
2021 рр.) ефективність епідеміологічного нагляду відповідала вимогам до нього лише в 2016 році (рис. 5). Під час пандемії COVID-19 (2020–2021 рр.) цей показник знизився відповідно до 1,2 та 1,6 на 100 тис. дітей віком до 15 років, що на тлі недопустимо низького рівня охоплення щепленнями не дозволяє об’єктивно оцінювати ситуацію і ставить під загрозу статус України, як вільної від поліомієліту території.
Внаслідок активних військових дій в Україні ця проблема значно посилилася. На тлі спалаху поліомієліту 2021 р., який фактично залишився без адекватної відповіді, спрямованої на досягнення несприйнятливості до поліовірусів необхідного прошарку дитячого населення, почалися безпрецедентні міграційні процеси, які супроводжувалися скупченням людей, відсутністю відповідних санітарно-гігієнічних умов. Руйнування житла та інфраструктури посилювали ризики передачі як збудника, так і сприяли інтенсифікації циркуляції вакцинних поліовірусів, що значно підвищує ризики формування вакциноспоріднених варіантів.
Поширення вакциноспоріднених поліовірусів у країнах, де не застосовують оральну вакцину, та в Ізраїлі. У 2022 р. почали з’являться повідомлення про визначення поліовірусів вакцинного походження або вакциноспоріднених поліовірусів, в яких вже багато років не застосовують оральну вакцину. Зокрема, у пробах стічних вод Лондона (Велика Британія), де OPV припинили використовувати в 2004 р., у період з лютого до 5 липня 2022 р. 116 ізолятів поліовірусу вакцинного походження типу 2 були виявлені в 19 зразках стічних вод очисних споруд, що охоплюють територію водозбору для населення близько 4 мільйонів осіб. За цей період вірус еволюціонував і став відповідати класифікації cVDPV2. Це дозволило припустити, що в цьому регіоні існує певний рівень передачі вірусу, який може поширитися на сусідні райони. Було рекомендовано введення бустерної дози IPV дітям віком 1–9 років у всіх районах Лондона. Припускають, що ще до лютого 2022 р. до Великої Британії приїхала людина з країни, де OPV використовували для додаткової імунізації [28, 29].
cVDPV2 став причиною поліомієліту у 20-річного невакцинованого пацієнта у США (округ Роукленд у Нью-Йорку) [30]. Вірус із близькими генетичними властивостями ідентифіковано в 3 пробах стічних вод. Визначено генетичний зв’язок виділених вірусів із вірусами з Великої Британії та Ізраїлю. Дослідження проб стічних вод, відібраних протягом квітня–жовтня 2022 р. у різних округах, виявило 94 позитивних на VDPV2, серед яких 87 штамів мали генетичний зв’язок із cVDPV2, виділеним від пацієнта з поліомієлітом. 7 штамів були охарактеризовані як VDPV2 або як варіанти вакцинного поліовірусу Себіна типу 2. Визначено 3 позитивних на поліовірус проби стічних вод, відібраних у Канаді в період 20–30 серпня 2022 року. 2 із них виявилися VDPV2 із 6 та 8 нуклеотидними замінами в VP1. Ще 1 зразок досліджується [31]. Зважаючи на ситуацію, що склалася, Панамериканська організація охорони здоров’я ВООЗ наголосила державам-членам на необхідності мати оновлений план реагування на спалахи поліомієліту, об’єднати зусилля для досягнення охоплення вакцинацією проти поліомієліту >95%, посилити та підтримувати епідеміологічний нагляд за ГВП для швидкого виявлення випадків.
В Ізраїлі, незважаючи на використання в календарі щеплень 3 доз IPV із рівнем охоплення 97,6% та 2 доз bOPV (1-а доза — 88,3%), було зареєстровано випадок поліомієліту в Єрусалимі, викликаний VDPV3, у невакцинованої дитини віком 3 роки (17.02.2022 року). На 15.04.2022 р. було ізольовано ще 6 штамів VDPV3 від дітей без симптомів захворювання. Вірус мав 17 змін у нуклеотидній послідовності та був віднесений до кластеру вірусів, виділених з ОНС протягом вересня 2021–січня 2022 років. На підставі цих даних віруси були віднесені до сVDPV3. Терміново в Єрусалимі було проведено імунізацію IPV та bOPV, а 13.04.2022 р. імунізацією bOPV було охоплено всю країну [32]. Одночасно в країні циркулював і VDPV2, який виділяли з ОНС [33].
Сучасні підходи до вакцинації проти поліомієліту. Ті країни Європи та Америки, які протягом майже 20 років використовують у своїх календарях щеплень лише IPV, і надалі продовжують цю стратегію. Їхні схеми імунізації відрізняються лише інтервалом між щепленнями вакцинального комплексу (частіше 1–2 міс., у деяких країнах інтервал між 2-им і 3-ім щепленнями становить 6–12 міс.) та загальною кількістю щеплень (4–6). Починають імунізацію здебільшого у 2 міс., окремі країни — у 3 міс. Багато країн орієнтовані на подальшу ревакцинацію кожні 10 або 20 років [34]. Усі ці країни є благополучними щодо поліомієліту, за винятком описаних випадків у 2022 році.
Вилучення із оральної вакцини поліовірусу типу 2 та необхідність у зв’язку з цим введення хоча б 1 дози IPV у календарі щеплень тих країн, які до цього застосовували лише tOPV, на тлі дефіциту IPV у світі спонукали шукати вихід щодо вирішення цієї проблеми. Одним із напрямів були дослідження щодо фракційного введення IPV (IPVf), які були розпочаті ще раніше. ВООЗ акцентує увагу на тому, що фракційні дози (0,1 мл або 1/5 повної дози) IPV, які вводяться внутрішньошкірно, забезпечують потенційне зниження витрат та дозволяють імунізувати більшу кількість людей, зважаючи на наявний обсяг вакцини [35].
Проведений мета-аналіз досліджень, що існують з цього приводу (Куба, Бангладеш, Оман), реципієнти в яких відрізнялися за віковими групами щодо отримання щеплень, показав, що 2 дози IPVf викликають дещо вищу сероконверсію, ніж 1 доза IPV. Зокрема, для поліовірусу типу 1 ці показники становили відповідно 27–94% проти 19–35%, для поліовірусу типу 2 — 55–98% проти 32–63%, для поліовірусу типу 3 — 43–93% проти 32–45%. Однак дослідження на Кубі (з використанням однакової схеми імунізації — у 6, 10 та 14 тижнів) та у Бангладеш (6 та 14 тижнів) показали дещо нижчі кумулятивні показники сероконверсії в групі fIPV, ніж у групі IPV [36]. Підтримуючи позицію ВООЗ щодо використання fIPV у рутинній імунізації, автори підкреслюють необхідність подальшої оцінки її поточного використання (наприклад, планова імунізація в Індії та Шрі-Ланці, кампанії масової вакцинації в Пакистані) та збільшення відповідних пілотних проєктів для додаткових досліджень, зокрема довготривалості імунітету тощо.
На наш погляд, такі широкі розбіжності між показниками сероконверсії в різних країнах, зокрема до поліовірусу типу 2, проти якого переважно і спрямований цей захист, свідчать про те, що 2 IPVf, або 1 IPV є недостатніми для формування належного специфічного імунітету до цього вірусу, який би усунув ризики формування та циркуляції VDPV2.
Окремого обговорення заслуговує перше дослідження ефективності IPVf порівняно з IPV, яке було проведено в 2008–2009 рр. на Філіппінах. Дітей дослідної та контрольної груп імунізували IPVf і IPV відповідно в 6, 10, 14 тижнів життя та ревакцинували в 15–18 місяців. При застосуванні IPVf через 1 міс. після 3 щеплень антитіла до поліовірусів 3 типів мали 99,1–100%, після ревакцинації — 100% дітей; після застосування IPV — 100%. Однак середні геометричні рівні антитіл після вакцинального комплексу IPVf (3 щеплень) були в 2,6–4,0 рази нижчими, ніж при IPV, а після бустерної дози — в 2,0–2,7 раза нижчими. Крім того, на момент введення бустерної дози не мали специфічних антитіл 4,5–11,7% дітей проти 1,8–3,6% дітей, що отримували IPV [37]. Отже, фракційне застосування IPV навіть при введенні 4 щеплень має нижчу ефективність, ніж IPVf. І хоча автори роблять висновок про його високу імуногенність, добру переносимість та медичну обґрунтованість використання IPVf, вони зазначають, що доцільність реалізації програм масової вакцинації на основі цього способу ще належить встановити. Також слід підкреслити, що IPVf до цього часу не використовується в Календарі щеплень Філіппін.
Водночас, незважаючи на те, що фракційне застосування IPV поки що офіційно не підтверджено виробниками вакцин і не внесено в інструкції з їх використання, за рекомендаціями Стратегічної консультативної групи експертів з імунізації ВООЗ [38], деякі країни вже додали її до своїх календарів щеплень.
У літературі почали з’являтися дані про те, що однієї дози IPV із наступною вакцинацією bOPV недостатньо для формування належного імунітету до поліовірусу типу 2 [39]. Автори пропонують введення до календарів щеплень не менше 2 доз IPV, а тим дітям, що отримали лише 1 щеплення IPV забезпечити вве- дення ще 1 дози.
Ми підтримуємо цю позицію і привертаємо увагу до того факту, що від початку застосування вакцино- профілактики поліомієліту, тобто з 1950–1960-х років минулого століття, вакцинальний комплекс, тобто початковий обов’язковий курс вакцинації, складався з 3 щеплень, який забезпечував належний специфічний імунітет до вірусу кожного типу, що було доведено й обґрунтовано науково. Отже, не можна передбачати, що 1 щеплення інактивованою вакциною може забезпечити стійкий та довготривалий гуморальний імунітет проти поліовірусу типу 2, живий вакцинний варіант якого має найвищу інтерферуючу активність серед інших вакцинних поліовірусів. Цю властивість можна екстраполювати і на сVDPV2.
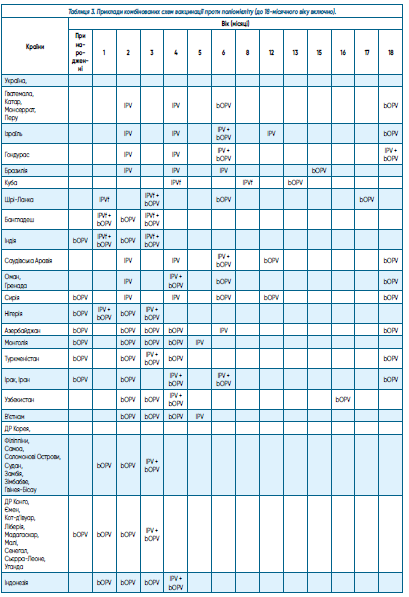
Теперішні календарі щеплень тих країн, в яких ще застосовують bOPV, дуже відрізняються і далеко не завжди мають доказові основи їх ефективності. Варіанти комбінованих схем імунопрофілактики поліомієліту (застосування інактивованої та оральної вакцин в різних комбінаціях) надано в таблиці 3, хоча це розмаїття не є повним [40, 41].
Їх можна поділити на 4 основних групи, а саме: застосування IPV для перших щеплень, а для наступних — bOPV (значно знижуються ризики вакциноасоційованого паралітичного поліомієліту, приклад, Україна); на тлі застосування IPV додаються щеплення bOPV або разом із IPV, або окремо (для формування локального специфічного імунітету в кишечнику вакцинованих, що теоретично знижує циркуляцію VDPV, приклад, Ізраїль); основними щепленнями календаря є bOPV, які проводяться першими, зокрема й при народженні, IPV додаються на певному етапі або одночасно з bOPV, або окремо (для формування імунітету до поліовірусу типу 2, який відсутній в bOPV, приклад, більшість країн Азії, Африки); застосування для перших щеплень IPVf або окремо, або разом із bOPV (у зв’язку з дефіцитом IPV, приклад, Куба, Шрі-Ланка, Бангладеш, Індія).
Для виготовлення IPV використовуються штами «диких» поліовірусів типів 1, 2 і 3, а саме Mahoney, MEF1 і Saukett відповідно. Ураховуючи припинення циркуляції «диких» поліовірусів типів 2 і 3 у світі, вже протягом 2 десятиріч обговорюється проблема створення IPV із застосуванням штамів Себіна (sIPV), тобто тих атенуйованих поліовірусів, що використовуються для отримання живої вакцини, або інших штамів поліовірусів, що позбавлені нейровірулентних властивостей. Зазначене важливо з погляду припинення на тлі реалізації ГІЕП використання при виробництві інактивованих вакцин «диких» штамів поліовірусу з метою усунення ризиків, ненавмисного потрапляння таких вірусів до людської популяції. Це питання нами було ретельно проаналізовано ще в 2012 р. у нашій монографії [1].
У зв’язку з переходом у 2016 р. на використання bOPV та різкою нестачею IPV для країн середнього та низького рівнів доходу, дослідження щодо створення і використання sIPV для таких країн, а також виробництва sIPV у цих країнах, що значно безпечніше, ніж виробництво IPV, відчутно активізувалися. Натепер уже є декілька таких вакцин, які проходять різні стадії клінічного випробування або вже навіть зареєстровані в тих країнах, де були створені [42–45].
Для досягнення належного рівня імуногенності sIPV на етапі 2-ої фази їх клінічних досліджень для кожного штаму підбирають вміст вірусу за D-антигеном VP1 (поверхневий антиген поліовірусу). Ці показники відрізняються у sIPV різних виробників, водночас, як для IPV вони є стабільними і становлять для поліовірусів типів 1, 2 і 3 відповідно 40, 8 та 32 одиниці. Наприклад, sIPV (Eupolio™), яка розроблена Intravacc (провідна міжнародна організація з розробки та виробництва інноваційних вакцин проти інфекційних захворювань, Нідерланди), передана за ліцензією південнокорейській компанії LG Chem у 2014 р. та першою пройшла прекваліфікацію ВООЗ у 2020 р., містить відповідно 5, 8 і 16 одиниць D-антигену VP1 [46], а sIPV виробництва Sinovac Biotech Company (КНР) — відповідно 15, 45 та 45 одиниць [47].
Обмежені дослідження, проведені в Японії при використанні в програмі імунізації першої ліцензованої sIPV, показали, що зниження середніх геометричних рівнів антитіл до поліовірусу типу 2 у дітей, які отримали 4 дози вакцини, було більш вираженим
при застосуванні sIPV, ніж при IPV [48]. Автори наголошують на необхідності довгострокового спостереження щодо тривалості збереження специфічних антитіл, зокрема для визначення подальшої тактики вакцинації, а саме — ревакцинації. Про необхідність вивчення тривалої імунологічної ефективності таких вакцин указують й інші дослідники [49]. При інтерпретації підсумків клінічних досліджень, проведених у Китаї, автори говорять про те, що результати, отримані в азіатській країні, можуть бути незастосовними для інших етнічних груп населення [50]. Крім того, вміст антигену може корелювати з реактогенністю. Цим пояснюють вищу частоту такої післявакцинальної реакції, як підвищення температури тіла у дітей, вакцинованих sIPV виробництва Sinovac Biotech Company (КНР), у порівнянні з цим показником у вакцинованих IPV (відповідно 20,62% проти 16,62%) [51].
Було повідомлення про те, що компанія LG Chem підписала контракт з ЮНІСЕФ на суму 80 мільйонів доларів США на постачання вакцини Eupolio™ протягом 2021–2022 рр. до 70 країн Близького Сходу, Африки та Південно-Східної Азії [52]. Однак, даних про ефективність її застосування в таких масштабах поки що не надано.
Є сподівання, що з часом вакцини sIPV замінять IPV у світі, проте дослідження ще продовжуються, зокрема і за напрямом вивчення безпеки та ефективності їх одночасного введення з іншими вакцинами календарів щеплень.
Окремо треба зупинитися на моновалентній оральній вакцині проти поліовірусу типу 2 OPV(nOPV2), що призначена для зупинення циркуляції сVDPV2. Ще в складі tOPV кількість інфекційних одиниць вакцинного поліовірусу типу 2 (штам P712 ch 2 ab), яка вимагалася в одній дозі вакцини за інструкціями для медичного застосування виробників, була значно нижчою, ніж в інших 2 типах. Ця кількість згідно з вимогами дорівнювала 1 000 000, 100 000 та 600 000 для поліовірусу типів 1, 2 і 3 відповідно, а їх співвідношення — 10 : 1 : 6. Зазначене було пов’язано з вищими інтерферуючими властивостями вакцинного поліовірусу типу 2, що, найімовірніше, надалі зумовило його перевагу в формуванні сVDPV2, порівнюючи з поліовірусами інших типів.
Масове застосування OPV2 в окремих країнах для ліквідації спалахів поліомієліту, викликаних сVDPV2, яке розпочалося на тлі використання bOPV та одиничних доз IPV у календарі щеплень деяких країн (табл. 3), як показав час, сприяє подальшій циркуляції вакцинного поліовірусу типу 2 із підвищеним ризиком формування VDPV2 та сVDPV2, що підтверджується різким зростанням випадків поліомієліту, викликаних сVDPV2, їх виділення від людей та з ОНС (рис. 4б). Також треба пам’ятати, що рівні материнських антитіл до поліовірусів, зокрема й типу 2, швидко знижуються. Наприклад, при дослідженнях, проведених в Бангладеш, через 8 тижнів від народження лише 56% дітей мали такі антитіла [53]. Тому в тих країнах, де IPV застосовують після декількох доз bOPV, може накопичуватися прошарок сприйнятливих до цього вірусу дітей.
У 2020 р. ГІЛП було ініційовано нову стратегію реагування на спалахи, викликані сVDPV2, із використанням
нової вакцини nOPV2, що містить модифікований вірус, який, як передбачається, має вищу генетичну стабільність порівняно зі штамом P712 ch 2 ab. За очікуваннями ВООЗ, це повинно зменшити ризик відновлення нейровірулентних властивостей вакцинного вірусу та здатності викликати паралітичний поліомієліт. Вакцина поки що не пройшла всіх етапів ліцензування, але з 2020 р. рекомендована ВООЗ для використання в екстрених випадках. Вона розфасована у флаконах по 50 доз. Розробку таких вакцин почали в 2011 році [54]. Клінічні випробування фази 1 двох вакцин-кандидатів (відповідно штами S2/cre5/S15domV/rec1/hifi3 та S2/S15domV/CpG40) із залученням дорослих були проведені в 2017 р. у Бельгії. Середня тривалість виділення вірусу становила 23 і 12 днів відповідно. Реверсія ізолятів до нейровірулентності була низькою, а втрати атенуації в домені V 5′-нетрансльованої ділянки геному вірусу при секвенуванні виявлені не були [55]. Під час досліджень, проведених в Бангладеш (фаза 2 клінічних досліджень), 220 новонароджених отримували 2 дози nOPV2 (виробництва Bio Farma, Iндонезія) протягом перших 3 днів від народження та через 4 тижні після 1-ої дози. Через 28 днів після 2-ої дози сероконверсія до поліовірусу типу 2 виявлена в 90% дітей, а захисний рівень антитіл — у 99% [53].
Натепер уже використано 450 млн доз у 21 країні світу у відповідь на спалахи cVDPV2 [56]. Частота реєстрації ВАПП дорівнювала 0,007 випадку на 100 000 реципієнтів вакцини nOPV2, що було нижче очікуваного діапазону 0,025–0,4 випадку на 100 000 для реципієнтів OPV, що містить штами Себіна [57].
На момент використання 111 млн доз цієї вакцини протягом березня–жовтня 2021 р. було ізольовано 128 штамів нового вакцинного поліовірусу типу 2 із проб фекалій у межах епідеміологічного нагляду за ГВП/ поліомієлітом у 6 країнах та 123 — із проб, відібраних із ОНС. Інтервал між відбором проб та проведенням масової імунізації nOPV2 для пацієнтів із ГВП становив 0–81 день, для проб з ОНС — 4–67 днів. За результатами секвенування геному ізолятів та порівняння їх із геномом вакцинного штаму (GenBank ID MZ245455) вони були розділені на 9 категорій за їх профілем ризику та втратою ключових мутацій атенуації нового вакцинного поліовірусу типу 2. Серед ізолятів 32 (13%) були віднесені до категорії 9 (без змін, порівнюючи з nOPV2), 213 (85%) — до категорії 8, в яких не показано реверсивних мутацій у домені V. Однак 6 ізолятів виявилися рекомбінантами між новим вакцинним вірусом та поліовірусом типу 1 Себіна або неідентифікованими ентеровірусами виду С (категорія 6). Кількість мутацій збільшувалася з часом, який минув після проведення кампаній вакцинації. Більш висока частота мутацій, що знижують атенуацію, спостерігалася в ізолятах з ОНС, ніж від пацієнтів із ГВП. При секвенуванні геномів 331 cVDPV2, ізольованих під час спалахів у країнах, географічно пов’язаних із використанням nOPV2, жоден із них не мав рекомбінації з новим вакцинним вірусом [58]. Водночас автори цієї статті не пояснюють, у який спосіб було виключено причетність нового вакцинного вірусу типу 2 до виникнення ГВП у тих осіб, від яких ці віруси виділені. Для того, щоб зробити кінцеві висновки щодо генетичної стабільності nOPV2, необхідні подальші дослідження з урахуванням ризику тривалої циркуляції вірусу серед людей та в навколишньому середовищі, особливо беручи до уваги виявлену тенденцію до збільшення генетичних змін вірусу зі збільшенням часу, що минув після вакцинації.
Узагальнюючи наведені у статті дані та враховуючи власний досвід, на наш погляд, і на цьому ми наполягаємо багато років, єдиним кроком, який дозволить поступово припинити циркуляцію сVDPV та запобігти подальшому формуванню і поширенню таких варіантів вірусу, є повний перехід всіх країн на використання лише ІПВ. Ми від самого початку бачили ризики у вилученні поліовірусу типу 2 як компоненту тривалентної оральної вакцини, на тлі дефіциту у світі IPV та відсутності єдиного науково обґрунтованого підходу до її використання в календарях щеплень різних країн, особливо враховуючи тенденції останніх років до зниження рівнів вакцинопрофілактики, зокрема через пандемію COVID-19, що створює додаткові ризики формування VDPV. Нашу позицію щодо необхідності відмовитися від живої вакцини в глобальному масштабі сьогодні розділяють й інші вчені [59]. Такий підхід, насамперед стосується України, в якій, завдяки створенню нами відповідної наукової доказової бази ще на початку 2000-х років було впроваджено спочатку 1, потім 2 перших щеплення IPV до національного календаря. Україна в цьому напряму стала першою країною на теренах колишнього СНД. І наприкінці статті ми хочемо повторити фразу із нашої монографії, написаної в ще в 2012 р., що «перспективою найближчого майбутнього повинен бути перехід на ІПВ на всіх етапах вакцинального комплексу та ревакцинації» [1].
Висновки
- Щорічна кількість випадків поліомієліту, викликаного «диким» поліовірусом типу 1, протягом 2016–2021 рр. становила від 6 до Перехід у світі на використання bOPV замість tOPV, який відбувся в квітні–травні 2016 р. і мав на меті припинити формування та циркуляцію сVDPV2, навпаки призвів до різкого посилення інтенсивності його циркуляції як серед людей, так і в ОНС. Загальна кількість випадків поліомієліту, етіологічно пов’язаних із сVDPVs, зросла з 32 у 2015 р. до 1 113 — у 2020 р., а кількість країн, де реєструвалися ці випадки — відповідно з 7 до 25.
- Динаміка зростання циркуляції сVDPV2 спостерігалася як серед людей (випадки поліомієліту: з 2 у 2016 р. до 1 081 — у 2020 р.; інші випадки виявлення вірусу у людей: з 3 у 2016 р. до 332 — у 2021 р.), так і в ОНС (з 5 штамів у 2016 р. до 537 — у 2020 р.). У 2022 р. поліовіруси вакцинного походження та VDPVs почали виявляти в тих країнах, де вже багато років не застосовують оральну вакцину (США, Велика Британія). Така ситуація пов’язана з відсутністю наукового підходу, який повинен передувати глобальним практичним діям, дефіцитом IPV у світовому масштабі для забезпечення своєчасного належного рівня імунітету до поліовірусу типу 2, який неможливо створити, використовуючи bOPV та одиничні дози IPV.
- Нова жива моновалентна вакцина nOPV2, розроблена на основі модифікованого поліовірусу типу 2, поки що не пройшла всіх етапів ліцензування, але з 2020 р. рекомендована ВООЗ для використання в екстрених випадках при спалахах поліомієліту, викликаних сVDPV2, і широко застосовується в кра- їнах Азії та Африки. Вона потребує подальшого дослідження для кінцевих висновків щодо генетичної стабільності нового вакцинного вірусу з урахуванням ризику його тривалої циркуляції серед людей і в навколишньому середовищі та наведених у літературі даних щодо виявленої тенденції до збільшення генетичних змін вірусу зі збільшенням часу, що минув після вакцинації, а також здатності до рекомбінації з ентеровірусами виду С.
- Однією із спроб подолання дефіциту у світі IPV ВООЗ розглядає можливість використання фракційного внутрішньошкірного введення 1/5 дози IPV. Такий варіант застосування вакцини поки що офіційно не підтверджено виробниками вакцин і не внесено в інструкції з їх використання, однак за рекомендаціями Стратегічної консультативної групи експертів з імунізації ВООЗ вже додано до календарів щеплень деяких країн (Куба, Шрі-Ланка, Бангладеш, Індія). Наявність широких розбіжностей між показниками сероконверсії при застосуванні IPVf у різних країнах, зокрема до поліовірусу типу 2, проти якого переважно і спрямований цей захист, свідчать про те, що 2 дози IPVf є недостатніми для формування належного рівня специфічного імунітету до цього вірусу, який би усунув на майбутнє ризики формування та циркуляції.
- Нові інактивовані поліомієлітні вакцини із штамів Себіна, які натепер активно розробляються, а дея- кі вже застосовуються, є перспективними препаратами для кінцевої стадії ерадикації поліомієліту. Але зараз вони потребують подальших досліджень щодо тривалості збереження рівнів специфічних антитіл та безпеки й ефективності одночасного використання з іншими вакцинами, що передбачені календарями щеплень.
- В Україні епідемічну ситуацію з поліомієліту можна оцінити як вкрай незадовільну. Це підтверджується недопустимо низькими рівнями охоплення 3 щепленнями дитячого населення, починаючи з 2009 року. Протягом 2016–2021 рр. ці показники в Україні становили 55,2–83% із коливанням у межах адміністративних регіонів від 20,7% до 96,5%. Ефективність епідеміологічного нагляду за ГВП/поліомієлітом є дуже низькою, оскільки показник виявлення ГВП протягом 2020–2021 рр. був у 1,9–2,5 раза нижче індикаторного. Спалах поліомієліту 2021 р. фактично залишився без адекватної відповіді, яка б дозволила досягти несприйнятливості до поліовірусів достатнього прошарку дитячого населення. Військові дії в країні значно посилили вже наявну проблему.
- Єдиним способом спочатку знизити, а потім припинити ризики формування та циркуляції сVDPVs в Україні є перехід на застосування винятково IPV на всіх етапах вакцинації з обов’язковим дотриманням рівня охоплення щепленнями 95% і вище. Цю нашу рекомендацію внесено до оперативного плану реалізації Стратегії розвитку імунопрофілактики та захисту населення від інфекційних хвороб, яких можна запобігти шляхом проведення імунопрофілактики, на період до 2030 року, згідно з яким відмова від використання ОПВ та повний перехід на використання в Календарі щеплення винятково IPV заплановано на 1 квартал 2024 року.
Література
- Задорожна В. І. (за редакцією) Поліомієліт: імунопрофілактика та її вплив на еволюцію епідемічного процесу ДІА: Київ. 2012. 272 с.
- Задорожна В. І. Вчення Л. В. Громашевського про ліквідацію інфекційних хвороб у світлі сьогодення. Мат. наук.-практ. конф. Вчення Л. В. Громашевського на сучасному етапі розвитку епідемічного процесу: до 120-річчя від дня народження. К. 2007. 36–43 с.
- Centers for Disease Control and Prevention (CDC). Update on vaccine-derived polioviruses-worldwide, April 2011-June MMWR Morb Mortal Wkly Rep. 2012. Sep 21;61:741-6. PMID:22992572
- Global Polio Eradication Initiative (2015). Reporting and classification of vaccinederived polioviruses. http://www.org/ Portals /0/ Document/Resources/ VDPV_ ReportingClassification.pdf
- Shaghaghi M., Soleyman-Jahi S., Abolhassani H., Yazdani R., Azizi G., Rezaei N., Barbouche M. R., McKinlay M. A., Aghamohammadi. New insights into physiopathology of immunodeficiency- associated vaccine-derived poliovirus infection; systematic review of over 5 decades of data. Vaccine. 2018; 36:1711–1719. doi: 10.1016/j.vaccine.2018.02.059.
- Kitamura K., Shimizu H. The Molecular Evolution of Type 2 Vaccine- Derived Polioviruses in Individuals with Primary Immunodeficiency Diseases. 2021 Jul 20;13(7):1407. doi: 10.3390/v13071407. PMID: 34372613; PMCID: PMC8310373.).
- Polio Eradication Strategy 2022–2026: Delivering on a promise. Geneva: World Health Organization; 2021. Licence: CC BY-NC- SA 3.0 IGO
- World Health Organization. (2011). Second meeting of the GPEI Independent Monitoring Board = Deuxième réunion du Comité de suivi indépendant de l’Initiative mondiale pour l’éradication de la poliomyélite. Weekly Epidemiological Record = Relevé épidémiologique hebdomadaire, 86 (19), 177–179. https://apps. int/iris/handle/10665/241754
- Zimmermann M., Hagedorn B., Lyons H. Projection of Costs of Polio Eradication Compared to Permanent J Infect Dis. 2020 Feb 3;221(4):561–565. doi: 10.1093/infdis/jiz488. PMID: 31565733.).
- https://extranet.who.int/polis/public/CaseCount.aspx
- Hampton M., Farrell M., Ramirez-Gonzalez A., Menning L., Shendale S., Ian Lewis I et al. Cessation of use of trivalent oral polio vaccine and introduction of inactivated poliovirus vaccine worldwide, 2016. Weekly Epidemiological Record. 2016 Sep2; 36-37: 421–427.
- SAGE meeting, 10-12 April 2012: https://www.int/news– room/events/detail/2012/04/10/default-calendar/strategic- advisory-group-of-experts-on-immunization-(sage)— april-2012
- WHO, Polio Eradication & Endgame Strategic Plan 2013–2018. PEESP_EN_A4.pdf (polioeradication.org).
- World Health Organization. (2015). WHO global action plan to minimize poliovirus facility-associated risk after type-specific eradication of wild polioviruses and sequential cessation of oral polio vaccine use: GAPIII. World Health Organization. https://apps.who.int/iris/handle/10665/208872)
- Basic-indicators.pdf. https://www.paho.org/hq/dmdocuments/ 2015/
- Global Polio Surveillance Status Report, 2019.Geneva: World Health Organisation; 2019 (WHO/POLIO/19.08) Licence: CC BY- NC-SA 3.0 IGO
- AFP/polio data. https://extranet.who.int/polis/public/CaseCount. aspx)
- All children aged 1 to 9 in London to be offered a dose of polio vaccine https://www.gouk/government/news/all-children-aged-1-to-9- in-london-to-be-offered-a-dose-of-polio-vaccine
- European Centre for Disease Prevention and Control: Update on the polio situation in the EU/EEA and the world. 16 Aug 2022. https://www.ecdc.eu/en/news-events/update-polio- situation-eueea-and-world.
- https://extranet.who.int/polis/public/CaseCount.aspx.
- Zhang M., Yang, J., Bai Y. et al. Epidemiological survey and genetic characterization of type 3 vaccine-derived poliovirus isolated from a patient with four doses of inactivated polio vaccine in Henan Province, Infect Dis Poverty 2022; 11:https://doi.org/10.1186/s40249-022-01028-1. — https://idpjournal.biomedcentral.com/articles/10.1186/s4).
- WHO:(2021). 35th meeting of the European Regional Certification Commission for Poliomyelitis Eradication: 6–7 September 2021. Virtual meeting hosted in Copenhagen, Denmark. Copenhagen: WHO Regional Office for Europe; 2022. WHO-EURO-2022-5197-44961-64000-eng.pdf
- WHO:Circulating vaccine-derived poliovirus type 2 (cVDPV2) — Ukraine (22 Oct 2021) Circulating vaccine-derived poliovirus type 2 (cVDPV2) — Ukraine (who.int)
- WHO: Global Polio Eradication Initiative (2012). 7th meeting of the Independent Monitoring Board. Weekly Epidemiological Record., 87(51/52), 509–512.
- Задорожна В. І., Циганчук О. М. Поліомієліт: нові виклики на шляху до ерадикації Інфекційні хвороби. 4: 5–12 с.
- WHO:(2021). 35th meeting of the European Regional Certification Commission for Poliomyelitis Eradication: 6–7 September 2021. Virtual meeting hosted in Copenhagen, Denmark. Copenhagen: WHO Regional Office for Europe; 2022. WHO-EURO-2022-5197-44961-64000-eng.pdf).
- https:/ WHO. (2011). 25th meeting of the European Regional Certification Commission for Poliomyelitis Eradication: 23–25 August 2011. /www.who.int/_data/assets/pdf_ file/0019/164512/25th-RCC-Report-final.pdf).
- https://www.gouk/government/publications/inactivated- polio-vaccine-ipv-booster-information-for-healthcare.
- https://www.gouk/government/news/all-children-aged-1- to-9-in-london-to-be-offered-a-dose-of-polio-vaccine.
- https://www.cdc.gov/media/releases/2022/s0913-html
- https://reliefweb.int/report/world/epidemiological-update- detection-poliovirus-wastewater-considerations-region- americas-30-december-2022.
- https://www.int/emergencies/disease-outbreak-news/ item/2022-DON366
- https://polioeradication.org/where-we-work/israel/.
- https://vaccine-ecdc.europa.eu.
- https://www.int/teams/immunization-vaccines-and- biologicals/policies/position-papers/polio.
- Okayasu H., Sein C., Chang Blanc D., Ramirez Gonzalez A., Macklin G., Sutter RW. Intradermal Administration of Fractional Doses of Inactivated Poliovirus Vaccine: A Dose-Sparing Option for Polio Immunization. The Journal of Infectious Disease. 2017; 216 (1):161–167. https://doi.org/10.1093/infdis/jix038.
- Cadorna-Carlos , Vidor E., Bonnet M-C. Randomized controlled study of fractional doses of inactivated poliovirus vaccine administered intradermally with a needle in the Philippines, International Journal of Infectious Diseases. 2012; 16(2): e110-e116, ISSN 1201-9712, https://doi.org/10.1016/j. ijid.2011.10.002.
- World Health Organization. (2016). Meeting of the Strategic Advisory Group of Experts on immunization, October 2016 — conclusions and recommendations = Réunion du Groupe stratégique consultatif d’experts sur la vaccination, octobre 2016 — conclusions et recommandations. Weekly Epidemiological 2016. 91 (48): 561–582. World Health Organization. https://apps.who.int/iris/handle/ 10665/251816
- Xu J., Wang Q., Kuang S., Rong R., Zhang Y., Fu X., Tang W. Immunogenicity of sequential poliovirus vaccination schedules with different strains of poliomyelitis vaccines in Chongqing, China: a cross-sectional Hum Vaccin Immunother. 2021 Jul 3;17(7):2125-2131. doi: 10.1080/21645515.2020.1868269. Epub 2021 Mar 24. PMID: 33759702; PMCID: PMC8189127
- https://immunizationdata.who.int/pages/disease/polio. html?iso3code=&targetpop_general=
- https://privivki.uz/upload/Calendar_new_a5_flyer_rus.pdf.
- Satoh , Tanaka-Taya K., Shimizu H., Goto A., Tanaka S., Nakano T., Hotta C., Okazaki T., Itamochi M., Ito M., Okamoto- Nakagawa R., Yamashita Y., Arai S., Okuno H., Morino S., Oishi. Polio vaccination coverage and seroprevalence of poliovirus antibodies after the introduction of inactivated poliovirus vaccines for routine immunization in Japan. Vaccine. 2019 Mar 28;37(14):1964–1971. doi: 0.1016/j.vaccine.2019.02.034. Epub 2019 Mar 1. PMID: 30827736.),
- Liao , Li R., Li C., Sun M., Jiang S., Li Y., Mo Z., Xia J., Xie Z., Che Y., Yang J., Yin Z., Wang J., Chu J., Cai W., Zhou J., Wang J., Li Phase 3 Trial of a Sabin Strain-Based Inactivated Poliovirus Vaccine. J Infect Dis. 2016 Dec 1; 214(11):1728-1734. doi: 10.1093/ infdis/jiw433. Epub 2016 Sep 22. PMID: 27658691.
- Knowlson , Burlison J., Giles E., Fox H., Macadam AJ., Minor D. New Strains Intended for the Production of Inactivated Polio Vaccine at Low-Containment After Eradication. PLoS Pathog. 2015; 11(12): e1005316. https://doi.org/10.1371/journal. ppat.1005316)
- Cramer J. P., Jimeno J., Han H. H., Lin S., Hartmann K., Borkowski A., Sáez-Llorens X. Safety and immunogenicity of experimental stand-alone trivalent, inactivated Sabin-strain polio vaccine formulations in healthy infants: A randomized, observer-blind, controlled phase 1/2 Vaccine. 2020 Jul 14; 38(33):5313-doi: 10.1016/j.vaccine.2020.05.081. Epub 2020 Jun 17. PMID: 32563609; PMCID: PMC7347011.
- First Sabin Inactivated Poliovirus Vaccine (sIPV) Achieved WHO first_sipv_prequalified_by_who.pdf (dcvmn. org)),
- Vaccines | Free Full-Text | Safety, Immunogenicity and Lot-to- Lot Consistency of Sabin-Strain Inactivated Poliovirus Vaccine in 2-Month-Old Infants: A Double-Blind, Randomized Phase III Trial (mdpi.com)
- Hotta C., Ogawa T., Shirasawa H. Surveillance ofimmunity acquired from poliovirus immunization including vaccination with the Sabin strain-derived inactivated vaccine. Hum Vaccin Immunother. 2019;15(5):1154–1159. doi: 1080/21645515.2019.1572408. Epub 2019 Mar 11. PMID: 30676843; PMCID: PMC6605838.
- Jiang R., Liu X., Sun X., Wang J., Huang Z., Li Ch., Li Z., Zhou J. et al. Immunogenicity and safety of the inactivated poliomyelitis vaccine made from Sabin strains in a phase IV clinical trial for the vaccination of a large Vaccine. 2021; 39 (9):1463–1471, ISSN 0264-410X, https://doi.org/10.1016/j.vaccine.2021.01.027.
- Sun , Xu Y., Tang F., Xiao Y., Wang Z., Wang B., Zhu X., Yang and Chen H. Immunogenicity and safety of concomitant administration of the chinese inactivated poliovirus vaccine with the diphtheria-tetanus-acellular pertussis (DTaP) vaccine in children: A multicenter, randomized, noninferiority, controlled trial. Front. Immunol. 2022; 13:905634. doi:10.3389/ fimmu.2022.90563.
- Vaccines | Free Full-Text | Safety, Immunogenicity and Lot-to- Lot Consistency of Sabin-Strain Inactivated Poliovirus Vaccine in 2-Month-Old Infants: A Double-Blind, Randomized Phase III Trial (mdpi.com)
- Intravacc’s Sabin Inactivated Polio vaccine (sIPV), out-licensed to LG Chem, receives WHO prequalification (prnewswire.com).
- Zaman K., Bandyopadhyay A. S., Hoque M. et al. Evaluation of the safety, immunogenicity, and faecal shedding of novel oral polio vaccine type 2 in healthy newborn infants in Bangladesh: a randomised, controlled, phase 2 clinical trial. Lancet 2022; published online Dec 7. https://doi.org/10.1016/S0140- 6736(22)02397-2. https://www.thelancecom/journals/lancet/ article/PIIS0140-6736(22)02397-2/fulltext .
- World Health (2020). Implementation of novel oral polio vaccine type 2 (nOPV2) for circulating vaccine- derived poliovirus type 2 (cVDPV2) outbreak response: technical guidance for countries. World Health Organization. https://apps.who.int/iris/handle/10665/333520. License: CC BY-NC-SA 3.0 IGO.
- Van Damme P., De Coster I., Bandyopadhyay A., Revets H., Withanage , De Smedt P. et al. The safety and immunogenicity of two novel live attenuated monovalent (serotype 2) oral poliovirus vaccines in healthy adults: a double-blind, single- centre phase 1 study. Lancet. 2019; 394(10193):148-158. doi:10.1016/S0140-6736(19)31279-6.
- Bandyopadhyay S., Zipursky A. A novel tool to eradicate an ancient scourge: the nOPV2 story. Lancet Infect Dis. 2022; (published online Sept 23) http://doi.org/10.1016/S1473- 3099(22)00582-5.
- WHO Global Polio Eradication Initiative Polio today — circulating vaccine-derived poliovirus.https://polioeradication.org/polio- today/polio-now/this-week/circulating-vaccine-derived- poliovirus/ Date: 2022 Date accessed: September 8,
- Martin J., Burns C. C., Jorba J. et al. Genetic characterization of novel oral polio vaccine type 2 viruses during initial use phase under Emergency Use Listing-worldwide, March–October, 2021. MMWR Morb Mortal Wkly Rep. 2022; 71: Р. 786–790.
- John TJ., Dharmapalan D. Lessons from Vaccine-Related Poliovirus in Israel, UK and USA. Vaccines. 2022; 10(11): 1969. https://www.mdpi.com/2076-393X/10/11/1969.
