Мавпяча віспа: Нові аспекти нинішнього спалаху
УДК 616.98:578.821.5
В.І. Задорожна, В.Р. Шагінян, Т.А. Сергеєва
ДУ «Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України»
Спалах мавпячої віспи (МРХ), пов’язаний з вірусом МРХ (МРХV) клади ІІb, що розпочався в кінці квітня 2022 р., поширюється світом. За пів року (травень–жовтень 2022 р.) до епідемічного процесу вже залучилися 102 неендемічні країни, в яких зареєстровано близько 76 тис. випадків. Спостерігається стійка передача вірусу від людини до людини (раніше — не > 5 передач), що свідчить про процес його адаптації до людської популяції, який продовжується. Розвивається формування нової паразитарної системи, в якій людина стає головним видовим хазяїном збудника. За масштабами і швидкістю поширення спалах переходить в епідемію з потенціалом до пандемії. Епідемічні особливості МРХ під час теперішнього спалаху (механізми та шляхи передачі збудника, групи ризику, віковий розподіл, летальність) відрізняються від тих, що спостерігалися на ендемічних територіях. Основною групою ризику є чоловіки, що мають секс із чоловіками. Однак МРХ може реєструватися серед будь-яких груп населення, незалежно від віку, статі, сексуальної орієнтації. ВІЛ-інфекція може сприяти більш важкому перебігу МРХ, а супутні інфекції, що передаються статевим шляхом, можуть викликати атипову клінічну картину захворювання. Багато випадків не мають класичної клінічної картини. Може бути відсутня етапність захворювання, виявлятися лише одне або кілька уражень в генітальній або періанальній зонах, які прогресують асинхронно і не поширюються далі тощо. З огляду на це, має бути настороженість не тільки лікарів-інфекціоністів, сімейних лікарів, але й лікарів іншого профілю, до яких пацієнт із МРХ може звернутися відповідно до локалізації уражень та основної симптоматики.
У вересні 2022 р. ВООЗ було суттєво змінено визначення випадку МРХ (підозрілий, ймовірний, підтверджений, скасований) та сформульовано нову дефініцію контактної особи з урахуванням тих клініко-епідеміологічних особливостей, які характерні для теперішнього спалаху.
ДНК МРХV, зокрема й з низьким значенням циклу ампліфікації (Ct), дослідники виявляють у слині, назофаренгіальних, ректальних змивах, шкірних ураженнях, області ануса і геніталій, крові, сечі, спермі. Все частіше надходять повідомлення про виявлення вірусу в спермі. Хоча це питання потребує подальших досліджень, з’являється все більше аргументів про існування статевого шляху передачі вірусу, який викликав теперішній спалах. Офіційна статистика випадків МРХ є значно заниженою. Цьому сприяє недосконалість епідеміологічного нагляду за МРХ, стигматизуюче ставлення в деяких країнах до груп ризику, низька обізнаність медичного персоналу та населення. Зазначене в помітній мірі стосується й України. Тут ще додаються проблеми, пов’язані з широкомасштабними військовими діями.
Серед дослідників обговорюється питання використання результатів дослідження вірусного навантаження у стічній воді (число копій ДНК МРХV на 1 мл) в епідеміологічному нагляді за МРХ для підвищення його ефективності.
Ключові слова: мавпяча віспа, вірус мавпячої віспи, епідеміологічний нагляд, клініко-епідеміологічні особливості, реемерджентна інфекція.
V.I. Zadorozhna, V.R. Shaginyan, T.A. Sergeeva
MONKEYPOX: NEW ASPECTS OF THE ONGOING OUTBREAK
SI «The L.V. Gromashevsky Institute of Epidemiology and Infectious Diseases of NAMS of Ukraine»
The monkeypox outbreak (MPX) associated with the MPX virus (MPXV) clade IIb, which began in late April 2022, is spreading around the world. For six months (May-October 2022), 102 non-endemic countries have already been involved in the epidemic process, in which about 76 thousand cases have been registered. There is
a steady transmission of the virus from person to person (previously — not > 5 transmissions), which indicates the ongoing process of its adaptation to the human population. The formation of a new parasitic system continues, in which man becomes the leading species host of the pathogen. In terms of scale and speed of spread, the outbreak turns into an epidemic with the potential for a pandemic. The epidemic features of this MRC outbreak (mechanisms and routes of pathogen transmission, risk groups, age distribution, mortality) differ from those observed in endemic areas. The main risk group are men who have sex with men. However, MPX can be registered among any population groups, regardless of age, gender, sexual orientation. HIV infection may contribute to a more severe course of MRC, and co-infection and sexually transmitted infections may cause an atypical clinical picture of the disease. Many cases do not have a classic clinical picture. There may be no staging of the disease, there may be only one or a few lesions in the genital or perianal areas that progress asynchronously and do not spread further, etc. From this point of view, vigilance should be not only on the part of infectious disease doctors, family doctors, but also other doctors, to whom a patient with MRC can turn, depending on the location of the lesions and the leading symptoms. In September 2022, WHO significantly changed the case definition of MRS (suspected, probable, confirmed, canceled) and contact. Those clinical and epidemiological features that are characteristic of the current outbreak were taken into account. DNA of MPXV, including those with a low amplification cycle (Ct), is found in saliva, nasopharyngeal, rectal washings, skin lesions, anus and genitals, blood, urine, and semen. There are more and more reports of virus detection in semen. While this issue requires further research, there is growing evidence that there is a sexual route for the virus that caused the current outbreak. The official statistics of MRC cases are significantly underestimated. This is facilitated by the imperfection of MRC epidemiological surveillance, the stigmatized attitude towards risk groups in some countries, and low awareness of medical personnel and the public. Here it is still necessary to take into account the problems associated with large-scale military operations. Among researchers, the question of using the results of the study of viral load in wastewater (the number of copies of MPXV DNA per ml) to improve the effectiveness of MPX surveillance is being discussed.
Key words: monkeypox, monkeypox virus, epidemiological surveillance, clinical and epidemiological features, re-emergent infection.
Спалах мавпячої віспи (МРХ), що розпочався у квітні 2022 р., стрімко поширюється світом. Із кожним днем зростає зареєстрована кількість випадків цієї інфекції, а кількість країн, для яких ця хвороба не була історично ендемічною, перевищила 100. Зокрема, на 22 серпня 2022 р. було повідомлено про 42 954 випадки у 95 країнах світу, серед яких 88 — країни, які історично не відносилися до ендемічних, і в яких кількість випадків на цю дату становила 42 567.
А вже на 27 жовтня 2022 р. ці показники відповідно становили 76 713 випадків, 109 країн, 75 822 випадки та 102 країни [1]. Тільки 891 із загальної кількості випадків було зареєстровано в 7 ендемічних країнах. Також треба враховувати, що офіційні дані є значно нижчими фактичних, оскільки епідеміологічний нагляд і можливість ідентифікувати збудника МРХ у багатьох країнах ще не налагоджені.
Зазначене свідчить про той факт, що почалася активна передача вірусу мавпячої віспи (MPXV) від людини до людини і подальша його адаптація до людської популяції. Стає зрозуміло, що ця інфекція починає набувати нових ознак, відмінних від відомої з 1970 р. зоонозної хвороби МРХ, коли було зареєстровано її перший випадок у людини. На жаль, не тільки населення, але і вчені поки що до кінця не розуміють наслідків цієї відомої нам вже понад 50 років інфекції, яка почала показувати «нове обличчя».
Враховуючи появу нової біологічної загрози, метою роботи було проаналізувати епідеміологічні, вірусологічні та клінічні особливості МРХ як реемерджентної інфекції в процесі формування нової паразитарної системи.
У нашій попередній роботі більш детально висвітлено вірусологічні та епідеміологічні особливості МРХ в історичному аспекті та на початку поширення теперішнього спалаху [2]. У цій статті, яка є продовженням попередньої, історію МРХ представлено настільки, щоб можна було простежити динаміку епідемічного процесу цієї інфекції. Більший акцент було зроблено на сучасній епідемічній ситуації з урахуванням тих наукових даних, які швидко накопичуються, а їх аналіз дозволяє науково обґрунтовано оцінювати ситуацію та робити певні прогнози. Викладену в нашій попередній статті інформацію ми намагалися не повторювати. Також надзвичайно актуальною є нещодавно опублікована оглядова стаття наших колег [3].
Історія МРХ як ендемічної зоонозної інфекції.
Протягом понад 40 років від реєстрації першого випадку мала місце спорадична передача MPXV від тварин до людини, яка не супроводжувалася подальшою тривалою передачею від людини до людини.

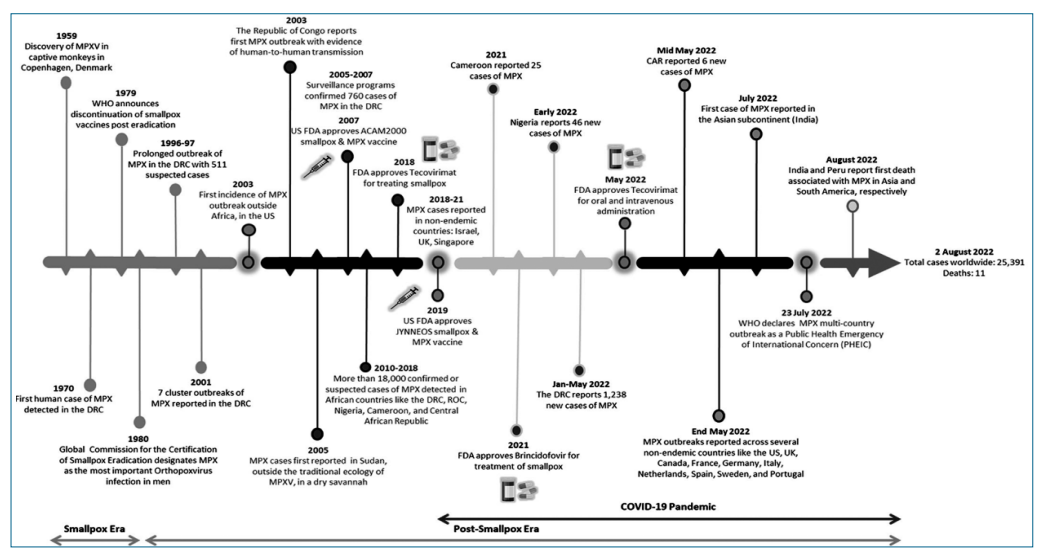
Рис. 1. Основні історичні дані щодо МРХ [4].
І фактично до 2003 р. МРХ, як хвороба людини, не виходила за межі Африки. Схематично хронологію поширення цієї хвороби в історичному плані та пов’язані з нею події надано на рисунку 1 з урахуванням періодів боротьби з натуральною віспою та пандемії COVID-19 [4].
За результатами молекулярно-епідеміологічних досліджень було відомо про 2 клади MPXV — центральноафриканську (басейну Конго) та західноафриканську. Вони значно відрізнялися за рівнем вірулентності, що підтверджено як епідеміологічними спостереженнями, так і експериментально.
На моделях мавп cynomolgus було показано відмінність у вірулентності 2 ізолятів вірусу (штам MPXV- ZAI-V79 — басейну Конго та штам MPXV-COP-58 — Західної Африки). Відмінності, які були отримані при секвенуванні цих вірусів, дозволили припустити, що з підвищеною вірулентністю пов’язані гени D10L, D14L, B10R, B14R та B19R, серед яких D14L визначено як провідного кандидата вірулентності [5].
Протягом 1970 — 25 лютого 2018 рр. у 9 країнах Африки (Габон, Ліберія, Камерун, Кот-д’Івуар, Нігерія, Республіка Конго, Судан, Сьєрра Леоне, ЦАР) було зареєстровано 273 випадки МРХ [6]. Водночас, починаючи з 2005 р., у Демократичній республіці Конго (ДРК) щороку траплялося понад 1 000 підозрілих випадків. Спалах у Нігерії в 2017–2018 рр. (122 випадки) був несподіваним і став підтвердженням зростання активності циркуляції MPXV у Західній Африці, для якої раніше ризик МРХ вважався низьким [7]. При цьому частка вторинних випадків (передача від людини до людини) зросла до 30%. Для спалахів у басейні річки Конго було характерне їх самозатухання з репродуктивним числом менше одиниці [8].
Багато років продовжується дискусія щодо визначення природного резервуару MPXV, оскільки, не дивлячись на назву хвороби, мавпи не є єдиними і головними природними хазяями цього вірусу.
Незвичайним виявився спалах у США у 2003 р., коли в 6 штатах країни захворіла 81 людина, а передачі від людини до людини зареєстровано не було. Джерелом збудника інфекції стали лугові собачки (гризуни), що були отримані від дистриб’ютора тварин, і які інфікувалися від гризунів, завезених із Гани [9]. Представники трьох африканських родів гризунів (Cricetomys, Graphiurus, Funisciurus), завезених із Гани, виявилися інфікованими MPXV. Лугових собачок (Cynomys ludovicianus), які від них інфікувалися і стали джерелом збудника інфекції для людей, у подальшому почали використовувати при експериментальних дослідженнях як тварин для відтворення МРХ. В експерименті була доведена можливість інфікування обома кладами MPXV гамбійських хом’якових щурів (Cricetomys gambianus) із відтворенням захворювання і тривалістю визначення вірусу до 56 днів після зараження. Зроблено припущення, що ці тварини можуть брати участь у підтримці циркуляції MPXV у популяціях диких ссавців [10, 11]. Схожі дані були отримані й в іншому дослідженні, де показано можливість відтворення інфекції як при внутрішньошкірному введенні вірусу, так і при інтраназальному. У першому варіанті розвивалася клініка МРХ, у другому був субклінічний перебіг. Незалежно від шляху введення вірусу, у всіх тварин вірус визначали в порожнині рота і носа. Також спостерігалася його репродукція в шкірі, яка не супроводжувалася візуальними проявами. Такі результати дозволили авторам зробити висновок про те, що ці тварини можуть відігравати важливу роль у передачі вірусу людям, оскільки на них полюють для споживання, і можливо, що інфіковані гамбійські хом’якові щури виділяють MPXV без прояву явних клінічних ознак [12]. В африканських мотузяних білок при експериментальному інфікуванні також спостерігалися клінічні прояви МРХ, що разом із позитивними даними серологічного моніторингу в Центральній Африці свідчить про їх роль як природного джерела збудника [13].
Відповідно до тієї чи іншої епідемічної ситуації, яка, головним чином, визначалася вірулентністю та трансмісивністю збудника, періодично змінювалося ставлення до MPXV як потенційного біотерористичного агента [8]. Певні застереження з цього приводу виникли у 1996–1997 рр. під час спалаху в ДРК, але невдовзі були спростовані. У 2008 р. J.R. Weaver та S. N. Isaacs підкреслили необхідність детального молекулярно-генетичного дослідження MPXV, зокрема обох його клад, у порівнянні з іншими поксвірусами, щоб розуміти зв’язок певних генів з вірулентністю вірусу. Підкреслювалося, що MPXV є важливим новим патогеном, який, відповідно до серологічних досліджень в Африці, може бути причиною більшої кількості випадків інфекції, ніж передбачалося, і якщо вірулентний штам буде занесений у середовище, де люди не мають імунітету до ортопоксвірусів, це може призвести до епідемії [14]. У листопаді 2017 р. Centers for Disease Control and Prevention (CDC, США) організували неофіційну консультацію щодо МРХ із дослідниками, партнерами в галузі охорони здоров’я, міністрами охорони здоров’я, експертами з проблеми МРХ у зв’язку зі зростанням кількості випадків МРХ серед людей в деяких центральнота західноафриканських країнах і розширенням кількості ендемічних країн. Наголошувалося на необхідності усунення прогалин в епідеміології МРХ, екології вірусу, діагностиці, лікуванні, профілактиці та контролі МРХ [6].
Під час спалаху в Нігерії в 2017–2018 рр., який поширився на 17 штатів цієї країни, було зареєстровано 122 випадки МРХ (69% припадало на чоловіків), віковий спектр захворілих був широким (2–50 років, середній вік — 29 років), зареєстровано 7 померлих (летальність — 6%). Спочатку інфікування відбувалося від тварин, згодом — від людини до людини, у тому числі було відмічено внутрішньолікарняну передачу збудника і занесення у тюремний заклад, що було підтверджено на основі геномного аналізу вірусу та наявності багаторазового його занесення [15]. Це змусило знову повернутися до цього вірусу як потенційної біологічної загрози. З часом траплялися продовження спалаху в Нігерії та початок низки завізних випадків в Азію, Європу та США. Також із року в рік продовжувала зростати захворюваність на МРХ у ДРК, сягнувши в 2020 р. 6 200 випадків. Спорадичні спалахи реєструвалися в Камеруні та ЦАР [16–18].
Етіологічний агент теперішнього спалаху та деякі його характеристики.
MPXV належить до роду Orthopoxvirus родини Poxviridae. Це ДНК-місткий вірус, діаметр якого дорівнює 200–400 нм та який має ліпопротеїнову оболонку. Лінійна 2-ланцюгова ДНК складається з 197 тис. нуклеотидних послідовностей. Геном вірусу містить більшість генів, необхідних для молекулярних процесів, таких як реплікація ДНК, транскрипція та збірка віріону. Однак він повністю залежить від рибосоми хазяїна для трансляції мРНК вірусу. Реплікація вірусу відбувається в цитоплазмі клітин. MPXV існує в 2 інфекційних формах: внутрішній зрілий вірус (IMV — internal mature virus) і вірус із зовнішньою оболонкою (EMV — external enveloped virus). IMV позбавлені зовнішньої оболонки, отриманої від хазяїна, і мають численні поверхневі білки, які відіграють вирішальну роль у вході в клітину, злитті та подальшому патогенезі. EEV структурно подібні IMV, але мають зовнішню оболонку (рис. 2.) [4].
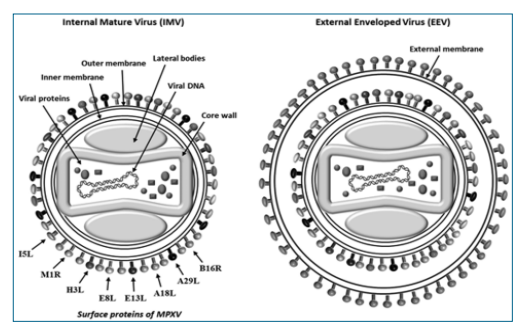
Рис. 2. Структура MPXV. Дві інфекційні форми MPXV: внутрішній зрілий вірус (IMV) і вірус із зовнішньою оболонкою (EMV) [4].
На тлі теперішнього спалаху, який значно відрізняється за клініко-епідеміологічними характеристиками від попередніх, а його етіологічний агент є генетичним відгалуженням від західноафриканської клади, запропоновано внести деякі зміни до класифікації MPXV. А саме виділити три монофілетичні клади — клада 1 (віруси Центральної Африки, або басейну річки Конго), клада 2 (західноафриканська: віруси, що визначалися в різних країнах в 1970–2017 рр.), клада 3 (західноафриканська: віруси 2017–2022 рр.). Відповідно позначити клади як І, ІІа та IIb, де клада I відповідає «кладі басейну річки Конго», тоді як клади IIa та IIb відповідають «західноафриканській кладі». Спалах 2022 р. був викликаний вірусами нової останньої клади (3, або ІІb), який запропоновано позначати як hMPXV з урахуванням нещодавно класифікованих ліній: A.1, A.1.1, A.2 та B.1 [19, 20].
Клініко-епідеміологічна характеристика теперішнього спалаху.
У вересні 2022 року ВООЗ було суттєво змінено визначення випадку МРХ (підозрілий, ймовірний, підтверджений, скасований) та сформульовано нову дефініцію контактної особи. Було ураховано ті клініко-епідеміологічні особливості, що характерні для теперішнього спалаху [21]. Для лабораторного підтвердження випадку рекомендовано застосовувати ПЛР, яка може бути загальною для OPXV або специфічною для MPXV (бажано). На додаток до ПЛР може проводитися секвенування. Країни мають обмінюватися даними генетичних послідовностей MPXV у доступних і загальнодоступних базах даних [22]. Це є важливо і для моніторингу можливих молекулярно-генетичних змін, і для молекулярно-епідеміологічного аналізу, який дозволяє простежити зв’язки між випадками навіть при відсутності епідемічного анамнезу.
Зараз все частіше описуються як перші випадки виявлення МРХ у тій чи іншій країні, на прикладі яких можна опосередковано оцінити їх готовність до нової біозагрози з урахуванням клінічної настороженості та спроможності клінічної бази, так і окремі клінічні випадки або групи випадків, за якими можна оцінити клінічні особливості МРХ та попередньо визначити основні тенденції щодо її епідеміологічної характеристики.
В Індії перші випадки МРХ були виявлені у двох осіб, які повернулися з ОАЕ. MPXV був виявлений у зразках із рото-, носоглотки, сечі, висипів, які були відібрані на 9-й день захворювання. За даними секвенування повного геному, віруси мали спорідненість на 99,91% і 99,96% відповідно зі штамом вірусу MPXV_USA_2022_ FL001 та належали до лінії А.2 hMPXV-1A клади 3. Такі дані опосередковано свідчать про поширення цієї генетичної лінії MPXV і в ОАЕ [20]. Привертає увагу той факт, що до цього про визначення вірусів згаданої генетичної лінії у 2022 р. повідомлялося в США (у двох пацієнтів), які мали спорідненість із вірусом від пацієнта при завізному випадку із Нігерії в Техас у 2021 р. [23, 24]. Однак обмежені епідеміологічні дані поки що не дозволяють повноцінно простежити передачу збудника цієї лінії під час теперішнього спалаху.
Перший випадок у Південній Кореї був зареєстрований у червні 2022 р. у пацієнта, який повернувся з Європи. Діагноз був поставлений на підставі результатів ізоляції вірусу на перещеплювальній культурі клітин Vero E6 із елюатів мазків ураженої шкіри з використанням електронної мікроскопії, ПЛР та секвенування. Вірус належав до західноафриканської клади. Передбачається, що цей штам (MPXV-ROK-P1-2022) надалі будуть використовувати як еталонний для діагностики МРХ [25].
У чотирьох пацієнтів у Німеччині позитивні результати ПЛР при дослідженні мазків із первинних уражень спостерігали до 22 днів від появи симптомів. ДНК вірусу визначали в мазках із глоткової та анальної слизової оболонки, сечі, насіннєвої рідини, крові та зразків неураженої шкіри. Виділення вірусу було позитивним у 6 із 14 зразків (уражена шкіра, глоткова та анальна слизові оболонки) [26].
У Північній Італії протягом 2 міс. (01.06.–01.08.2022 р.) виявлено 10 випадків МРХ, серед яких 8 молодих чоловіків, із них 6 чоловіків, які мають секс із чоловіками (ЧСЧ), і 2 жінки. 9 осіб мали в анамнезі недавні сексуальні контакти. Одна жінка, яка заперечувала сексуальні контакти, повідомила лише про відвідування зборів. Повногеномне секвенування послідовностей МРХV від 2 пацієнтів показало їх приналежність до клади 3, ліній B.1 та B.1.5 відповідно. Зокрема, послідовність ДНК вірусу від одного пацієнта була спорідненою з послідовностями вірусів з інших європейських країн та США, незважаючи на те, що цей пацієнт не повідомляв про поїздки або сексуальні контакти з іншими інфікованими людьми. Нуклеотидна послідовність МРХV від іншого пацієнта співпала з таким самим у пацієнта з Мілану, ймовірно, інфікування відбулося в результаті прямого статевого контакту. Той факт, що 2 МРХV належали до різних генетичних ліній, свідчить про можливість багаторазового незалежного занесення вірусу в цей регіон. Автори наголошують: незважаючи на те, що під час теперішнього спалаху MPX спостерігається висока частка випадків серед ЧСЧ, виявлення випадків серед гетеросексуалів та серед жінок без сексуальних факторів ризику має підвищити обізнаність лікарів про можливе поширення MPX серед населення загалом [27].
Крім зазначеної вище групи населення із сексуальними поведінковими ризиками, яка превалює серед захворілих на теперішній час, звертають увагу і на маргалізовані верстви населення, які мають підвищений ризик інфікування, зокрема, безхатьки та особи, що вживають психоактивні речовини. Для них ризик зараження визначається низькою якістю санітарно-гігієнічних умов, відсутністю доступу до стерильних ін’єкційних процедур тощо [28].
Щодо захворюваності на МРХ дитячого населення, то відповідно до досвіду Іспанії, яка натепер є однією з найбільш уражених країн, серед 4 663 випадків МРХ, зареєстрованих на 03.08.2022 р., тільки 16 пацієнтів (0,3%) були молодше 18 років. Серед них 4 дітей були молодше 4 (7, 10 і 13 місяців, 3 роки) і 12 були підлітками у віці 13–17 років. Три пацієнти молодшої вікової групи інфікувалися через побутовий контакт з їхніми батьками, в одного пацієнта шлях передачі був невідомий. Припускають, що у старшій віковій групі 9 хворих були інфіковані через контамінований матеріал у студії тату і пірсингу, 3 — у результаті сексуального контакту [29]. Для порівняння змін вікового розподілу захворювано-ті під час теперішнього спалаху можна навести той факт, що на початку 1980-х років частка дітей серед захворілих у ДРК становила близько 90% [30].
Проведено дослідження щодо ризику вторинної захворюваності на МРХ у дитячих організованих колективах (діти від 2 до 16 років) після підтвердженого випадку у дорослого, який працював у закладі. Протягом 28-денного спостереження серед щонайменше 340 дітей і понад 100 співробітників вторинних випадків МРХ зареєстровано не було. Серед них 21 особа отримала вакцину MVA-BN у термін до 14 днів після контакту із захворілим [31].
Імовірність серйозних ускладнень від МРХ аналізувалася за даними попередніх спалахів. Автори наголошують на тому, що хоча під час нинішнього спалаху у більшості випадків реєструються лише вогнищеві ураження шкіри, ускладнення можуть виникнути головним чином у дітей та пацієнтів з імунодепресією. Раніше повідомлялося про такі неврологічні прояви, як енцефаліт, судоми, запаморочення, біль, втома, порушення зору, фотофобія, головний біль і міалгія. Енцефаліт може бути зумовлений проникненням вірусу до центральної нервової системи або імуноопосередкованим процесом. У таких ситуаціях важливим є швидке дослідження цереброспінальної рідини. Довготривалі наслідки енцефалітів як ускладнень МРХ до кінця невідомі [30, 32, 33].
Вплив супутніх захворювань на перебіг МРХ. Під час теперішнього спалаху випадки МРХ часто реє-струються у пацієнтів із гострою ВІЛ-інфекцією [34]. ВІЛ-інфекція є фактором ризику щодо важчого перебігу МРХ та більшого вірусного навантаження ВІЛ у пацієнтів. Показано, що в осіб з ВІЛ-інфекцією позитивні результати ПЛР-дослідження зразків шкірних уражень можуть бути отримані навіть у пізній період захворювання, коли результати досліджень зразків крові та змивів із ротоглотки вже були негативні [35].
Піднімається питання щодо впливу супутніх інфекцій, які передаються статевим шляхом, на перебіг МРХ. Частка таких пацієнтів може сягати 76% [36]. Описано результати спостереження за 2 пацієнтами (ЧСЧ, сексуальні партнери) із ВІЛ-негативним статусом, в одного з яких було виявлено лише 2 ураження шкіри в області геніталій (мазки з яких були позитивними одночасно на MPXV і Treponema pallidum (ТР)) та лімфоаденопатія. У другого пацієнта протягом одного тижня були лихоманка, ректальні болі зі слизовими виділеннями та висипання. При клінічному огляді виявлено кілька типових псевдопустул. Мазки з ділянок ураження і горлянки були позитивними на MPXV, а серологічні тести відповідали пізньому латентному сифілісу. За результатами інцизійної біопсії в обох випадках, незважаючи на клінічні відмінності, при імуногістохімічному дослідженні були виявлені численні спірохетні елементи з одночасними характерними для MPXV цитопатичними змінами. Автори підкреслюють, що ці випадки ілюструють той діапазон клінічних проявів при одночасному перебігу сифілісу і MPX, з якими можуть зіткнутися клініцисти, з переважанням однієї форми над іншою і навпаки. Ймовірно, що клінічною особливістю такої ко-інфекції може бути наявність кореподібних/ макулопапульозних висипань, які не спостерігалися під час попередніх спалахів [37].
У Румунії описано випадок ко-інфекції МРХ, гепатиту А (ГА) і сифілісу у ВІЛ-позитивного пацієнта, який належить до групи ЧСЧ і повернувся з Іспанії, де мав сексуальні зв’язки з декількома партнерами. Перебіг захворювання мав ознаки МРХ із ураженням більшості ділянок тіла і гострого ГА з жовтяницею, симптоматикою з боку шлунково-кишкового тракту та підвищенням відповідних показників крові. Результати циклу ампліфікації ПЛР (Ct) на MPXV були нижчими при дослідженні матеріалу з висипів у порівнянні з назофарингальними змивами (відповідно 17,1 та 24,1). Кількість CD4 становила 936 клітин/мкл, а вірусне навантаження ВІЛ — 2 820 копій/мл, що, вірогідно, було пов’язано з недотриманням пацієнтом режиму антиретровірусної терапії. Крім іншої терапії, йому було призначено дексаметазон 8 мг на добу (протягом 5 днів). Через 3 тижні після виписки з лікарні, де пацієнт лікувався протягом 2 тижнів, ДНК MPXV все ще визначалася в мазках із носоглотки (Ct 39) [38]. Ми детально зупинилися на цьому випадку, оскільки тут, незважаючи на високі показники Ct при дослідженні біоматеріалу від пацієнта через 5 тижнів після початку захворювання, не можна виключити тривалої персистенції MPXV, чому може сприяти виражений імунодефіцитний стан та прийом гормональних препаратів. Усе вказане має подвійне епідеміологічне значення — як підвищений ризик довготривалого існування джерела збудника інфекції, особливо враховуючи анамнестичні дані пацієнта щодо нестійкої прихильності до лікування ВІЛ-інфекції та ін., так і ризик мутації MPXV.
Визначення МРХV у зразках різного виду біоматеріалу від хворих.
Важливими з точки зору активності тих чи інших механізмів, шляхів і факторів передачі збудника, визначення їх ролі в інтенсифікації епідемічного процесу є порівняльні дослідження щодо наявності та рівня вірусного навантаження МРХV у різних біологічних рідинах та на різних біотопах в організмі інфікованого.
За даними дослідження, проведеного в Ізраїлі, з паралельним використанням для дослідження матеріалу від пацієнтів із МРХ методу ПЛР та культури клітин BSC-1 було визначено значення Сt, яке корелює з відсутністю інфекційності вірусу. Воно становило 34,98. Це говорить про те, що в досліджуваному матеріалі значення Ct ≥ 35 передбачає відсутність або дуже низьку інфекційність. Щоб отримати порівняльне значення для різних лабораторій, була розрахована мінімальна кількість ДНК вірусу в клінічному зразку, яка б свідчила про його інфекційність. Цей показник становив 4 300 копій ДНК/мл [39]. Привертає увагу той факт, що в цьому дослідженні значення Сt в ректальних змивах становили 26,8 та 27,4, що, виходячи з наведених авторами розрахунків, свідчить про наявність у цих зразках життєздатного вірусу і не виключає, на наш погляд, можливості реалізації фекально-орального механізму передачі збудника.
При обстеженні 12 пацієнтів (147 проб матеріалу, зібраного протягом 4–16 днів від початку симптомів) ДНК МРХV визначено в шкірних ураженнях і слині всіх пацієнтів на тому чи іншому етапі дослідження (Сt 16,2–23,2 та 20,3–37,9 відповідно), у назофаренгіальних змивах і сечі 9 пацієнтів (Сt 25,4–40,0 та 19,1–40,0 відповідно), у спермі 7 із 9 обстежених (Сt 20,9–40,0), у ректальних змивах 10 пацієнтів (Сt 17,6–38,4), у фекаліях 8 пацієнтів (Сt 17,8–31,4) [40].
Обстеження 50 чоловіків (середній вік — 34 роки, 49 — ЧСЧ), хворих на МРХ, у Парижі (Франція), серед яких 22 мали ВІЛ-позитивний статус, при встановленні діагнозу і на 14-й день захворювання, показали зниження частоти виявлення MPXV на шкірі з 88% до 22%, в області анусу — з 71% до 9%, горлі — з 77% до 0, крові — з 29% до 5%, сечі — з 22% до 0, спермі — з 54% до 9%. Вірусне навантаження на початку захворювання було значно вищим на ураженнях шкіри (Ct 19,8) і в анальних зразках (Ct 20,9), ніж у горлі (Ct 27,2), крові (Ct 32,8), сечі (31,1) або спермі (Ct 27,8). Зі 107 зразків, взятих на 14-й день, тільки у 6 із 24 пацієнтів були зразки зі значенням Ct менше 35 (із них 4 — зі шкіри, 2 — з області ануса, 2 — сперми) [41].
Усе активніше в літературі дискутується питання ризику передачі MPXV із кров’ю/органами донорів. Ця небезпека пов’язана з наявністю віремії при МРХ, що не виключає присутності в крові життєздатного вірусу на певних стадіях інфекційного процесу [42]. Зазначене потребує розробки універсальних підходів до контролю донорської крові та препаратів крові щодо MPXV.
Аналогічні дискусії тривають щодо наявності життєздатного MPXV у спермі, зокрема, коли показники Ct становили менше 35. З огляду на це, особливу увагу привертають останні експериментальні дослідження зразків архівної тканини макак-крабоїдів з гострою та реконвалесцентною фазами інфікування MPXV, які належали до I або II клад. MPXV виявляли в інтерстиціальних клітинах і насіннєвих канальцях яєчок, а також у просвіті придатка яєчка, які є місцями продукування та дозрівання сперми. Гістологічні дослідження також показали запалення та некроз під час гострої фази захворювання. При цьому спостерігалося вивільнення більшості органів від MPXV під час реконвалесценції, включаючи загоєні ураження шкіри, але його можна було виявити протягом 37 днів після інфікування в яєчках реконвалесцентних макак. Автори підкреслюють можливість статевої передачі MPXV у людей [43].
Такі дані поступово наближують нас до висновку щодо існування статевого шляху передачі вірусу, що викликав теперішній спалах. Якщо так, то ця здатність разом з іншими особливостями забезпечила вірусу високий епідемічний потенціал.
Однак, питання щодо можливості статевого шляху передачі MPXV продовжує бути дискутабельним [44]. Необхідним є подальше накопичення матеріалу та його аналізу.
Потенційна роль біотичних й абіотичних об’єктів у епідемічному процесі МРХ.
Поступово накопичується інформація щодо тривалості збереження життєздатності MPXV поза організмом людини. Ще за рік до теперішнього спалаху на прикладі завізного випадку, пов’язаного із західноафриканським варіантом MPXV, було показано, що ДНК вірусу методом ПЛР визначали на пористих (90% від досліджених зразків) і непористих поверхнях (90,5%) протягом 15 днів після того, як пацієнт залишив помешкання. Однак життєздатність вірусу, яка визначалася за його репродукцією в культурі клітин, значно відрізнялася (p < 0,01) між вірусами, виявленими на пористих (6/10, 60%) порівняно з непористими (1/21, 5%) поверхнями. Ці результати показують, що пористі поверхні (наприклад, постільна білизна, одяг) можуть становити більший ризик як фактори передачі MPXV, ніж непористі (наприклад, метал, пластик) [45]. Є повідомлення, що для знезараження поксвірусу в продуктах харчування достатньою є їх обробка в режимі 70 °С 12 хвилин [46].
Під час теперішнього спалаху з’явилася інформація про передачу MPXV від людини до собаки (Париж, Франція), яка жила в домогосподарстві ЧСЧ. Симптоми у собаки (італійської борзої) з’явилися через 12 днів після початку захворювання у чоловіків, які проявлялися симптомами ураження шкіри і слизової оболонки, включаючи пустули на животі та тонку виразку анального отвору. В одного із пацієнтів і в собаки визначено вірус hMPXV-1 лінії B.1, який поширювався в неендемічних країнах із квітня 2022 року. Обидва штами виявилися на 100% гомологічними за послідовністю 19,5 тис. секвенованих пар основ [47]. Це повідомлення викликає велику тривогу щодо подальшої міжвидової передачі MPXV, який зараз поширюється, та ризиків його закріплення, саме як зоонозного, на неендемічних раніше територіях. Наші побоювання з цього приводу розділяють й інші автори [48], наголошуючи на необхідності дослідження цієї реемерджентної інфекції з позиції концепції «Єдиного здоров’я». Враховуючи ризики потрапляння цього вірусу в навколишнє середовище із фекаліями хворого та потенційно тривалого збереження життєздатності MPXV в абіотичних об’єктах, зазначене посилює необхідність моніторингу можливого інфікування тварин та подальшого зворотного повернення вірусу до людини.
Відповідно до того факту, що як і при інших інфекційних хворобах до офіційної статистики потрапляють далеко не всі випадки, запропоновано підсилити епідеміологічний нагляд за моніторингом МРХ стічних вод із визначенням в них концентрації геномних копій MPXV, які потрапляють у стічні води з фекаліями. За розрахунковими даними, концентрація вірусної ДНК становить у середньому 7,78 lg геномних копій на інфіковану людину, що дозволить робити перерахування в залежності від особливостей очисних споруд [49]. Про доцільність дослідження стічних вод у рамках дозорного епідеміологічного нагляду із визначенням вірусного навантаження повідомляють й інші дослідники. Дослідження, проведені на зразках стічних вод, відібраних у центрі Бангкоку (Таїланд) протягом травня–серпня 2022 р., показали, що ДНК MPXV уперше почали виявляти, починаючи з 2-го тижня червня, коли середнє число дорівнювало 16,4 копій/мл. На 1-му тижні липня цей показник підвищився до 45,92 копії/мл. Результати показують, що стічні води можуть бути додатковим об’єктом для виявлення вірусної ДНК і прогнозування майбутніх спалахів. Ці дані є надзвичайно показовими щодо ефективності моніторингу стічних вод, особливо, якщо їх порівняти з показником офіційно зареєстрованих випадків МРХ у Таїланді на 02.11.2022 р. (лише 12 випадків) [50].
Діагностика. Натепер, згідно з рекомендаціями ВООЗ, лабораторне підтвердження випадку МРХ має здійснюватися методом ПЛР та/або секвенування. Складовою ознакою ймовірного випадку, окрім клінічних ознак, можуть бути наявність антитіл IgM проти OPXV (протягом 4–56 днів після появи висипів); або 4-разове підвищення титру антитіл IgG на основі дослідження сироватки крові в гострий (до 5–7 днів) і реконвалесцентний (21 день і більше) періоди за відсутності недавньої вакцинації проти натуральної віспи/ віспи мавп або іншого відомого контакту з ортопоксвірусом (OPXV). Лабораторним підтвердженням також вважають позитивний результат тесту на ортопоксвірусну інфекцію (наприклад, OPXV-специфічна ПЛР без MPXV-специфічної ПЛР або секвенування) [21].
Водночас, пошук більш доступних і швидких методів діагностики продовжується. Повідомляється про розробку трьох рекомбіназних ізотермальних ампліфікаційних методів (recombinase-based isothermal amplification assay RPA/RAA) для швидкого визначення MPXV. Вони спрямовані на виявлення гену G2R MPXV, а межа чутливості становить 100 копій ДНК на реакцію. Методи є специфічними щодо MPXV, не мають перехресних реакцій з іншими поксвірусами, а результати можна отримати через 20–30 хвилин [51].
Лікування. Натепер CDC (США) розроблено тимчасові клінічні рекомендації щодо лікування МРХ, до яких внесено підтримуючу терапію та використання у разі потреби знеболюючих препаратів, що є достатнім для більшості пацієнтів із відсутністю порушень в імунній системі. Одночасно зазначається, що перебіг захворювання залежить від впливу багатьох чинників, зокрема, преморбідного стану, вакцинального анамнезу, а для деяких пацієнтів симптоматичного лікування може бути недостатньо. У таких випадках необхідно застосовувати додаткові препарати [53]. Офіційно затверджених специфічних препаратів для лікування МРХ поки що не існує, але для специфічного лікування натуральної віспи свого часу були розроблені три препарати — Tecovirimat (ще відомий як TPOXX, ST-246), Cidofovir (Viscide) та Brincidofovir (CMX001, Tembera) (табл.) [54], також існує внутрішньовенний специфічний імуноглобулін, який містить специфічні антитіла у відповідь на імунізацію вакциною проти натуральної віспи (Vaccinia Immune Globulin Intravenous (VIGIV). Саме ці лікарські засоби рекомендують використовувати для лікування МРХ у групах ризику. До них належать пацієнти з тяжким перебігом захворювання (геморагічні прояви; велика кількість уражень, що зливаються; сепсис; енцефаліт; очні або періорбітальні інфекції; інші стани, які потребують госпіталізації; залучення анатомічних ділянок, що може призвести до серйозних наслідків, включаючи рубцювання або стриктури — ураження, які безпосередньо зачіпають горлянку, викликають дисфагію, нездатність контролювати секрецію або потребу в парентеральному харчуванні; крайню плоть статевого члена, вульву, піхву, уретру або пряму кишку, які можуть спричинити стриктуру або вимагати катетеризації; анальні ураження, що заважають дефекації (наприклад, сильний біль); тяжкі інфекції (включаючи вторинні бактеріальні шкірні інфекції), особливо ті, що потребують для санації хірургічного втручання. Також ці препарати рекомендовані для пацієнтів із високим ризиком тяжкого захворювання (тяжкий імунодефіцит, пов’язаний із ВІЛ-інфекцією, лейкемією, лімфомою, генералізованим злоякісним новоутворенням, трансплантацією паренхіматозних органів, терапією алкілуючими агентами, антиметаболітами, високими дозами кортикостероїдів тощо; діти, особливо молодше 8 років; вагітні або годуючі грудьми; люди зі станом, що порушує цілісність шкіри, наприклад, атопічний дерматит, екзема, опіки, імпетиго, герпетичні ураження тощо) [52].
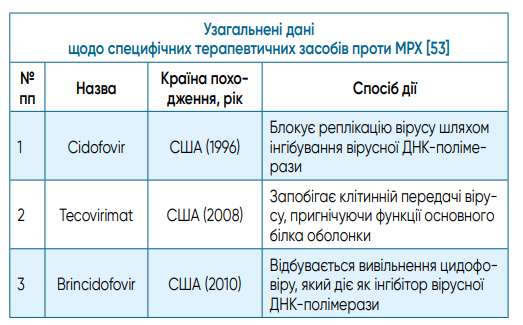
Водночас експерти зазначають, що Tecovirimat схвалено для лікування натуральної віспи, а не МРХ, як складову готовності до біотероризму, і що схвалення ґрунтувалося на даних, отриманих на тваринах. У даний час Tecovirimat показаний для застосування пацієнтам з ослабленим імунітетом або тяжким перебігом захворювання, що характеризується поширеними ураженнями, сильним болем та/або системними проявами. Його користь поки що є невизначеною у разі застосування для пацієнтів з імунодефіцитом при легкому перебігу хвороби. Зазначене потребує проведення відповідних рандомізованих досліджень [54].
Для розширення спектру препаратів для лікування МРХ із застосуванням обчислювального підходу AlphaFold2, який використовується для прогнозування білкових структур, зокрема протеомів людини та вірусу SARS-CoV-2, були визначені білки-мішені (B4R, A42R, PRO132, VITF3L, E8L, I1L, D10L, P28 та G9R) щодо
деяких вже відомих терапевтичних препаратів. Трипановий синій і цефарантин продемонстрували значну афінність зв’язування з усіма зазначеними білками. Трипановий синій діє за рахунок утворення водневих зв’язків, сольових містків і гідрофобної та пі-катіонної взаємодії з білками. Цефарантин показав високу афінність зв’язування з I1L, VITF3L, A42R і E8L через гідрофобні взаємодії та утворення водневих зв’язків [55].
Питання вакцинопрофілактики та її ефективності.
З використанням класичної епідеміологічної моделі для прогнозування SIR (сприйнятливі/інфіковані/розподіл імовірності інфікування) розраховано, наскільки вакцинація проти натуральної віспи, яка була припинена в 1980 р., ефективна проти МРХ під час теперішнього спалаху. Розрахунки проводили на прикладі населення міста Відня (Австрія). При цьому враховували віковий індукований вакциною імунітет проти МРХ та ймовірність зараження залежно від віку у загальній популяції. Серед осіб, які народилися до 1981 р., середній захисний ефект, викликаний вакциною, становить 50,4%, натомість у тих, хто народився пізніше, захист відсутній. Загальна ймовірність зараження після контакту з інфікованим пацієнтом в умовах Відня склала 73,8%, що перевищує граничне значення 46,9% для того, щоб пацієнт заразив хоча б одну людину (R ≥ 1,0) [56]. За результатами математичного моделювання було зроблено висновок про 65% ефективності вакцинації [57].
Отримані результати свідчать, що в сучасних умовах той рівень популяційного імунітету, який залишився внаслідок вакцинації проти натуральної віспи в минулому, не зможе суттєво вплинути на подальше поширення МРХ.
Якщо виходити з даних, які відомі щодо натуральної віспи, то рівень летальності від цієї інфекції серед вакцинованих і невакцинованих вагітних був вищим, ніж серед невагітних [58, 59]. При загальній летальності серед нещеплених 30%, серед невакцинованих вагітних цей показник становив 63%, для вакцинованих ці показники становили відповідно 2% і 26%. Ризик викидня і мертвонародження є високим протягом усієї вагітності (39–45%) [60]. Відповідно до таких даних, можна припустити, що й для MPXV характерною буде вертикальна передача.
Дійсно, таке дослідження було проведено в одній із лікарень ДРК (2007–2011 роки), де лікувалися 4 вагітні пацієнтки з МРХ [61]. Із 4 вагітних жінок 1 народила здорову дитину, у 2 були викидні в першому триместрі, а в 1 була внутрішньоутробна смерть плода, при цьому у мацерованого мертвонародженого були виявлені дифузні шкірні макулопапілярні ураження шкіри голови, тулуба та кінцівок, включаючи кисті рук і підошви ніг. На підставі цієї інформації інші дослідники [62] підкреслювали той факт, що оскільки MPXV є потенційним агентом біотероризму, фетальна передача додає ще один рівень загрози, який треба сприймати серйозно. Спостереження, проведені впродовж 1980–1985 рр.
у Заїрі (ДРК) за участі 282 хворих на МРХ, показали, що перебіг захворювання у вакцинованих і невакцинованих пацієнтів значно різнився [30]. Плеоморфізм і «кропінг» як при натуральній віспі спостерігалися у 31% вакцинованих і 18 невакцинованих пацієнтів. Летальних випадків серед вакцинованих не зареєстровано. Серед захворілих переважали діти до 15 років (90%).
Попередні дослідження щодо ефективності проти МРХ 1 дози вакцини Modified Vaccinia Ankara, яка сво-го часу була створена для профілактики натуральної
віспи, у досліджуваній групі 626 осіб із помірним та високим ризиком інфікування MPXV, при спостереженні протягом 10 днів після вакцинації показала 100% ефективність [63]. Однак такий короткий період спостереження є недостатнім для висновків і прийняття відповідних рішень, виходячи із загальної практики оцінки ефективності вакцин, а також того факту, що інкубаційний період МРХ може складати 21 день.
CDC (США) розроблено керівництво щодо вакцинації проти МРХ і натуральної віспи, яке було оновлено під час теперішнього спалаху (22.06.2022 р.). Зокрема для МРХ передбачено проведення як доконтактної (pre-exposure prophylaxis — PrEP) вакцинації (для лабораторних і медичних працівників), так і профілактичної. Зазначено, що ефективність вакцинації становить не менше 85%. Пропонується використовувати ліцензовані у США вакцини проти натуральної віспи ACAM2000 та JYNNEOSTM (ще відома як Imvamune, або Imvanex). Повідомляється, що післяконтактна вакцинація, проведена протягом 4 днів, захищає від захворювання. Вакцинація у період 4–14 днів після контакту зменшує прояви захворювання. ACAM2000 містить атенуйований вірус, здатний до реплікації, тому протягом 28 днів вакцинований зобов’язаний дотримуватися запобіжних заходів, щоб не інфікувати навколишніх. Вакцинальний комплекс складається з 1 щеплення, яке вводиться внутрішньошкірно. JYNNEOSTM містить живий вірус, який не здатний до реплікації, вводиться двічі підшкірно з інтервалом 4 тижні, а людина вважається вакцинованою через 2 тижні після 2-го щеплення. Вакцина ACAM2000 є більш реактогенною, ніж JYNNEOSTM [64]. Існує ще одна вакцина для профілактики натуральної віспи (APSV — Aventis Pasteur Smallpox Vaccine) зі здатністю до реплікації вірусу, що входить до її складу. Очікується, що її профіль безпеки буде подібний до ACAM2000®. Це вакцина, яка ще досліджується.
Вакцина JYNNEOS, що ліцензована у США, вводиться за зазначеною вище схемою в дозі 0,5 мл. Однак у зв’язку з дефіцитом вакцини на тлі поширення спалаху МРХ ця вакцина 09.08.2022 р. отримала дозвіл від FDA (США) на екстрене використання для осіб ≥ 18 років у дозі 0,1 мл при внутрішньошкірному введенні (2 щеплення), що суттєво розширило наявний запас вакцини. Загалом, починаючи з 22.05 по 10.10.2022 р., у США введено 931 155 доз вакцини JYNNEOS (628 610(67,5%) — 1-а доза, 301 770 (32,4%) — 2-а доза). Вакцина використовувалася у 49 штатах, а для звітності запроваджена система, що створена для вакцинації проти COVID-19. Автори оцінюють такий початок використання вакцини для профілактики МРХ, як першу широкомасштабну спробу надання вакцини особам із підвищеним ризиком інфікування [65].
З’являються повідомлення про експериментальні роботи щодо нових вакцин проти МРХ. Із застосуванням методів біота імуноінформатики було продемонстровано перспективність конструювання мультиепітопної вакцини шляхом використання трьох імовірних антигенних позаклітинних білків: купінового домену білка, АВС-транспортера АТФ-зв’язуючого білка та домену білка DUF192. Передбачається використовувати E. сoli як продуцента цих білків. Основними якостями вакцинної конструкції були індукція як клітинного, так і гуморального імунітету. Було показано, що така вакцина є потенційно ефективною проти MPXV, повинна мати високу імуногенність, цитокінпродукуючу активність, антигенність, бути нетоксичною, неалергенною і стабільною. Автори роблять висновок про перспективність її додаткових експериментальних випробувань [66].
Соціальна обізнаність, повнота виявлення випадків МРХ, підходи до неспецифічної профілактики.
На прикладі соціальних досліджень, проведених у Саудівській Аравії, показана низька обізнаність населення щодо МРХ. Серед 480 опитуваних лише 48% мали високі знання. Джерелами інформації для респондентів були соціальні мережі (75%), телебачення і радіо (45,6%), родина чи друзі (15,6%). На постачальників медичних послуг припадало лише 13,8%. Загалом знання про цю інфекцію оцінено як дещо низькі. Наголошується на нагальній потребі в просвітництві громадськості щодо МРХ. Така робота є необхідною з точки зору профілактики та зниження тягаря на охорону здоров’я та економіку країн [67]. Дослідження, проведені в цій країні серед студентів медичної школи з найвищим рейтингом, показали також їх низький рівень знань щодо МРХ (72%). Цей показник був значно вищим серед старшокурсників [68].
Щодо захворюваності на МРХ, то необхідна обережність при інтерпретації її низьких рівнів у країнах Східної Європи, оскільки вони позитивно корелюють з інтенсивністю скринінгу на хламідіоз/гонорею, сифіліс та індексом веселки (Rainbow Index). Тобто є припущення, що більш стигматизуюче ставлення до гомосексуалізму, як і при ВІЛ-інфекції, сприяє недовиявленню випадків МРХ у цих країнах [69].
Як показали ретроспективні дослідження на прикладі 35 випадків МРХ, зареєстрованих до 08.08.2022 р. у системи Atrium Healt (регіон Великий Шарлотт, США), 16 пацієнтам при перших зверненнях за медичною допомогою діагноз МРХ поставлено не було. Найчастішими причинами проведення обстеження на МРХ були ураження геніталій, що супроводжувалися болем, проктит та біль у горлі. Серед тих, хто мав кілька відвідувань, середня кількість симптомів до постановки діагнозу MPX склала 1,6, сягаючи діапазону до 5. Час від початку симптомів до тестування дорівнював 2–14 днів (у середньому 6 днів). Подальше моделювання показало, що відповідно до прогнозу в 95% випадків тестування буде проведено протягом 12,4 дня (інтервал 9,7–17,1 дня). Ця затримка може бути викликана кількома причинами, включаючи недостатню поінформованість пацієнтів про MPX, недостатнє розпізнавання цієї інфекції медичними працівниками та/або відсутність доступності тестування. Визначено, що кожне звернення по медичну допомогу до тестування на MPX призвело до приблизно 3,2 додаткового контакта (1,7–4,7; P < 0,001), з яких 2,3 вважалися з високим або проміжним ризиком (P < 0,001) [70].
Натепер звертають велику увагу на необхідність профілактики МРХ серед секс-працівників, для чого потрібне партнерство між організаціями секс-працівників, громадськими лідерами та союзниками-клініцистами. При цьому наголошується, що для того, щоб не допустити помилок, які траплялися на початку поширення ВІЛ-інфекції, коли основним об’єктом із профілактичного погляду стали ЧСЧ, необхідно не забувати про таку велику групу ризику, як секс-працівники [71].
Світ має великий досвіт протидії пандеміям, який нам надав COVID-19. Він повинен аналізуватися і за певних умов екстраполюватися на протидію іншим емерджентним інфекціям, зокрема й МРХ.
У відповідь на поширення МРХ необхідна належна стратегія боротьби з боку системи охорони здоров’я. Основною проблемою натепер може бути недостатній рівень знань щодо розпізнавання хвороби та низька поінформованість про проблему. Звичайні заходи охорони здоров’я, у тому числі перевірки в аеропортах для запобігання завезенню хвороб, діють у низці країн, але МРХ все ще може поширюватися на нові регіони, такі як Південно-Східна Азія. Необхідним є об’єднання зусиль експертів з усього світу, які дійсно розуміються на проблемі МРХ [72]. На наш погляд, навіть масові перевірки в аеропортах та на іншому транспорті, не стануть настільки ефективними, щоб належним чином запобігти завезенню збудника в будь-яку країну, особливо враховуючи інкубаційний період МРХ, який може бути достатньо тривалим.
Водночас прикладом швидкої організації епідеміологічного нагляду за МРХ є Китай. У червні 2022 р. Національна комісія охорони здоров’я сформулювала і випустила Протокол діагностики та лікування МРХ, Технічні рекомендації з боротьби та профілактики МРХ для підвищення ефективності виявлення та реєстрації хворих на МРХ у медичних установах. Митна служба розробила Циркуляр про запобігання завезенню МРХ до Китаю, ще більш посиливши контроль за карантином людей і тварин, які в’їжджають до Китаю. Для досягнення мети раннього виявлення випадків та своєчасного блокування можливої передачі збудника поточна стратегія епіднагляду Китаю спрямована на високу чутливість епіднагляду, включаючи всі типи і рівні медичних закладів та цільові групи населення [73].
У США 11 жовтня 2022 р. Annals of Internal Medicine та Американський коледж лікарів зібрали групу експертів для надання на віртуальному форумі інформації клініцистам про профілактику та лікування МРХ, оскільки більшість лікарів з цією хворобою ніколи раніше не стикалися. Було зроблено наголос на тому, що поки недостатньо інформації про лікування та специфічну профілактику цієї інфекції. Щодо неспецифічних заходів профілактики, то, незважаючи на тривалий термін збереження вірусу на предметах довкілля, не спостерігалося випадків внутрішньолікарняної інфекції та навіть серед медичного персоналу, який по-різному дотримувався заходів індивідуального захисту. Дуже важливий момент, на якому було зроблено наголос учасниками дискусії, полягає в тому, що особи, раніше вакциновані проти натуральної віспи, не повинні вважати, що їхня попередня вакцинація захищає їх від МРХ. Якщо є ризик зараження МРХ, вони мають отримати вакцину JYNNEOS [55].
Отже, система біобезпеки кожної країни повинна забезпечувати швидке реагування на будь-яку біологічну загрозу, зокрема появу емерджентної та реемерджентної інфекції шляхом оперативної організації належного епідеміологічного нагляду як головної складової цієї системи.
Ситуація в Україні. Згідно з даними ЗМІ, зі слів Головного державного санітарного лікаря України на 27.10.2022 р. в Україні виявлено 4 випадки МРХ, які між собою не мають епідемічного зв’язку. Перший випадок був лабораторно підтверджений 15.09.2022 р., 4-й — 27.09.2022 року. Також зазначається, що ризик поширення МРХ в Україні оцінюється, як низький [74]. Водночас, за даними CDC (США), на 28.10.2022 р. в Україні зареєстровано 5 випадків МРХ. На офіційному сайті Центру громадського здоров’я МОЗ України інформація щодо МРХ є вкрай обмеженою [75]. Треба зазначити, що Україна має спільний кордон із багатьма країнами, де на 31.10.2022 р. уже діагностовано набагато більше випадків МРХ, ніж в Україні, незважаючи на те, що кількість населення в деяких із них є набагато меншою (Польща — 206, Угорщина — 80, Румунія — 42, Словаччина — 14 випадків) [76]. При цьому треба враховувати ті припущення щодо неповної реєстрації випадків МРХ у країнах Східної Європи, про які було зазначено вище [70]. Високими є показники захворюваності в країнах Західної Європи [77], з якими Україна також має інтенсивні міграційні зв’язки (наприклад, Іспанія — 7 317, Франція — 4 094, Німеччина — 3 662 випадки). Також не можна недооцінювати той факт, що в жодному випадку в Україні не було простежено епідемічний ланцюг поширення збудника, тобто можна передбачати, що невідома частка випадків залишилася неідентифікованою. Зазначене опосередковано свідчить про недосконалість системи епідеміологічного нагляду за МРХ в Україні та необхідність підвищення її ефективності. На наш погляд, також немає підстав розглядати Україну, особливо враховуючи військові дії, інтенсивну міграцію населення, прогалини в епідеміологічному нагляді тощо, як країну з низьким ризиком поширення МРХ, у той час, як на світовому рівні ВООЗ визнала теперішній спалах МРХ надзвичайною ситуацією охорони здоров’я та явний ризик такого поширення різними країнами. Треба підкреслити, що на момент цього визнання у світі було зареєстровано лише близько 16 тис. випадків у 47 країнах, а на 28.10.2022 р. їх кількість збільшилася до майже 77 тис. у 109 країнах.
Висновки
- Спалах МРХ 2022 р. демонструє безпрецедентне поширення вірусу мавпячої віспи за межі ендемічного регіону. За пів року (травень–жовтень 2022 р.) до епідемічного процесу залучено 102 неендемічні країни, в яких зареєстровано близько 76 тис. випадків. Спостерігається стійка передача вірусу від людини до людини (раніше — не більше 5 передач), що свідчить про процес продовження його адаптації до людської популяції. За масштабами і швидкістю поширення спалах переходить в епідемію з потенціалом до пандемії.
- Вірус клади ІІb (або 3) відрізняється своїми біологічними особливостями (вірулентність, контагіозність, тропність тощо), які необхідно вивчати і стежити за їх можливими змінами. Формування нової (або оновленої) паразитарної системи продовжується.
- Епідеміологічні особливості (механізми та шляхи передачі збудника, групи ризику, віковий розподіл, летальність) теперішнього спалаху, викликаного MPXV клади ІІb (або 3), відрізняються від тих, що спостерігалися раніше на ендемічних територіях. Також спостерігається тенденція до втрачання зоонозного характеру хвороби, викликаної вірусом цієї клади. Водночас у подальшому не виключено ризику залучення до паразитарної системи нових видових хазяїв, що потребує постійного моніторингу в рамках концепці «Єдиного здоров’я».
- Основною групою ризику є чоловіки, які мають секс із чоловіками. Однак МРХ може реєструватися серед будь-яких груп населення, незалежно від віку, статі, сексуальної орієнтації. ВІЛ-інфекція може сприяти більш важкому перебігу МРХ, а супутні інфекції, що передаються статевим шляхом — атиповій клінічній картині хвороби.
- Багато випадків не мають класичної клінічної картини. Може бути відсутня етапність захворювання, виявлятися лише одне або кілька уражень в генітальній або періанальній зонах, які прогресують асинхронно і не поширюються далі тощо. З огляду на це, варто зосередити особливу увагу щодо МРХ не тільки лікарів-інфекціоністів, сімейних лікарів, але й лікарів іншого профілю, до яких пацієнт може звернутися відповідно до локалізації уражень та основної симптоматики.
- Дослідження щодо виявлення МРХV у різних біологічних рідинах та на різних біотопах в організмі інфікованого мають як діагностичне, так і епідеміологічне значення. Дослідники з різних країн виявляли у слині, назофаренгіальних, ректальних змивах, шкірних ураженнях, зоні анусу і геніталій, крові, сечі, спермі ДНК МРХV, у тому числі й з низьким значенням циклу ампліфікації. Все більше повідомлень про виявлення вірусу в спермі, що, незважаючи на дискутабельність цього питання і необхідність подальших досліджень, поступово наближує нас до висновку щодо існування статевого шляху передачі вірусу, який викликав теперішній спалах.
- Незважаючи на реєстрацію випадків МРХ уже в 102 неендемічних країнах, справжня поширеність цієї хвороби залишається під питанням. Необхідна обережність при інтерпретації її низьких рівнів у деяких країнах, зокрема країнах Східної Європи, оскільки є припущення, що стигматизуюче ставлення до гомосексуалізму сприяє недовиявленню випадків МРХ.
- Відповідно до спорадичної реєстрації випадків МРХ в Україні, відсутності виявлених епідемічних зв’язків між випадками на тлі значно вищих показників захворюваності на МРХ у країнах, що межують з Україною, країнах Західної Європи, наявності постійних інтенсивних міграційних потоків між Україною і цими країнами, необхідним є створення в Україні належної системи епідеміологічного нагляду за МРХ з метою своєчасного запровадження належних протиепідемічних та профілактичних заходів.
Література
- Centers for Disease Control and Prevention (CDC). 2022 Monkeypox Outbreak Global Map. https://www.cdc.gov/poxvirus/monkeypox/ response/2022/world-map.html)
- Задорожна В.І., Сергеєва Т.А., Шагінян В.Р. Мавпяча віспа: реемерджентна інфекція та подальші епідеміологічні ризики. Журнал Національної Академії Медичних наук України. 2022. Том 28, № 2, С. 399–421
- Івахів О.Л., Качор В.О., Вишневська Н.Ю. Віспа мавп — новий виклик людству? Інфекційні хвороби. 2022. 2(108)., С. 4–15
- Insights into the monkeypox virus: Making of another pandemic within the pandemic? / Chadha J., Khullar L., Gulati P., Harjai K. // Environmental Microbiology. Environ Microbiol. 2022. 24, P. 4547– 4560.
- Chen N, Li G, Liszewski MK, et al. Virulence differences between monkeypox virus isolates from West Africa and the Congo basin. Virology. 2005. 340(1), P. 46-63. DOI:10.1016/j.virol.2005.05.030.
- Weekly epidemiological record (WER) no.11, 16 March 2018, Emergence of monkeypox in West Africa and Central Africa 1970–2017.
- Rezza G. Emergence of human monkeypox in west Africa. Lancet Infect Dis. 2019. Aug. 19(8), P. 797–799. doi: 10.1016/S1473–3099(19)30281-6. Epub 2019 Jul 5. PMID: 31285141.
- Di Giulio DB Eckburg PB Human monkeypox: an emerging zoonosis. Lancet Infect Dis. 2004. 4, P. 15–25.
- Update: Multistate Outbreak of Monkeypox — Illinois, Indiana, Kansas, Missouri, Ohio, and Wisconsin, 2003. https: //www.cdc.gov/ mmwr/preview/mmwrhtml/mm5226a5.htm
- Hutson CL, Nakazawa YJ, Self J, et al. Laboratory Investigations of African Pouched Rats (Cricetomys gambianus) as a Potential Reservoir Host Species for Monkeypox Virus. Plos Neglected Tropical Diseases. 2015. 9(10), e0004013. DOI: 10.1371/journal.pntd.0004013. PMID: 26517724; PMCID: PMC4627651)
- Weiner Z.P., Salzer J.S., LeMasters E. et al. Characterization of Monkeypox virus dissemination in the black-tailed prairie dog (Cynomys ludovicianus) through in vivo bioluminescent imaging. Plos one. 2019. 14(9), e0222612. DOI: 10.1371/journal.pone.0222612. PMID: 31557167; PMCID: PMC6762066
- Falendysz E.A., Lopera J.G., Lorenzsonn F. et al. Further Assessment of Monkeypox Virus Infection in Gambian Pouched Rats (Cricetomys gambianus) Using In Vivo Bioluminescent Imaging. Plos Neglected Tropical Diseases. 2015. 9(10), e0004130. DOI: 10.1371/journal. pntd.0004130. PMID: 26517839; PMCID: PMC4627722
- Falendysz .EA., Lopera J.G., Doty J.B. et al. Characterization of Monkeypox virus infection in African rope squirrels (Funisciurus sp.). Plos Neglected Tropical Diseases. 2017. Aug; 11(8), e0005809. DOI: 10.1371/journal.pntd.0005809. PMID: 28827792; PMCID: PMC5578676
- Weaver JR, Isaacs SN. Monkeypox virus and insights into its immunomodulatory proteins. Immunol Rev. 2008 Oct. 225, р.96-113. doi: 10.1111/j.1600-065X.2008.00691.x. PMID: 18837778; PMCID: PMC2567051
- Yinka-Ogunleye A, Aruna O, Dalhat M, Ogoina D, McCollum A, Disu Y, Mamadu I, Akinpelu A. еt al. CDC Monkeypox Outbreak Team. Outbreak of human monkeypox in Nigeria in 2017-18: a clinical and epidemiological report. Lancet Infect Dis. 2019 Aug. 19(8),872-879. doi: 10.1016/S1473-3099(19)30294-4. Epub 2019 Jul 5. PMID: 31285143.
- Monkeypox — Singapore (who.int). https://www.who.int/emergencies/disease-outbreak-news/item/16-may-2019-monkeypox-sin-gapore-en
- Monkeypox outbreak in Nigeria — On Medicine (biomedcentral.com). https://blogs.biomedcentral.com/on-medicine/2019/06/04/ monkeypox-outbreak-in-nigeria/
- Past U.S. Cases and Outbreaks | Monkeypox | Poxvirus | CDC), (Monkeypox the United States of America (who.int). https:// www.who.int/es/emergencies/disease-outbreak-news/item/ monkeypox—the-united-states-of-america
- Happi Ch, Adetifa I, Mbala P, Njouom R, Nakoune E, Happi A, et al. Urgent need for a non-discriminatory and non-stigmatizing nomenclature for monkeypox virus. News Directory World News Headlines [Internet]. 2022 Jun 10. [cited 2022 Aug 2]. Available from: https://virological.org/t/urgent-need-for-a-non-discriminatory and-non-stigmatizing-nomenclature-for-monkeypox-virus/853
- Pragya D. Yadav, Aravind Reghukumar, Rima R. Sahay et al. First two cases of Monkeypox virus infection in travellers returned from UAE to India, July 2022, 05 August 2022, PREPRINT (Version 1) available at Research Square [https://doi.org/10.21203/rs.3.rs-1927719/v1]
- Laboratory testing for the monkeypox virus: Interim guidance. Laboratory testing for the monkeypox virus: Interim guidance (who.int)
- Gigante CM, Korber B, Seabolt MH, Wilkins K, Davidson W, Rao AK, et al. Multiple lineages of Monkeypox virus detected in the United States, 2021–2022 bioRxiv [Internet]. 2022 [cited 2022 Aug 11];2022.06.10.495526. Preprint from bioRxiv, 11 Jun 2022. Available from: https://www.biorxiv.org/content/10.1101/2022.06.10.49552 6v1
- Kmiec D, Kirchhoff F. Monkeypox: A New Threat? Int J Mol Sci. 2022 Jul 17;23(14):7866. doi: 10.3390/ijms23147866. PMID: 35887214; PCID: PMC9321130. https://www.ncbi.nlm.nih.gov/pmc/articles/ PMC9321130/
- J.W. Kim, M. Lee, H.Shin, C.H. Choi, M.M. Choi, J.W. Kim et al. Isolation and identification of monkeypox virus MPXV-ROK-P1-2022 from the first case in the Republic of Korea. Osong Public Health Res Perspect. 2022; 13(4):308–311. Publication date (electronic): 2022 August 31. doi : https://doi.org/10.24171/j.phrp.2022.0232
- Daniel Hornuss, Theo Daehne, Veronika Goetz, Matthias Mueller, Susanne Usadel, Alexandra Lorz, Maja Mockenhaupt et al. Transmission characteristics, replication patterns and clinical manifestations of human monkeypox virus — an in-depth analysis of four cases from Germany, Clinical Microbiology and Infection, 2022, ISSN 1198-743X, https://doi.org/10.1016/j. cmi.2022.09.012 (https://www.sciencedirect.com/science/ article/pii/S1198743X22005006
- Loconsole, D., Sallustio, A., Centrone, F., Casulli, D., Accogli, M., Saracino, A., Foti, C. et al. Monkeypox Virus Infections in Southern Italy: Is There a Risk for Community Spread? Int. J. Environ. Res. Public Health 2022, 19, 11719. https://doi.org/10.3390/ijerph191811719
- Beyond sex: Human Monkeypox Virus is an Emerging Threat to Marginalized Populations J.A. Barocas, S.A. Strathdee — Open Forum Infectious Diseases, 2022. — ofac551.pdf (silverchair.com)
- Aguilera-Alonso D., Alonso-Cadenas J.A., Roguera-Sopena M., Lorusso N, Miguel LGS, Calvo C. Monkeypox virus infections in children in Spain during the first months of the 2022 outbreak. Lancet Child Adolesc Health. 2022 Sep 1. S.2352–4642(22)002504. doi: 10.1016/S2352-4642(22)00250-4. Epub ahead of print. PMID: 36058226.
- Ježek Z. Human monkeypox: clinical features of 282 patients. J Infect Dis 1987. 156:293-8. doi: 10.1093/infdis/156.2.293.
- Very low risk of monkeypox among staff and students after exposure to a confirmed case in educational settings, England, May to July 2022. S.N. Ladhani, F. Aiano, D.S. Edwards, S. Perkins… — Eurosurveillance, 2022. — eurosurv-27-40-1.pdf (eurosurveillance.org)
- Marzia Puccioni-Sohler, Carolina Marques de Oliveira, Marcelo Namen, Clarissa R. Damaso, Emerging Monkeypox virus and neuroinflammatory disorders, IJID Regions, 2022. ISSN 2772-7076, https://doi.org/10.1016/j.ijregi.2022.08.015. (https://www. sciencedirect.com/science/article/pii/S2772707622001072)
- Badenoch J.B., Conti I., Rengasamy E.R., Watson C.J., Butler M, Hussain Z. [et al.] Neurological and psychiatric presentations associated with human monkeypox virus infection: a systematic review and meta-analysis. [Preprint]. Available at: https:// www.medrxiv.org/content/10.1101/2022.07.03.22277069v1. doi:10.1101/2022.07.03.22277069
- Brundu M., Marinello S., Scaglione V., Ferrari A., Franchin E., Mazzitelli M., Cattelan A.M. The first case of monkeypox virus and acute HIV infection: Should we consider monkeypox a new possible sexually transmitted infection? J Dermatol. 2022 Aug 22. doi: 10.1111/1346-8138.16556. Epub ahead of print. PMID: 35996211.
- Dominik Nörz, Thomas Theo Brehm, Hui Ting Tang, Ilka Grewe, Lennart Hermanussen, Hanna Matthews, Julia Pestel et al. Clinical characteristics and comparison of longitudinal qPCR results from different specimen types in a cohort of ambulatory and hospitalized patients infected with monkeypox virus., Journal of Clinical Virology, Volume 155, 2022. 105254, ISSN 1386-6532, https://doi.org/10.1016/j.jcv.2022.105254). (https://www. sciencedirect.com/science/article/pii/S138665322200186X)
- A. Català, P. Clavo Escribano, J. Riera, et al. Monkeypox outbreak in Spain: clinical and epidemiological findings in a prospective cross-sectional study of 185 cases. Br. J. Dermatol. 2022. 10.1111/ bjd.21790 10.1111/bjd.21790.
- Ramoni S., Maronese C.A., Morini N., Avallone G., Quattri E., Carrera C.G., Boggio F.L., Marzano A.V. Syphilis and monkeypox co-infection: Coincidence, synergy or asymptomatic carriage? Travel Med Infect Dis. 2022 Sep 5. 50:102447. doi: 10.1016/j. tmaid.2022.102447. Epub ahead of print. PMID: 36067937.
- Oprea C., Ionuț Popa, Ianache. I, Păun A., Vasile S., Grațiela Țârdei, Nica M.M., Popescu C.P., Ceausu E., Florescu S.A. Monkeypox, severe hepatitis A, and syphilis in an HIV returning traveler from Spain to Romania. Travel Med Infect Dis. 2022 Sep 8. 102455. doi: 10.1016/j.tmaid.2022.102455. Epub ahead of print. PMID: 36089283.
- Paran Nir, Yahalom-Ronen Yfat, Shifman Ohad, Lazar Shirley, BenAmi Ronen, Yakubovsky Michal, Levy Itzchak, Wieder-Feinsod Anat, Amit Sharon, Katzir Michal et al. Monkeypox DNA levels correlate with virus infectivity in clinical samples, Israel, 2022. Euro Surveill. 2022. 27(35):pii=2200636. https://doi.org/10.2807/1560-7917.ES.2022.27.35.2200636
- Peiró-Mestres Aida, Fuertes Irene, Camprubí-Ferrer Daniel, Marcos María Ángeles, Vilella Anna, Navarro Mireia et al. on behalf of the Hospital Clinic de Barcelona Monkeypox Study Group. Frequent detection of monkeypox virus DNA in saliva, semen, and other clinical samples from 12 patients, Barcelona, Spain, May to June 2022. Euro Surveill. 2022. 27(28): pii=2200503. https://doi. org/10.2807/1560-7917.ES.2022.27.28.2200503
- Palich R., Burrel S., Monsel G. et al. Viral loads in clinical samples of men with monkeypox virus infection: a French case series. Lancet Infect Dis. 2022. (published online Sept 29.) https://doi. org/10.1016/S1473-3099(22)00586-2
- Focosi D., Franchini M. What a Transfusion Physician Should Know about Monkeypox Virus: Barriers to and Risks for Transmission, and Possible Mitigation Strategies. Diagnostics (Basel). 2022s ep 11. 12(9), 2200. doi: 10.3390/diagnostics12092200. PMID: 36140601; PMCID: PMC9497883.
- Jun Liu Eric M. Mucker, Jennifer L. Chapman, April M. Babka, Jamal Gordon, Ashley V. Bryan, Jo Lynne W. Raymond, Todd M. Bell, Paul R. Facemire, Arthur J. Goff, Aysegul Nalca & Xiankun Zeng. Retrospective detection of monkeypox virus in the testes of nonhuman primate survivors. Nature Microbiology . 2022. vol. 7, P. 1980–1986.
- A. Reda, R. Sah, A.J. Rodriguez-Morales, J. Shah Viral replication and infectivity of monkeypox through semen.. Lancet Infect Dis. 2022 Nov. 22(11), P. 1531–1532. Published online 2022 Sep 29. doi: 10.1016/S1473-3099(22)00611-9
- Morgan C.N., Whitehill F, Doty J.B., et al. Environmental Persistence of Monkeypox Virus on Surfaces in Household of Person with Travel-Associated Infection, Dallas, Texas, USA, 2021. Emerging Infectious Diseases. 2022 Aug. 28(10). DOI: 10.3201/ eid2810.221047. PMID: 35951009.
- Estelle Chaix, Mickaël Boni, Laurent Guillier, Stéphane Bertagnoli, Alexandra Mailles, Catherine Collignon, Pauline Kooh, et al. Risk of Monkeypox virus (MPXV) transmission through the handling and consumption of food. Microbial Risk Analysis. 2022. 100237, ISSN 2352-3522, https://doi.org/10.1016/j.mran.2022.100237. (https:// www.sciencedirect.com/science/article/pii/S2352352222000354
- S. Seang, S. Burrel, E. Todesco, V Leducq, G. Monsel. Evidence of human-to-dog transmission of monkeypox virus. The Lancet, 2022 August 27. Vol 400, P. 658–659. www.thelancet.com
- Hannah Murphy & Hinh Ly The potential risks posed by interand in traspecies transmissions of monkeypox virus. Virulence. 2022. 13:1, P. 1681–1683, DOI: 10.1080/21505594.2022.2127199
- W. Chen, W. Chen. Model-Based Theoretical Evaluation of the Feasibility of Using Wastewater-Based Epidemiology to Monitor Monkeypox. Environ. Sci. Technol. Lett. 2022. 9, 9, P. 772–778.
- Dhammika Leshan Wannigama, Mohan Amarasiri, Parichart Hongsing, Cameron Hurst, Charin Modchang, Sudarat Chadsuthi, Suparinthon Anupong et al. Multiple traces of monkeypox detected in non-sewered wastewater with sparse sampling from a densely populated metropolitan area in Asia, Science of The Total Environment. 2022. 159816, ISSN 0048-9697, https://doi. org/10.1016/j.scitotenv.2022.159816. (https://www.sciencedirect. com/science/article/pii/S0048969722069169)
- Centers for Disease Control and Prevention (CDC). 2022 Monkeypox Outbreak Global Map (Data as of 02 Nov 2022) — https://www.cdc. gov/poxvirus/monkeypox/response/2022/world-map.html
- Mao L., Ying J., Selekon B., Gonofio E., Wang X., Nakoune E., Wong G., Berthet N. Development and Characterization of RecombinaseBased Isothermal Amplification Assays (RPA/RAA) for the Rapid Detection of Monkeypox Virus. Viruses. 2022. 14, 2112. https://doi. org/10.3390/ v14102112/
- Treatment Information for Healthcare Professionals | Monkeypox | Poxvirus | CDC (https://www.cdc.gov/poxvirus/monkeypox/ clinicians/treatment.html)
- S. Chatterjee, A.R. Sharma, M. Bhattacharya, K. Dhama, S.-S. Lee, Chakraborty. Relooking the monkeypox virus during this present outbreak: epidemiology to therapeutics and vaccines. Eur Rev Med Pharmacol Sci. 2022. Vol. 26, N. 16, P. 5991–6003. DOI: 10.26355/ eurrev_202208_29541
- Laine Ch., Mover D., Cotton D. Monkeypox: Challenging Clinical Questions. Annal of Internal Medcine. 14 October 2022. https:// doi.org/10.7326/M22-3040. — Monkeypox: Challenging Clinical Questions | Annals of Internal Medicine (acpjournals.org)
- Yang Q, Xia D, Syed AAS, Wang Z, Shi Y. Highly accurate protein structure prediction and drug screen of monkeypox virus proteome. J Infect. 2022 Aug 11, S0163-4453(22)00470-4. doi: 10.1016/j.jinf.2022.08.006. Epub ahead of print. PMID: 35964685; PMCID: PMC9367171
- Tibor Spath, Sophie Brunner-Ziegler, Tanja Stamm, Florian Thalhammer, Michael Kundi, Kim Purkhauser, Alessandra Handisurya. Modelling the protective effect of previous compulsory smallpox vaccination against human monkeypox infection: from hypothesis to a worst case scenario. International Journal of Infectious Diseases. 2022. ISSN 1201-9712, https://doi.org/10.1016/j.ijid.2022.09.022. (https:// www.sciencedirect.com/science/article/pii/S1201971222005215
- New numerical dynamics of the fractional monkeypox virus model transmission pertaining to nonsingular kernels. M Al Qurashi, S Rashid, AM Alshehri, F Jarad, F Safdar — Mathematical Biosciences …, 2022. — New numerical dynamics of the fractional monkeypox virus model transmission pertaining to onsingular ernels (aimspress.com)
- Fuentes-Zacarías P, Murrieta-Coxca JM, Gutiérrez-Samudio RN, Schmidt A, Schmidt A, Markert UR, Morales-Prieto DM. Pregnancy and pandemics: Interaction of viral surface proteins and placenta cells. Biochim Biophys Acta Mol Basis Dis. 2021, Nov 1. 1867(11), р.166218. doi: 10.1016/j.bbadis.2021.166218. Epub 2021 Jul 24. PMID: 34311080; PMCID: PMC9188292
- Hassett D.E. Smallpox infections during pregnancy, lessons on pathogenesis from nonpregnant animal models of infection. J. Reprod. Immunol. 2003. 60(1), P. 13-24. [PubMed] [Google Scholar]
- Nishiura H. Smallpox during pregnancy and maternal outcomes. Emerg. Infect. Dis. 2006. 12(7), P. 1119–1121. [PMC free article] [PubMed] [Google Scholar
- Mbala PK, Huggins JW, Riu-Rovira T, Ahuka SM, Mulembakani P, Rimoin AW, Martin JW, Muyembe JT. Maternal and Fetal Outcomes Among Pregnant Women With Human Monkeypox Infection in the Democratic Republic of Congo. J Infect Dis. 2017 Oct 17. 216(7), P. 824–828. doi: 10.1093/infdis/jix260. PMID: 29029147
- Neville K Kisalu, John L Mokili, Toward Understanding the Outcomes of Monkeypox Infection in Human Pregnancy, The Journal of Infectious Diseases. October 2017. Vol. 216, Issue 7, P. 795–797, https:// doi.org/10.1093/infdis/jix342
- Ronen Arbel, Yael Wolff Sagy, Roy Zucker et al. Vaccine Effectiveness of Modified Vaccinia Ankara in Human Monkeypox, 22. August 2022, PREPRINT (Version 1) available at Research Square [https://doi. org/10.21203/rs.3.rs-1976861/v1
- Monkeypox and Smallpox Vaccine Guidance | Monkeypox | Poxvirus | CDC. (https://www.cdc.gov/vaccines/hcp/vis/vis-statements/ smallpox-monkeypox.html)
- Kriss JL, Boersma PM, Martin E, et al. Receipt of First and Second Doses of JYNNEOS Vaccine for Prevention of Monkeypox — United States, May 22–October 10, 2022. MMWR Morb Mortal Wkly Rep. ePub: 21 October 2022. DOI: http://dx.doi.org/10.15585/mmwr. mm7143e2
- Asad Ullah, Farah Ali Shahid, Mahboob Ul Haq, Muhammad Tahir ul Qamar, Muhammad Irfan, Bilal Shaker, Sajjad Ahmad, Faris Alrumaihi, Khaled S. Allemailem & Ahmad Almatroudi. An integrative reverse vaccinology, immunoinformatic, docking and simulation approaches towards designing of multi-epitopes based vaccine against monkeypox virus, Journal of Biomolecular Structure and Dynamics. 2022. DOI: 10.1080/07391102.2022.2125441
- Alshahrani N.Z.; Alzahrani F.; Alarifi A.M.; Algethami M.R.; Alhumam M.N.; Ayied H.A.M.; Awan A.Z.; Almutairi A.F.; Bamakhrama S.A.; Almushari B.S.; et al. Assessment of Knowledge of Monkeypox Viral Infection among the General Population in Saudi Arabia. Pathogens 2022. 11, 904. https:// doi.org/10.3390/pathogens11080904
- Alshahrani N.Z., Mitra S., Alkuwaiti A.A., et al. Medical Students’ Perception Regarding the Re-emerging Monkeypox Virus: An Institution-Based Cross-Sectional Study From Saudi Arabia. Cureus. August 16, 2022. 14(8), e28060. doi:10.7759/cureus.28060
- Kenyon C. Is Monkeypox Being Underdiagnosed in Countries with More Stigmatizing Attitudes towards Men Who Have Sex with Men? A Simple Ecological Analysis. Epidemiologia 2022. № 3, 363–368. https://doi.org/10.3390/ epidemiologia303002
- Sampson M., Polk C., Fairman R., DeWitt M., Leonard M., Davidson L., Passaretti C. Monkeypox testing delays: The need for drastic expansion of education and testing for monkeypox virus. Infection Control & Hospital Epidemiology. 2022. 1–2. doi:10.1017/ice.2022.237
- Singer R.B., Johnson A.K., Zemlak J.L. et al. Monkeypox Prevention and Protecting Sex Workers: A Call to Action. Arch Sex Behav. 2022. https://doi.org/10.1007/s10508-022-02428-y
- Mungmunpuntipantip R., Wiwanitkit V. COVID-19 pandemic mistakes and monkeypox: Correspondence. Pulmonology. 2022 Oct 17. S2531-0437(22)00247-1. doi: 10.1016/j.pulmoe.2022.10.003. Epub ahead of print. PMID: 36274044; PMCID: PMC9574457
- Mungmunpuntipantip R., Wiwanitkit V. COVID-19 pandemic mistakes and monkeypox: Correspondence. Pulmonology. 2022 Oct 17:S2531-0437(22)00247-1. doi: 10.1016/j.pulmoe.2022.10.003. Epub ahead of print. PMID: 36274044; PMCID: PMC9574457)
- Lei Zhou, Yali Wang, Dan Li, Mengjie Han, Guoqing Shi, Qun Li. Consideration of Monkeypox Surveillance in China, 2022[J]. China CDC Weekly, 2022, 4(41): 924–928. doi: 10.46234/ccdcw2022.190
- В Україні зафіксували чотири випадки мавпячої віспи (ukrinform. ua), (Віспа мавп в Україні — скільки випадків Слово і Діло (slovoidilo.ua)
- Віспа мавп | Центр громадського здоров’я (phc.org.ua)
- https://www.cdc.gov/poxvirus/monkeypox/response/2022/world-map.html
